不同Wagner分级糖尿病足患者创面分离病原菌分布特点
杜 鸣, 刘佳霖, 许 鑫, 陈 敏, 廖亚玲, 夏 飞
(湖北省第三人民医院,湖北 武汉 430033)
糖尿病(diabetes mellitus)是一组以慢性血糖水平增高为特征的代谢性疾病。临床常见神经、血管神经性病变,以及细菌感染。因患者远端肢体供血不足,可致12%~25%患者发展为糖尿病足溃疡(diabetic foot ulcer,DFU)[1]。感染是促进糖尿病足进展与恶化的高危因素,一旦发生,将因肢体远端供血障碍而难以有效控制。临床糖尿病足合并感染者截肢率高于未发生感染者,约80%~85%糖尿病足患者被迫选择截肢[2-3]。由于糖尿病病程发展缓慢、治疗周期长,溃疡部位感染风险高,采取合理有效的临床抗感染治疗至关重要。本研究回顾性分析糖尿病足患者的临床资料与病原学资料,旨在深入了解糖尿病足细菌感染特征,以期为糖尿病足患者抗菌药物的合理应用提供依据。
1对象与方法
1.1 研究对象 2014年1月—2016年12月某三级甲等综合医院收治的糖尿病足患者,均依据世界卫生组织(WHO)制定的糖尿病诊断标准[4]进行诊断。
1.2 研究方法 回顾性调查糖尿病足患者的病历资料,调查内容包括性别、年龄、基础疾病、实验室检查结果、有无侵袭性操作、病原菌及其耐药情况等。并将患者按照检出细菌种类不同分为革兰阳性(G+)菌感染组、革兰阴性(G-)菌感染组、混合感染组。混合感染组患者为足部溃疡创面中同时检出多种G+菌和/或G-菌。
1.3 细菌培养与药敏试验 取糖尿病足渗出物标本接种于血琼脂平板,送35℃生化培养箱内培养24 h。细菌分离鉴定采用Phoenix-100全自动微生物鉴定与药敏分析仪及配套细菌鉴定卡。细菌培养发现多种菌混合感染则分别鉴定。细菌药敏试验采用K-B纸片扩散法,判断标准与结果解释参照2014年版美国临床实验室标准化协会(CLSI)标准。质控菌株为铜绿假单胞菌ATCC 27853,金黄色葡萄球菌ATCC 25923,大肠埃希菌ATCC 25922。
1.4 糖尿病足分级 依据Wagner糖尿病足分级标准[5],将研究对象按累及组织严重程度分为6级。0级为有发生足溃疡危险,目前足部皮肤无开放性病灶;1级为足部皮肤表面有溃疡,临床上无感染;2级为较深的足部组织溃疡,常合并软组织感染,无脓肿或骨的感染;3级为出现深部溃疡,常影响到骨组织,并有深部脓肿或骨髓炎;4级特征为缺血性溃疡,局部或足特殊部位的坏疽;5级为坏疽影响到整个足,大部分或全部坏疽。本研究将Wagner 1、2级定义为轻度糖尿病足溃疡,Wagner 3级为中度糖尿病足坏疽,Wagner4、5级为重度糖尿病足坏疽。
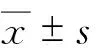
2结果
2.1 基本情况 2014年1月—2016年12月共有糖尿病足患者103例,其中男性68例,女性35例;年龄38~92岁,平均年龄(69.22±13.63)岁;糖尿病病程2个月~32年,平均病程(10.62±9.11)年。
2.2 不同病原菌类型患者临床特征 G+菌感染组患者39例,G-菌感染组患者50例,混合感染组患者14例。混和感染组患者年龄、病程高于其余两组(均P<0.05);混和感染组患者糖化血红蛋白(HbA1c)、降钙素原低于其余两组(均P<0.05);G+菌感染组患者中性粒细胞百分比高于其他两组(P<0.01);不同组别患者的性别、血白细胞计数比较,差异无统计学意义(均P>0.05)。见表1。

表1 不同病原菌类型糖尿病足患者临床特征
2.3 糖尿病足病原菌分布 依据Wagner糖尿病足分级标准,103例糖尿病患者可分为1级15例,2级38例,3级36例,4级8例,5级6例。共送检标本132份,检出菌株103株,阳性率为78.03%。其中G+菌44株,G-菌59株,检出率分别为33.33%(44/132)和44.70%(59/132)。G+菌以金黄色葡萄球菌(19株)和表皮葡萄球菌(11株)为主;G-菌以布氏柠檬酸杆菌(12株)、大肠埃希菌(11株)及铜绿假单胞菌(11株)为主。
随着Wagner分级增加,患者检出病原菌分布逐渐发生变化,混合感染率逐渐升高,单一细菌感染率呈下降趋势,见图1A。在混合感染患者中,G+菌与G-菌混合感染者比例同样随着Wagner分级升高而增加,并在Wanger 5级时达100%,见图1B。
轻度糖尿病足患者(Wagner1、2级)G+菌和G-菌构成比分别为23.30%(24/103)和20.39%(21/103),中、重度糖尿病足坏疽患者(Wagner3、4、5级)则分别为19.42%(20/103)和36.89%(38/103);不同病情患者感染细菌类别构成比较,差异具有统计学意义(χ2=4.57,P=0.03)。不同Wagner分级糖尿病足患者感染病原菌分布见表2。

图1 不同Wagner分级糖尿病足患者创面分离病原菌分布
表2不同Wagner分级糖尿病足患者感染病原菌分布(株)
Table2Distribution of pathogenic bacteria in patients with diabetic foot infection of different Wagner grades (Strain)

病原菌1级2级3级4级5级合计[株(%)]G+菌71786644(42.72) 金黄色葡萄球菌2832419(18.45) 表皮葡萄球菌4312111(10.68) 无乳链球菌01200 3(2.91) 化脓链球菌13111 7(6.80) 路登葡萄球菌01100 2(1.94) 溶血链球菌01010 2(1.94)G-菌614265759(57.28) 布氏柠檬酸杆菌1341312(11.65) 铜绿假单胞菌1232311(10.68) 大肠埃希菌1361011(10.68) 阴沟肠杆菌11311 7(6.80) 肺炎克雷伯菌01400 5(4.86) 鲍曼不动杆菌10100 2(1.94) 科氏柠檬酸杆菌12100 4(3.88) 奇异变形杆菌01100 2(1.94) 普通变形杆菌01300 4(3.88) 摩根摩根菌01000 1(0.97)合计1332341113103(100.00)
2.4 细菌耐药情况 G+菌中,金黄色葡萄球菌和表皮葡萄球菌多重耐菌构成比分别为52.63%[10/19,其中耐甲氧西林金黄色葡萄球菌(MRSA) 8株,占42.11%]和45.45%(5/11);G-菌中,布氏柠檬酸杆菌、铜绿假单胞菌、大肠埃希菌多重耐药菌构成比分别为75.00%(9/12)、72.73%(8/11)、90.91%(10/11,其中产超广谱β-内酰胺酶(ESBLs)菌株8株,占72.73%)。不同Wagner分级糖尿病足患者多重耐药菌分布见表3。
表3不同Wagner分级糖尿病足患者多重耐药菌分布(株)
Table3Distribution of multidrug-resistant bacteria in patients with diabetic foot of different Wagner grades (Strain)

多重耐药菌1级2级3级4级5级金黄色葡菌球菌01324表皮葡萄球菌01121布氏柠檬酸杆菌01413铜绿假单胞菌11123大肠埃希菌13510合计2714811
3讨论
糖尿病足是糖尿病的慢性并发症之一,有多种因素参与其发生发展过程[6]。感染被认为是糖尿病足患者的一种常见危险因素[7]。故在糖尿病足感染初期,及时而正确选用抗菌药物至关重要。同时,由于不同地区糖尿病足病原菌分布存在较大差异[8-10],故本研究从该院糖尿病足患者病原菌分布及耐药菌特点进行分析,以期促进糖尿病足患者抗菌药物的合理应用。
在一般患者的抗感染治疗过程中,白细胞计数、中性粒细胞百分比、降钙素原及C反应蛋白是重要的反映感染严重程度的指标,然而对于糖尿病足感染患者,其局部炎症症状或全身中毒症状不典型,白细胞计数往往无明显升高[11],中性粒细胞、NK细胞、T/B淋巴细胞以及巨噬细胞功能受影响[12]。本项研究中,我们观察到各组白细胞数目及中性粒细胞比值在3组间无差异,均在正常范围,仅有降钙素原在G-菌感染组有明显升高,因此,上述五种临床常用炎症指标不能较好反映糖尿病足患者的实际足部感染情况。对于糖尿病足患者,特别是Wagner分级较高患者应及时开展溃疡分泌物的病原学检查与药敏试验。
目前,有关糖尿病足病原菌分布及耐药性研究较多,但不同地域的文献数据差异较大[6, 13-14]。国外文献报道G-菌所占比例高于G+菌[15]。无论何种类型细菌占优势,国内外文献[13-15]显示G+菌感染以金黄色葡萄球菌或链球菌为主;G-菌感染多见铜绿假单胞菌、大肠埃希菌或鲍曼不动杆菌。本研究中,G+菌占42.72%,G-菌占57.28%。G+菌以金黄色葡萄球菌和表皮葡萄球菌为主,G-菌以布氏柠檬酸杆菌、铜绿假单胞菌、大肠埃希菌为主。进一步分析显示,Wagner 1、2级糖尿病足患者G+菌检出率较高,Wagner 3级患者G-菌检出率较高。Wagner 4、5级G+菌与G-菌检出率相近;此时,G+菌和G-菌的混合感染呈显著上升,与文献报道一致[16-17]。其原因可能与Wagner分级较高的患者年龄较大、体质较弱、免疫系统功能较差,使得机会致病菌易从定植发展为局部感染甚至于全身感染有关。因此,从临床合理用药出发,轻度糖尿病足患者发生感染时可以选择感染谱较窄、主要针对G+菌的青霉素类或第二代头孢类;对于中重度或者混合感染的患者,建议在未明确病原体时选择广谱抗菌药物或者联合使用抗菌药物,明确病原体后再调整用药。值得关注的是,本研究还发现G-菌发生多重耐药比例高于G+菌,以产ESBLs病原菌为主,这也提示在中重度糖尿病足溃疡并发感染的经验性治疗阶段,可以给与含β-内酰胺酶的抗菌药物制剂治疗。
综上所述,糖尿病足病程难以控制,感染又增加了治疗的难度;然而长期、反复使用抗菌药物亦会导致其感染耐药菌的概率增加。因此,及时明确病原菌种类与特征可为临床合理用药提供依据。本文采用回顾性调查,且患者主要来自周边地区,下一步可采取前瞻性调查,增加研究对象,开展更为全面准确的临床药学研究。
[1] Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9): 948-959.
[2] Callahan D, Keeley J, Alipour H, et al. Predictors of severity in diabetic foot infections[J]. Ann Vasc Surg, 2016, 33: 103-108.
[3] Pickwell K, Siersma V, Kars M, et al. Predictors of lower-extremity amputation in patients with an infected diabetic foot ulcer[J]. Diabetes Care, 2015, 38(5): 852-857.
[4] Apelqvist J, Bakker K, van Houtum WH, et al. International consensus and practical guidelines on the management and the prevention of the diabetic foot. International Working Group on the Diabetic Foot[J]. Diabetes Metab Res Rev, 2000, 16 (Suppl 1): S84-S92.
[5] Wagner FJ. The dysvascular foot: a system for diagnosis and treatment[J]. Foot Ankle, 1981, 2(2): 64-122.
[6] 徐波, 杨彩哲, 刘朝阳, 等.糖尿病足感染患者病原菌分布及其药物敏感试验[J].中华传染病杂志, 2016, 34(6):344-348.
[7] 李惠琴, 苏晓飞, 丁波, 等.218例糖尿病足患者临床特征及高危因素分析[J].中华内分泌代谢杂志, 2012, 28(6):492-495.
[8] 冯雪琴, 张汉奎, 兰海丽, 等.糖尿病足部溃疡感染情况及其影响因素分析[J].检验医学与临床, 2010, 7(14):1423-1425, 1428.
[9] 邓婷婷, 周素娴, 梁国荣.糖尿病足感染患者病原菌分布及相关性研究[J].中华医院感染学杂志, 2013, 23(24):5945-5947.
[10] 李静波, 王欣, 陈佰义.糖尿病足合并感染171株病原菌的分布与耐药性变迁[J].中华医院感染学杂志, 2010, 20(5):730-733.
[11] Dinh T, Snyder G, Veves A. Current techniques to detect foot infection in the diabetic patient[J]. Int J Low Extrem Wound, 2010, 9(1): 24-30.
[12] Shah BR, Hux JE. Quantifying the risk of infectious diseases for people with diabetes[J]. Diabetes Care, 2003, 26(2): 510-513.
[13] 冯书红, 王鹏华, 褚月颉, 等.糖尿病足感染患者病原菌分布及耐药性分析[J].中国糖尿病杂志, 2009, 17(4):293-295.
[14] 沈秋燕, 林迪妮, 朱虹, 等.糖尿病足合并感染患者754株病原菌分布及耐药性分析[J].中华医学杂志, 2014, 94(12):889-894.
[15] Bansal E, Garg A, Bhatia S, et al. Spectrum of microbial flora in diabetic foot ulcers[J]. Indian J Pathol Microbiol, 2008, 51(2): 204-208.
[16] 张杉杉, 顾雪明, 刘宏, 等.糖尿病足感染病原菌分布与病情严重性相关[J].中华内分泌代谢杂志, 2012, 28(6):487-491.
[17] Chen SY, Giurini JM, Karchmer AW. Invasive systemic infection after hospital treatment for diabetic foot ulcer: risk of occurrence and effect on survival[J]. Clin Infect Dis, 2016, 64(3): 326-334.

