TNF-α-1031 T/C基因多态性与精神分裂症患者发病年龄、认知功能的关系
唐伟 温娜 刘家洪 潘建设 章金良 詹敏梅 杨馥银 陈洁 修梅红
国内外研究表明,精神分裂症患者存在持久且严重的认知功能损害,如言语记忆、注意、视空间能力和执行功能等[1-3]。同时认知功能损害在发病前就已存在,是精神分裂症的独立症状[4]。但目前关于其机制仍未清楚,有研究认为过度激活的免疫反应-慢性炎症过程可能参与了精神分裂症的认知功能损害[5]。关于神经系统疾病的研究发现,免疫-神经炎症反应是认知功能下降的神经病理机制[6-8]。关于精神疾病的研究发现,双相障碍患者执行功能中的抑制控制能力与外周血TNF-α水平呈正相关[9],且与TNF-α受体(可溶性sTNFR2)呈负相关。TNF-α在精神分裂症发病与精神病性症状中的作用已被广泛研究过[10],但它是否参与认知功能损害的研究较少。TNF-α基因位于6p21.3主要组织相容性复合物(MHC)-Ⅲ类分子区域内,此区域是精神分裂症的易感位点。Zhang等[11]研究发现位于启动子区域-1031位置处的T/C基因多态性与精神分裂症的发病年龄相关,而与精神分裂症的认知功能损害是否有关需要进一步研究。神经假说认为,精神分裂症是一种神经发育缺陷的疾病,发病年龄可能与精神分裂症患者认知功能损害的严重程度有关,患者发病年龄越早,其神经发育缺陷越严重,表现出的认知功能障碍越严重。亦有研究报道早发型精神分裂症患者比晚发型精神分裂症患者存在更为严重的认知功能损害,尤其在即刻记忆方面[12]。因此,本研究就TNF-α-1031 T/C基因多态性与精神分裂症患者发病年龄、认知功能损害之间的复杂关系作一综合分析,现报道如下。
1 对象和方法
1.1 对象 选择温州医科大学附属康宁医院2009年4月至2016年10月住院的468例慢性精神分裂症患者为观察组,其中男313例,女 155例;年龄 20~70(50.8±9.8)岁;受教育年限 6~19(9.3±2.4)年;病程 5~52(26.7 ±9.5)年。入组标准:(1)符合《美国精神障碍诊断与统计手册第四版》(DSM-Ⅳ)精神分裂症的诊断标准;(2)病程 5 年以上;(3)年龄为 20~70 岁;(4)小学以上文化程度;(5)病情稳定,近3个月无换药计划。排除明确患有任何躯体疾病者、有过敏史者、妊娠期或哺乳期妇女。在医院附近社区招募年龄、性别、受教育年限与观察组相匹配的319例健康志愿者为对照组,其中男215例,女104 例;年龄 21~70(48.6±11.4)岁;受教育年限 5~19(9.6±2.9)年。入组标准:(1)既往或目前无精神疾病史及精神疾病家族史;(2)无中枢神经系统疾病;(3)无酒精或其他物质依赖史;(4)小学以上文化程度。排除标准与观察组相同。本研究经温州医科大学附属康宁医院伦理委员会批准,研究对象或家属均签署知情同意书。
1.2 方法
1.2.1 认知功能评估 使用DSM-Ⅳ轴Ⅰ临床定式检查工具诊断精神分裂症患者,收集其社会人口学资料。采用重复性成套神经心理状态测验(RBANS)评估被试者的认知功能,包括即刻记忆、视觉广度、注意、言语功能、延迟记忆等5个分量表,由心理学专业的研究生操作;采用阳性与阴性症状量表(PANSS)评估患者精神病性症状,内容包括阳性症状、阴性症状、一般精神病理等3个方面,由临床经验丰富的精神科医师给予评定。
1.2.2 基因组DNA的提取 采集静脉血5ml,使用美国Promega公司提取DNA试剂盒,提取外周血基因组DNA,分装后置-80℃保存。
1.2.3 TNF-α-1031 T/C多态性位点的检测 采用聚合酶链式反应-限制性酶切片段长度多态性(PCR-RFLP)法。PCR扩增含有多态性位点长度为270bp的片段,上游引物:5′-GGGAGAACAAAAGGATAAG-3′,下游引物:5′-CCCCATACTCGACTTTCATA-3′。扩增后的 PCR产物经过Bbs I过夜酶切,经1.5%琼脂糖电泳,根据消化所得片段大小分别检出-1031T/C多态性位点的基因型。T等位基因为 270bp,C等位基因为 159bp和111bp。
1.3 统计学处理 应用SHEsis统计软件,观察组与对照组的Hardy-Weinberg遗传平衡检验、两组间等位基因及基因型分布频率的比较,采用χ2检验。应用SPSS19.0统计软件,TT基因型与TC/CC基因型的精神分裂症患者性别比较,采用χ2检验;年龄、发病年龄、病程、PANSS及RBANS比较,采用配对样本t检验。精神分裂症患者发病年龄与认知功能的关系采用Pearson相关分析。中介效应分析采用温忠麟等[13]基于依次检验和Sobel检验提出的一个使用的中介效应检测程序,该程序主要包括Baron和Kenny部分中介检验、Judd和Kenny完全中介检验以及Sobel检验。P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg遗传平衡检验结果 观察组(χ2=0.269,P=0.604)与对照组(χ2=0.693,P=0.405)TNF-α-1031 T/C位点分布符合遗传平衡定律,提示该样本具有一定的代表性。
2.2 两组TNF-α-1031 T/C等位基因及基因型分布频率比较 观察组与对照组T/C等位基因及基因型分布频率比较,差异均无统计学意义(均P>0.05),见表1。
2.3 精神分裂症患者TNF-α-1031 T/C基因多态性与精神病性症状、认知功能的关系 TT基因型与TC+CC基因型的患者年龄,性别,病程,PANSS总分及各因子得分,RBANS的注意、言语功能及延迟记忆等分量表得分比较,差异均无统计学意义(均P>0.05)。TT基因型患者发病年龄小于TC+CC基因型患者,RBANS总分及即刻记忆、视觉广度等分量表得分均低于TC+CC基因型患者,差异均有统计学意义(均P<0.05),见表2。

表1 两组TNF-α-1031 T/C等位基因及基因型分布频率比较[例(%)]
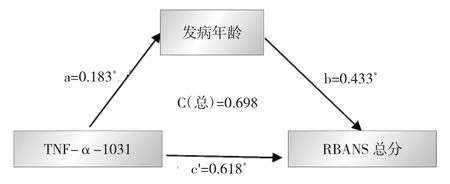
图2 精神分裂症患者TNF-α-1031 C/T基因多态性、发病年龄和认知功能间的中介效应分析模型(a、b、c'分别是指路径分析中的标准回归系数,C=c'+a×b)
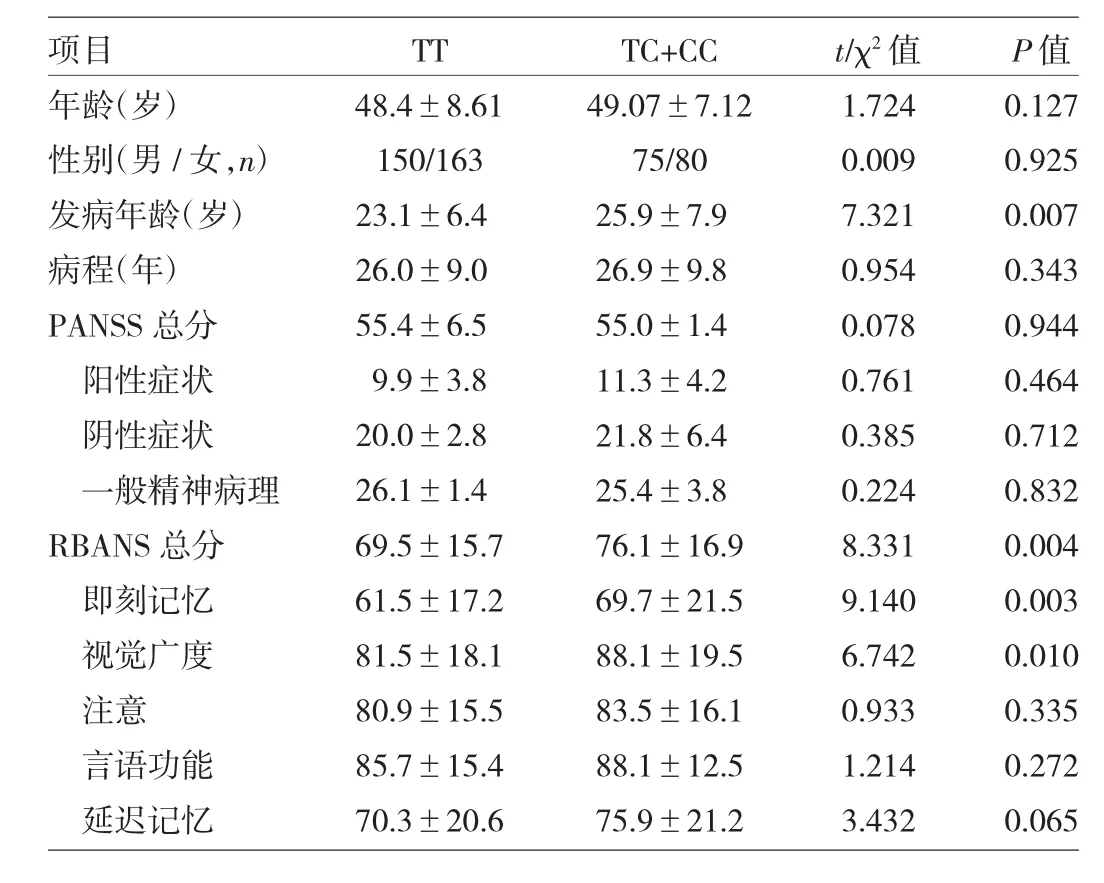
表2 精神分裂症患者TNF-α-1031 T/C等位基因与精神病性症状、认知功能的关系(n=468)
2.4 精神分裂症患者发病年龄与认知功能的关系 对精神分裂症患者发病年龄与认知功能的关系进行偏相关分析(校正年龄、性别、教育年限、抗精神病药物等混杂因素),结果发现患者发病年龄与RBANS总分及注意、即刻记忆、延迟记忆等分量表得分均呈正相关(r=0.179、0.102、0.154 和 0.134,均 P<0.05),与视觉广度、言语功能分量表得分均未见相关(r=0.149和0.138,均P >0.05),见图 1(插页)。
2.5 精神分裂症患者TNF-α-1031 T/C基因多态性、发病年龄与认知功能间的中介效应分析 精神分裂症患者TNF-α-1031 T/C基因多态性与发病年龄相关,发病年龄又与认知功能相关,因此本研究通过中介效应分析来探讨TNF-α-1031 T/C基因多态性、发病年龄与认知功能间的复杂关系。以RBANS总分为因变量,TNF-α-1031 T/C基因多态性为自变量,发病年龄为调节变量,年龄、性别、受教育年限等为协变量作中介效应分析模型,差异有统计学意义(R2=0.13,P<0.01),说明发病年龄在认知功能损害中发挥了部分中介的作用。中介效应分析模型见图2。
3 讨论
认知功能是指个体认识事物和现象的能力,包括信息处理速度、记忆、注意、执行功能等。精神分裂症患者的认知功能损害可能与过度激活的免疫反应-慢性炎症状态有关,但免疫系统与认知功能的关系只有极少的实验室证据。细胞因子作为信号分子,介导免疫系统应对外界感染和应激过程,同时在免疫系统-神经系统间的交流中起着关键作用,从而参与精神分裂症的病理、生理过程[14]。本研究探讨TNF-α-1031 C/T基因多态性与精神分裂症患者认知功能的关系,结果表明此位点基因多态性能够对患者造成广泛但不是所有神经认知领域的影响。
在中枢神经系统中,TNF-α主要是由小胶质细胞和星形胶质细胞分泌的促炎性细胞因子,能够参与神经系统的免疫反应,同时还可以促进神经细胞的生长、分化和凋亡[15]。有文献报道衰老和老年性痴呆患者的TNF-α水平明显高于健康对照组[16]。多项研究结果发现精神分裂症患者TNF-α水平发生明显改变,并参与病理、生理过程[17]。最近GWAS研究发现,TNF-α和TNF-α受体相关的信号通路基因参与了精神分裂症的发病[18]。TNF-α基因多态性位点可影响其基因的表达水平,而研究发现-1031 C/T基因多态性可影响蛋白水平的表达。本研究发现TNF-α-1031 C/T基因多态性与精神分裂症患者的认知功能相关,提示TNF-α相关炎症信号通路可能参与了精神分裂症患者的认知功能损害。在中枢神经系统发育的关键时期,TNF-α水平的改变影响了神经发育的进程,从而引起脑部神经结构和功能的异常,并导致认知功能损害。本研究中,笔者确实也发现TNF-α-1031 C/T基因多态性与精神分裂症患者的发病年龄有关,TT基因型的患者发病年龄明显早于CC+TC基因型患者。可见,发病年龄与认知功能损害有关,发病年龄越早,其认知功能损害程度越严重。因此,笔者推测TNF-α-1031 C/T基因多态性可导致神经发育异常,携带T等位基因的精神分裂症患者的发病年龄较小,这部分患者的认知功能损害就更为严重且广泛。以上是本研究的推测,还需要建立动物模型的基础研究给予更多的证据。
本研究探讨了TNF-α-1031 C/T基因多态性与精神分裂症患者发病年龄、认知功能的关系,为神经炎症在认知功能损害中的作用机制提供了进一步的佐证。但本研究尚存在以下局限性:(1)本研究对象是慢性精神分裂症患者,服用药物及病程等混杂因素会潜在影响认知功能;(2)细胞因子在体内以网络的形式协同工作的,本研究只分析一种促炎性细胞因子,无法说明整个免疫系统细胞因子对认知功能的影响;(3)TNF-α基因上有多个基因多态性位点,本研究中只选取了一个,且未检测外周血TNF-α水平。因此,今后仍需收集首发精神分裂症患者的临床资料,且以更大的样本量来研究多个细胞因子基因多态性对认知功能的影响。
[1]周晨辉,王志仁,刘小蕾,等.组胺能系统与精神分裂症相关认知功能障碍的研究进展[J].中华精神科杂志,2015,48(6):372-374.
[2]刘璇,王惠玲,方悦,等.精神分裂症首次发病患者的执行功能和学习能力[J].中华精神科杂志,2011,44(1):32-35.
[3]Condray R,Yao JK.Cognition,dopamine and bioactive lipids in schizophrenia[J].Frontiers in Bioscience,2011,3(1):298-330.
[4]Morrison G,O'Carroll R,McCreadie R.Long-term course of cognitive impairment in schizophrenia[J].Br J Psychiatry,2006,189(6):556-557.
[5]Ribeiro-Santos A,Lucio TA,Salgadoand JV.Evidence for an immune role on cognition in schizophrenia:a systematic review[J].Curr Neuropharmacol,2014,12(3):273-280.
[6]Gorelick PB.Role of inflammation in cognitive impairment:results of observational epidemiological studies and clinical trials[J].Ann N YAcad Sci,2010,1207(1):155-162.
[7]Passos GR,Douglas S,Jefferson B,et al.Th17cells pathways in multiple sclerosis and neuromyelitis optica spectrum disorders:pathophysiological and therapeutic implications[J].Mediators Inflamm,2016(7):1-11.
[8]Goldeck D,Douglas S,Jefferson B,et al.Peripheral immune signatures in alzheimer disease[J].Curr Alzheimer Res,2016,13(7):739.
[9]Barbosa IG,Rocha NP,Huguet RB,et al.Executive dysfunction in euthymic bipolar disorder patientsand its association with plasma biomarkers[J].J Affect Disord,2012,137(1-3):151-155.
[10]Goldsmith DR,Rapaport MH,Miller BJ.A meta-analysis of blood cytokine network alterations in psychiatric patients:comparisons between schizophrenia,bipolar disorder and depression[J].MolPsychiatry,2016,21(12):1696.
[11]Zhang XY,Haile CN,Tan YL,et al.Tumour necrosis factor alpha polymorphism (-1031T/C)is associated with age of onset of schizophrenia[J].MolPsychiatry,2005,10(10):897-899.
[12]邢晓萍,徐林群,卢卫红,等.早发与非早发精神分裂症认知功能比较研究[J].神经疾病与精神卫生,2012,12(1):9-11.
[13]温忠麟,张雷,侯杰泰.中介效应检验程度及其应用[J].心理学报,2004,36(5):614-620.
[14]Altamura AC,BuoliM,PozzoliS.Role of immunologicalfactors in the pathophysiology and diagnosis of bipolar disorder:comparison with schizophrenia[J].Psychiatry Clin Neurosci,2014,68(1):21-36.
[15]Beattie MS,Hermann GE,Rogers RC,et al.Cell death in models of spinalcord injury[J].Prog Brain Res,2002,137:37-47.
[16]March R,Dieset I,Faerden A,et al.Persistent increase in TNF and IL-1 markers in severe mental disorders suggests trait-related inflammation:A one year follow-up study[J].Acta Psychiatr Scand,2017,136:400-408.
[17]Misiak B,Staczykiewicz B,Kotowicz K,et al.Cytokines and C-reactive protein alterations with respectto cognitive impairment in schizophrenia and bipolar disorder:A systematic review[J].Schizophr,Res,2017.doi:org/10.1016/j.schres.2017.04.015.
[18]Jia P,Wang L,Meltzer HY,et al.Common variants conferring risk of schizophrenia:A pathway analysis of GWAS data[J].Schizophr Res,2010,122(1-3):38-42.

