维持性血液透析继发性甲状旁腺功能亢进患者应用活性维生素D治疗对肾性贫血的改善作用
吴 晨 周广宇 郭 莹 王雪婷 赵圆圆
(吉林大学中日联谊医院肾内科,吉林 长春 130033)
维持性血液透析(MHD)患者普遍存在活性维生素D的缺乏及与之相关的多种并发症,包括继发性甲状旁腺功能亢进(SHPT)、慢性肾脏病-矿物质和骨异常(CKD-MBD)、顽固性高血压和免疫功能异常等,肾性贫血也是MHD患者的常见并发症之一。研究表明,SHPT不但可引起钙磷代谢紊乱,而且甲状旁腺激素(PTH)水平升高也是影响肾性贫血的关键因素之一〔1〕,但SHPT及活性维生素D与肾性贫血的相互作用及作用机制尚不明确。本研究在应用活性维生素D治疗MHD患者SHPT的同时,观察肾性贫血的改善情况,探讨活性维生素D在改善肾性贫血中的作用。
1 材料与方法
1.1研究对象 选取2016年5月至2017年1月于吉林大学中日联谊医院血透中心行MHD治疗伴中重度SHPT (PTH>300 pg/ml)及中重度肾性贫血〔血红蛋白(Hb)<90 g/L〕的患者48例,其中男35例,女13例,平均年龄(66.37±9.26)岁,随访3个月。原发病分别为慢性肾小球肾炎27例、糖尿病肾病12例、高血压肾损害6例、梗阻性肾病2例、多囊肾1例。入选标准:(1)患者MHD透析时间≥6个月;(2)均经正规重组人促红细胞生成素(rhEPO)治疗6个月以上,rhEPO用量≥9 000 IU/w,Hb及血细胞比容(Hct)处于稳定状态;(3)持续补充铁剂及叶酸6个月以上,无铁缺乏证据〔铁蛋白(SF)≥200 μg/L,转铁蛋白饱和度(TSAT)≥20%〕;(4)未接受长期、正规维生素D治疗;(5)透析充分:透析充分性(KT/V)≥1.2。排除标准:(1)近3个月内有出血、输血史或血液系统疾病者;(2)近3个月内有严重感染、严重心力衰竭或活动性疾病;(3)恶性肿瘤者。
1.2治疗方法
1.2.1透析方案 全部患者均采用费森尤斯4008S或贝朗Dialog+血液透析机,费森尤斯聚砜膜FX60或贝朗聚砜膜Lo15透析器,应用碳酸氢盐透析液,钙浓度为1.5 mmol/L,钠浓度为140 mmol/L。透析频率均为每周3次,每次3~4 h,血液透析血流量为180~280 ml/min,透析液流量为500 ml/min。
1.2.2骨化三醇治疗方案 患者均应用碳酸钙或醋酸钙,在控制好血钙、血磷的基础上予以活性维生素D(骨化三醇,上海罗氏制药有限公司生产,国药准字J20100056,0.25 μg/粒)治疗:参照2005年《活性维生素D在慢性肾脏病继发性甲旁亢中合理应用的专家共识(修订版)》和2013年《慢性肾脏病矿物质和骨异常诊治指导》,给予骨化三醇治疗3个月:对于PTH 300~500 pg/ml者予骨化三醇0.5 μg,1次/d口服;PTH 501~1 000 pg/ml者予骨化三醇2~4 μg,2次/w口服;PTH>1 000 pg/ml者予骨化三醇4~6 μg,2次/w口服。服药时间为每次透析当日晚顿服。
1.3观察指标
1.3.1血生化指标观察 所有患者于骨化三醇治疗前检测血钙、血磷、PTH、血清碱性磷酸酶(ALP)、Hb、Hct、血清SF、TSAT、血清白蛋白(Alb)、前白蛋白(PA)和C反应蛋白(CRP)等实验室指标。以后每4 w检测上述指标,均为透析前采血,由该院检验科完成检测。根据血钙、钙磷乘积和PTH结果调整骨化三醇剂量,维持血钙浓度<2.88 mmol/L及钙磷乘积<55 mg2/dl2。
1.3.2rhEPO用量 记录骨化三醇治疗前的rhEPO用量,每4 w检测血Hb,参照2007年《重组人促红细胞生成素在肾性贫血中合理应用的专家共识》调整rhEPO用量:如4 w后血Hb增长速度≤10 g/L,增加rhEPO使用剂量25%;如4 w后血Hb增长速度>10 g/L,则减少rhEPO使用剂量25%,对于血Hb增长速度>20 g/L的患者将rhEPO使用量减少50%。
1.3.3SHPT临床症状改善情况 分别于治疗前和治疗3个月后采用问卷调查形式对临床症状改善情况进行评分量化,骨痛程度:严重疼痛伴血压、脉搏等变化,4分;持续重度疼痛必须使用止痛药,3分;中度影响休息,2分;轻度间歇可以忍受,1分;无疼痛,0分。疼痛部位数量:3个以上部位疼痛,3分;2~3个部位疼痛,2分;单部位疼痛,1分。皮肤瘙痒程度:持续重度难以忍受,3分;中度影响休息,2分;轻度间歇可以忍受,1分;无,0分。
1.3.4不良反应 记录治疗过程中出现的各种不良反应。
1.4统计学处理 应用SPSS22.0软件,计量资料比较采用t检验,计数资料比较采用χ2检验。
2 结 果
2.1治疗前后SHPT主要临床症状的改善情况 骨化三醇治疗3个月后,四项自觉症状的患者比例及临床症状改善评分与治疗前比较差异均有统计学意义(P<0.05)。见表1。

表1 治疗前后有临床症状的患者比例及临床症状评分比较〔n(%),n=48〕
与治疗前比较:1)P<0.05,2)P<0.01;下表同
2.2治疗前后SHPT相关血生化指标和CRP水平比较 治疗3个月后血钙、血磷水平及钙磷乘积与治疗前比较差异均无统计学意义(P>0.05);治疗后PTH、ALP水平均较治疗前明显下降(P<0.05),CRP水平明显降低(P<0.05)。见表2。
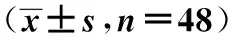
表2 治疗前后相关血生化指标及CRP水平比较
2.3治疗前后贫血指标、rhEPO用量及其他指标比较 治疗后,血Hb、Hct较治疗前明显升高,差异均有统计学意义(P<0.05);rhEPO的用量较治疗前减少,差异有统计学意义(P<0.05)。KT/V、SF、TSAT、Alb、PA等各项指标在治疗前后的差异无统计学意义(P>0.05)。见表3。
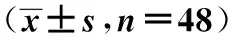
表3 治疗前后贫血指标、rhEPO用量及其他指标的比较
2.4不良反应 48例患者中3例服药后出现轻度头痛、肌肉酸痛,2例出现恶心、呕吐等胃肠道反应,均经对症处理后缓解。
3 讨 论
SHPT和肾性贫血是MHD患者常见且重要的并发症,其治疗与MHD患者的预后息息相关。PTH的过度分泌可引起患者多系统病理改变及临床变化。近年来有研究认为PTH也是影响肾性贫血及引起rhEPO低反应的关键因素之一〔2,3〕。
SHPT是矿物质代谢紊乱的重要表现类型之一,不仅可以加重钙磷代谢异常,还可以引起骨骼损害、皮肤瘙痒等临床症状。本文结果显示骨化三醇治疗后SHPT临床症状明显改善,且PTH水平明显下降,表明骨化三醇可有效改善SHPT。骨化三醇能直接、间接抑制PTH的合成和分泌,纠正SHPT,但骨化三醇在升高血钙的同时可升高钙磷乘积,引起低转化性骨病。但本研究中所有患者的血钙水平保持稳定,且骨化三醇治疗后并未出现PTH的过度抑制,表明根据PTH升高的不同程度选择相应的骨化三醇适宜剂量,并在治疗过程中严格监测血钙、血磷水平,能做到安全、有效地控制SHPT。
本文发现随着PTH水平的明显下降,各项贫血指标如Hb、Hct水平有明显改善,rhEPO的用量也显著下降。因此,在排除了造血原料缺乏、营养不良、透析不充分对贫血的影响后,肾性贫血仍然得以改善,提示肾性贫血与SHPT存在一定的关系,同时也提示SHPT可能是导致肾性贫血的影响因素。这与近年来的研究报道一致〔4〕。Patel等〔5〕也发现Hb下降程度与维生素D缺乏水平正相关,二者的线性关系在校正年龄、性别、种族、肾小球滤过率、糖尿病及PTH后仍有显著意义。然而,维生素D影响肾性贫血的机制尚不十分清楚。肾性贫血主要是由于EPO分泌不足引起,大部分患者通过补充rhEPO,肾性贫血可得到基本改善,但有10%~20%患者存在EPO抵抗〔6〕。本研究提示SHPT可能为肾性贫血EPO抵抗的原因之一。SHPT患者行甲状旁腺切除术后,随着PTH迅速下降,贫血得到改善,rhEPO用量也显著减少,也提示SHPT可能是肾性贫血的原因之一〔2〕。以往研究表明PTH可通过干扰内源性EPO的合成、加速溶血、干扰红细胞能量代谢,加重肾性贫血〔7〕。
本研究还发现,随着肾性贫血的改善,CRP也明显降低,提示肾性贫血可能与炎性反应有关。由于透析膜的生物不相容、透析液中微生物和内毒素等致热源激活炎症细胞,释放大量炎症因子,导致MHD患者常呈现微炎症状态。有研究认为,微炎症状态下机体分泌的炎症因子如CRP,可抑制内源性红细胞生成素的合成,降低机体对红细胞生长素的敏感性,抑制红细胞生成〔8〕。研究表明,活性维生素 D与维生素D受体(VDR)结合可抑制炎性细胞的活化及炎症介质的释放〔9〕;维生素 D通过抑制VDR介导的核因子(NF)-κB途径发挥抑制炎症的作用〔10〕,还可通过抑制肾素-血管紧张素-醛固酮系统(RAS)发挥抗炎症作用〔9〕。但目前关于微炎症反应与肾性贫血的关系多为体外实验,国内的临床研究未见此方面报道。本文的研究结果首次揭示了活性维生素D可能通过抑制炎性反应改善MHD患者的肾性贫血。
肾性贫血的关键还在于铁代谢异常,铁调素是维持机体铁代谢平衡的重要激素,可负性调节铁代谢平衡。随着肾小球滤过率下降,MHD患者体内会铁调素蓄积,引起铁代谢障碍。近年来,有研究报道维生素 D不足与铁调素相关〔11〕。维生素D可通过抑制铁调素基因转录、下调铁调素的表达,从而降低MHD患者铁调素〔12,13〕。但本研究发现维生素D治疗前后铁代谢指标变化差异无统计学意义,这可能与本研究的MHD患者持续补充外源性铁剂,影响了铁代谢指标检测结果有关。因此,本研究结果对维生素D和铁调素关系的预测指导意义不大。
1Rao DS,Shin MS,Mohini R.Effect of serum parathyroid hormone and bone marrow fibrosis on the response to erythropoietin in uremia〔J〕.N Engl J Med,1993;328(3):171-5.
2Chen C,Wu H,Zhong L,etal.Impacts of parathyroidectomy on renal anemia and nutritional status of hemodialysis patients with secondary hyperparathyroidism〔J〕.Int J Clin Exp Med,2015;8(6):9830-8.
3Tanaka M,Yoshida K,Fukuma S,etal.Effects of secondary hyperparathyroidism treatment on improvement in anemia:results from the MBD-5D study〔J〕.PLoS One,2016;11(10):e0164865.
4Kiss Z,Ambrus C,Almasi C,etal.Serum 25(OH)-cholecalciferol concentration is associated with hemoglobin level and erythropoietin resistance in patients on maintenance hemodialysis〔J〕.Nephron Clin Pract,2011;117(4):c373-8.
5Patel NM,Gutiérrez OM,Andress DL,etal.Vitamin D deficiency and anemia in early chronic kidney disease〔J〕.Kidney Int,2010;77(8):715-20.
6Szczech LA,Barnhart HX,Inrig JK,etal.Secondary analysis of the CHOIR trial epoetin-alpha dose and achieved hemoglobin outcomes〔J〕.Kidney Int,2008;74(6):791-8.
7吴建平,郭树龙,沈世忠,等.CAPD的内分泌素与rhEPO疗效的相关性〔J〕.中国中西医结合肾病杂志,2003;4(4):218-20.
8Martone M,Zanchi R,Panzetta G,etal.Role of iron deficiency in erythropoietin sensitivity in dialysis patients with elevated C-reactive protein〔J〕.G Ital Nefrol,2003;20(1):31-7.
9Sanchez-Nio MD,Bozic M,Córdoba-Lanús E,etal.Beyond proteinuria:VDR activation reduces renal inflammation in experimental diabetic nephropathy〔J〕.Am J Physiol Renal Physiol,2012;302(6):F647-57.
10Tan XY,Wen XY,Liu YH.Paricalcitol inhibits renal inflammation by promoting vitamin D receptor-mediated sequestrationof NF-kappaB signaling〔J〕.J Am Soc Nephrol,2008;19(9):1741-52.
11Icardi A,Paoletti E,De Nicola L,etal.Renal anaemia and EPO hyporesponsiveness associated with vitamin D deficiency:the potential role of inflammation〔J〕.Nephrol Dial Transplant,2013;28(7):1672-9.
12Bacchetta J,Zaritsky JJ,Sea JL,etal.Suppression of iron-regulatory hepcidin by vitamin D〔J〕.J Am Soc Nephrol,2014;25(3):564-72.
13Zughaier SM,Alvarez JA,Sloan JH,etal.The role of vitamin D in regulating the iron-hepcidi-ferroportin axis in monocytes〔J〕.J Clin Transl Endocrinol,2014;1(1):19-25.

