环境激素壬基酚对杂交鲟的氧化胁迫作用
杨琦+张金补+董然然

摘要 本研究通过3种不同浓度壬基酚(Nonylphenol,NP)浸浴杂交鲟(Acipenser baerii♂×Acipenser schrenckii♀)28 d后,检测鲟鱼不同组织的总抗氧化能力、谷胱甘肽S转移酶活性和丙二醛含量。结果表明,肝脏、鳃和小肠中总抗氧化能力(T-AOC)和谷胱甘肽S转移酶(GST)活性随着NP浓度的升高而降低,中浓度(NP,50 μg/L)和高浓度(NP,100 μg/L)组T-AOC和GST活性均显著低于对照组(P<0.05),并且高浓度组GST活性均最低,显著低于其他各组(P<0.05)。肝脏、鳃和小肠丙二醛(MDA)含量随着NP浓度的升高而增加,中浓度组和高浓度组MDA含量均显著高于对照组(P<0.05),并且低浓度组(NP,25 μg/L)肝脏中MDA含量开始显著高于对照组(P<0.05)。因此,环境激素NP可以影响鲟鱼T-AOC、GST活性以及MDA含量;随着指标的变化表明,鲟鱼受到NP的氧化胁迫,已对其肝脏、小肠和鳃造成损伤,并且鲟鱼已经启动自身抗氧化解毒系统。
关键词 壬基酚;杂交鲟;总抗氧化能力;谷胱甘肽S转移酶;丙二醛
中图分类号 S965.215 文献标识码 A 文章编号 1007-5739(2018)02-0240-03
Effect of Nonylphenol on Oxidative Stress of Hybrid Sturgeon
YANG Qi ZHANG Jin-bu DONG Ran-ran
(College of Animal Science,Guizhou University,Guiyang Guizhou 550025)
Abstract In this study,T-AOC,GST activity and MDA content in liver,gill and small intestine of hybrid sturgeon(Acipenser baerii♂× Acipenser schrenckii♀)were detected after treatment for 28 days with different concentrations nonylphenol.The results showed that T-AOC and GST activity reduced when the concentration of nonylphenol increased.Compared with the control group,T-AOC and GST activity were significantly lower in medium(50 μg/L)and high concentration groups(100 μg/L)(P<0.05).In addition,GST activity was the lowest in high concentration groups,significantly lower than the other groups(P<0.05).MDA content increased when the concentration of nonylphenol increased in liver,gill and small intestine.Compared with the control group,MDA content was significantly higher in medium and high concentration groups(P<0.05).MDA content of liver in low concentration group was significantly higher than the control group(P<0.05).These results indicated that T-AOC,GST activity and MDA content in the hybrid sturgeon were affected by nonylphenol.The changes in biochemical index revealed that the sturgeon had been under oxidative stress of nonylphenol,which had caused damage to its liver,small intestine and gills,and its anti-oxidant detoxification system might have been started.
Key words nonylphenol;hybrid sturgeon;T-AOC;GST;MDA
随着工业的飞速发展,环境激素在给人们生产带来便捷的同时也严重污染了环境。壬基酚(Nonylp-henol,NP)是一种典型的环境激素,在水、大气、土壤以及食品中均有分布报道,尤其是在水中的报道最多,欧洲、美洲、亞洲和非洲的多条河流中都检测到壬基酚[1-3]。目前,壬基酚对硬骨鱼类影响的研究主要集中在生殖毒性和生物累积方面,而其对鱼类生态毒性方面的报道较少[4-7]。本研究以生长速度快、抗病力强、肉质鲜美、营养价值丰富的杂交鲟(Acipenser baerii♂×Acipenser schrenckii♀)为研究对象,通过不同浓度壬基酚浸浴后,检测鲟鱼不同组织总抗氧化能力、谷胱甘肽S转移酶活性和丙二醛含量的变化,以期丰富环境激素对鱼类生态毒理方面的研究,为野生条件下保护鲟鱼提供参考依据,同时提高公众保护环境的意识。
1 材料与方法
1.1 试验材料endprint
试验所用杂交鲟购自遵义绥阳县芙蓉江鲟鱼繁养有限公司,体质量为(59.16±4.18)g。在实验室暂养7 d。
1.2 试验设计
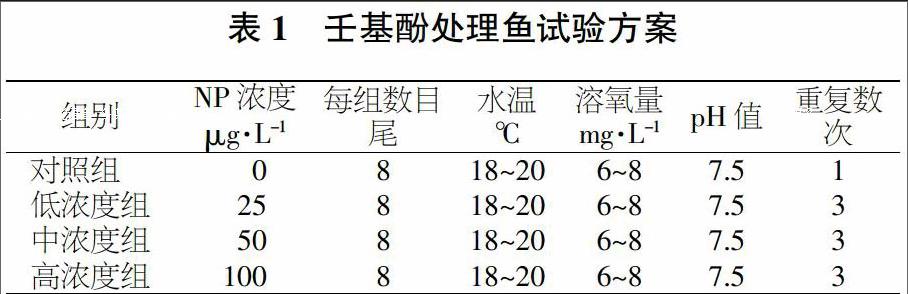
将NP溶于95%乙醇中,配成2 mg/mL母液,浸浴处理时,分别向鱼缸中(含100 L水)加入1、2、4 mL NP母液,使水中NP的终浓度分别为25、50、100 μg/L。
试验共设4个处理,即低浓度组、中浓度组、高浓度组、对照组。其中处理组设置3次重复。从暂养7 d的鲟鱼中,选取80尾健康个体随机分到每个小组,每小组8尾鱼。浸浴时间为28 d。浸浴期间每天饱食投喂2次(9:00和17:00),水温控制在18~20 ℃之间,溶氧量为6~8 mg/L,pH值为7.5左右。具体试验方案见表1。浸浴结束后,取肝脏、小肠和鳃检测总抗氧化能力、谷胱甘肽S转移酶活性和丙二醛含量。
1.3 指标测定方法
1.3.1 总抗氧化能力(T-AOC)的测定。称取0.2 g组织加入2 mL 0.65%生理盐水用匀浆器充分匀浆,然后在3 500 r/min条件下离心10 min,取上清液,用于检测总抗氧化能力和蛋白质浓度。样品的总抗氧化能力以达到同样吸光度变化值(△A)所需的标准离子浓度表示。检测总抗氧化能力具体操作步骤按北京索莱宝生物科技有限公司试剂盒进行。此指标的测定设 3个以上重复。
1.3.2 谷胱甘肽S转移酶(GST)活性的测定。上清液制备同检测总抗氧化能力中的方法。GST活性单位:在25 ℃或37 ℃中,每1 mg蛋白1 min催化1 nmol/L CDNB与GSH结合为1个酶活单位。操作流程按北京索莱宝生物科技有限公司谷胱甘肽S转移酶试剂盒进行。此指标的测定设3个以上重复。
1.3.3 丙二醛(MDA)含量的测定。上清液制备与检测总抗氧化能力中的方法相同。检测丙二醛含量具体操作步骤按北京索莱宝生物科技有限公司试剂盒进行。此指标的测定设3个以上重复。
1.4 数据处理
用Excel 2013和IBM SPSS Statistics 21软件整理和分析数据,各组数据间多重比较用单因素方差分析中的LSD(L)和Ducan(D)法进行,多重比较的显著性水平(F)值均设置为0.05。文中试验数据均用平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 不同浓度壬基酚(NP)对杂交鲟肝脏的氧化胁迫作用
如表2所示,NP浓度为0、25、50、100 μg/L时,肝脏中MDA的含量分别为(2.06±0.13)(2.53±0.25)(2.85±0.06)(3.12±0.40)nmol/mg prot。结果显示,随着NP浓度的升高,丙二醛含量显著升高(P<0.05)。
各组肝脏中T-AOC分别为(1.87±0.04)(1.66±0.05)(1.47±0.03)(1.44±0.10)U/mg prot。NP浓度为50 μg/L时,总抗氧化能力显著低于对照组(P<0.05)。NP浓度为100 μg/L时,总抗氧化能力最低,显著低于其他3组(P<0.05)。
各组肝脏谷胱甘肽S转移酶活性分别为(15.98±0.23)(15.65±0.67)(13.23±0.51)(10.69±0.46)nmol/(min·mg prot)。NP浓度为50 μg/L时,GST活性显著低于对照组(P<0.05)。NP浓度为100 μg/L时,GST活性最低,显著低于其他各组(P<0.05)。
2.2 不同浓度壬基酚(NP)对杂交鲟小肠的氧化胁迫作用
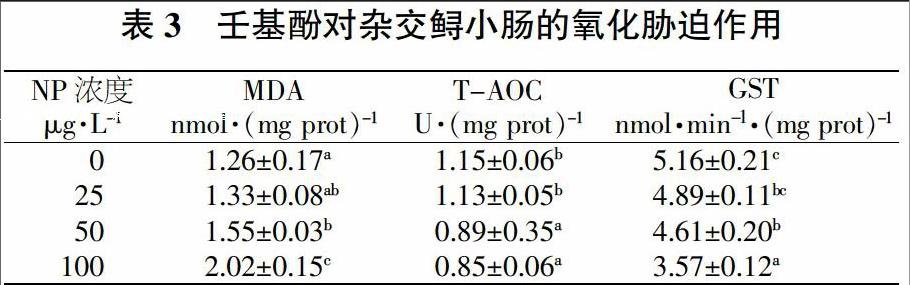
小肠中MDA含量随着NP浓度的升高而呈现出升高的趋势(表3)。NP浓度为50 μg/L时,丙二醛含量为(1.55 ± 0.03)nmol/mg prot,显著高于对照组(1.26 ± 0.17)nmol/mg prot。NP浓度为100 μg/L时,丙二醛含量为(2.02±0.15)nmol/mg prot,显著高于其他各组(P<0.05)。
NP浓度为0、25、50、100 μg/L时,小肠的T-AOC分别为(1.15±0.06)(1.13±0.05)(0.89±0.35)和(0.85±0.06)U/mg prot。50、100 μg/L NP浓度组显著高于0、25 μg/L NP浓度组,但是50、100 μg/L NP浓度组之间以及0、25 μg/L NP浓度组之间的T-AOC没有显著性差异(P>0.05)。
小肠中GST活性随着NP浓度的升高而降低。NP浓度为50 μg/L时,GST的活性为(4.61±0.20)nmol/(min·mg prot),显著低于对照组(5.16±0.21)nmol/(min·mg prot)(P<0.05)。并且随着NP浓度的升高(100 μg/L),GST的活性也进一步显著降低,为(3.57±0.12)nmol/(min·mg prot)(P<0.05)。
2.3 不同浓度壬基酚(NP)对杂交鲟鳃的氧化胁迫作用
NP浓度为0、25、50、100 μg/L时,鳃中MDA含量分别为(0.86±0.13)(0.77±0.10)(1.23±0.24)(1.15±0.09)nmol/mg prot(表4)。NP濃度为50、100 μg/L时,MDA含量显著高于0、25 μg/L NP浓度组(P<0.05),而50、100 μg/L NP浓度组之间以及0、25 μg/L NP浓度组之间MDA含量没有显著性差异(P>0.05)。
NP浓度为50 μg/L时,T-AOC为(0.77±0.04)U/mg prot,显著低于对照组(0.93±0.06)U/mg prot。NP浓度为100 μg/L时,总抗氧化能力为(0.59±0.08)U/mg prot,显著低于其他各组(P<0.05)。endprint
各组鳃中GST活性分别为(6.19±0.23)(6.61±0.07)(4.68±0.14)(4.30±0.12)nmol/(min·mg prot)。随着NP浓度升高,各组GST活性逐渐降低,各组间活性差异显著(P<0.05)。
3 结论与讨论
3.1 结论
本研究中,不同浓度NP浸浴可以显著提高杂交鲟肝脏、鳃和小肠中MDA含量,降低鲟鱼T-AOC和GST活性。结果表明,鲟鱼受到NP的氧化胁迫,已对其肝脏、小肠和鳃造成损伤,并且鲟鱼已经启动自身抗氧化解毒系统。
3.2 讨论
3.2.1 NP可提高杂交鲟体内MDA含量。脂质过氧化是机体内新陈代谢失常和免疫功能降低引起的连锁反应。MDA是连锁反应的终产物,故MDA含量是反应机体脂质过氧化程度的重要指标[8]。研究发现,生活在农药污染的河流中,鲦鱼鳃和小肠中MDA含量明显升高[9]。环境激素NP、多环芳烃等可显著提高金鱼、鲈鱼、中华倒刺鲃和细鳞仔鱼肝脏中MDA含量,且MDA含量随着环境激素浓度增加而增加[10-12]。本文中,环境激素NP可以显著提高杂交鲟肝脏、小肠和鳃中MDA含量,表明NP已在这3种组织中引起脂质过氧化反应。
3.2.2 NP可以降低杂交鲟体内的T-AOC。总抗氧化能力是衡量机体抗氧化系统功能状况的综合性指标。已有研究表明,苯并(α)芘可以显著降低鲫鱼肝脏中T-AOC[13]。益生菌、VC可以显著提高草鱼和普安银鲫体内T-AOC[14-15]。而重金属铅和镉在建鲤和草鱼体内会先升高后降低T-AOC[16-17]。本研究中,NP可以显著降低杂交鲟肝脏、小肠和鳃中的T-AOC,并且在肝脏和鳃中随着NP浓度的增加,T-AOC会明显降低。表明鲟鱼已启动自身抗氧化解毒系统。有学者认为,如果外源有害物质的累积量超出了鱼体自身解毒系统的分解代谢能力,那么体内抑制自由基氧化反应的机制就会受到损伤[18]。
3.2.3 NP可以抑制杂交鲟体内GST的活性。为避免机体脂质过氧化和组织DNA受损,GST会催化外源物质与还原型谷胱甘肽结合,加速外源有害物质在体内的代谢。Slatinska等指出,鱼类GST是检测水体污染的重要生化指标[19]。已有研究表明,溴氰菊酯可以显著提高麦穗鱼肠和鳃中的GST活性[20]。而蒽和菲可以显著降低细鳞仔鱼鳃和肌肉以及中华倒刺鲃肝胰脏中的GST活性[10,21]。本研究结果显示,NP也能够显著抑制杂交鲟肝脏、鳃和小肠中的GST活性,并且随着NP浓度的升高,GST活性显著降低。目前,关于抑制GST活性的原因有2种假设:一是外源物质与GST结合;二是外源物质使反应底物-还原性谷胱甘肽的含量减少[10,22]。
4 参考文献
[1] DONG C D,CHEN C W,CHEN C F.Seasonal and spatial distribution of 4-nonylphenol and 4-tert-octylphenol in the sediment of Kaohsiung Harbor,Taiwan[J].Chemosphere,2015,134:588-597.
[2] KANNAN K,KEITH T L,NAYLOR C G,et al.Nonylphenol and nonylp-henol ethoxylates in fish,sediment,and water from the Kalamazoo River,Michigan[J].Archives of Environmental Contamination & Toxicology,2003,44(1):77-82.
[3] LIBER K,KNUTH M L,STAY F S.An integrated evaluation of the persi-stence and effects of 4-nonylphenol in an experimental littoral ecosystem[J].Environmental Toxicology and Chemistry,1999,18:357-362.
[4] KINNBERG K,KORSGAARD B,BJERREGAARD P.Concentration-dependent effects of nonylphenol on testis structure in adult platyfish Xiphophorus maculatus[J].Marine Environmental Research,2016,50(1):169-173.
[5] SAYED A E,HAMED H S.Induction of apoptosis and DNA damage by 4-nonylphenol in African catfish(Clarias gariepinus)and the antioxidant role of Cydonia oblonga[J].Ecotoxicology and Environmental Safety,2017,139:97.
[6] 戚珍珠,雷忻,王靜,等.壬基酚对1月龄泥鳅的急性毒性及鳃、肝脏组织学损伤研究[J].水生态学杂志,2016,37(1):87-92.
[7] 吴婷婷.镉和壬基酚对鲫鱼肝细胞的毒理作用及联合作用的评价[D].上海:上海海洋大学,2011.
[8] LUO Y,WANG X R,SHI H H,et al.Electron paramagnetic resonance investigation of in vivo free radical formation and oxidative stress induced by 2,4-dichlorophenol in the freshwater fish Carassius auratus[J].Environmental Toxicology & Chemistry,2010,24(9):2145-2153.endprint
[9] DRAGUN Z,MARIJI'V F,KRASNI'I N,et al.Malondialdehyde conc-entrations in the intestine and gills of Vardar chub(Squalius vardarensis,Karaman)as indicator of lipid peroxidation[J].Environmental Science & Pollution Research International,2017:1-10.
[10] PALANIKUMAR L,KUMARAGURU A K,RAMAKRITINAN C M,et al.Biochemical response of anthracene and benzo[a]pyrene in milkfish Chanos chanos[J].Ecotoxicology & Environmental Safety,2012,75(1):187-197.
[11] 孙建光,王文勇,刘舒婷.壬基酚对金鱼丙二醛含量变化率的影响[J].科技信息,2009(33):50-51.
[12] 林建清,洪华生,王新红,等.海水中多环芳烃的暴露浓度对鲈鱼体内脂质过氧化程度的影响[J].应用海洋学学报,2005,24(3):310-315.
[13] 张春玲,胡俊峰,王丕文,等.苯并(α)芘对鲫鱼肝脏总抗氧化能力的影响[J].环境与健康杂志,2004,21(5):325-326.
[14] 姚俊杰,熊铧龙,蒋左玉,等.维生素C对普安银鲫早期发育中氧化损伤及总抗氧化能力的影响[J].动物学杂志,2015,50(4):581-590.
[15] 桂琳,王晓清,康银,等.一种复合益生菌对草鱼生长和抗氧化功能的影响[J].淡水渔业,2015,45(5):83-87.
[16] 王艳艳,姚俊杰,梁正其,等.Pb2+对建鲤幼鱼抗氧化酶活性和总抗氧化能力的影响[J].淡水渔业,2013,43(1):55-58.
[17] 田鹏.水体中镉暴露对草鱼的氧化胁迫研究[D].重庆:西南大学,2013.
[18] PAN L Q,REN J,LIU J.Responses of antioxidant systems and LPO level to benzo(a)pyrene and benzo(k)fluoranthene in the haemolymph of the scallop Chlamys ferrari[J].Environmental Pollution,2006,141(3):443-451.
[19] SLATINSKA I,SMUTNA M,HAVELKOVA M,et al.Biochemical mark-ers of aquatic pollution in fish-glutathione S-transferase[J].Folia Vet Lat,2008,52:129-134.
[20] 尹曉晖,赵震宇,姜辉,等.亚致死剂量溴氰菊酯对麦穗鱼谷胱甘肽S-转移酶活性的影响[J].安全与环境学报,2005,5(4):58-60.
[21] 王汨.长江上游鱼类体内多环芳烃的含量及饲料菲对中华倒刺鲃生态毒理学影响[D].重庆:西南大学,2013.
[22] INCARDONA J P,DAY H L,COLLIER T K,et al. Developmental toxi-city of 4-ring polycyclic aromatic hydrocarbons in zebrafish is differen-tially dependent on AH receptor isoforms and hepatic cytochrome P4501A metabolism[J].Toxicology & Applied Pharmacology,2006,217(3):308-321.endprint

