化学生物学综合创新实验
——基于3D细胞模型的基因转染
刘艳红,张 骥,余孝其,李 静,王 娜
(1.四川大学 基础化学实验教学中心,四川 成都 610064;2.四川大学 化学学院,四川 成都 610064)
化学生物学是19世纪中期兴起的交叉性、实验性学科。它的出现开拓了现代化学的研究领域,为生命科学、医学和农业等传统学科的发展带来了新的机遇。在我国,发展化学生物学已经成为国家发展的重要战略[1]。为了适应学科的发展,国内多所高校相继设立了化学生物学研究方向,其中部分高校还创办了化学生物学本科专业。在本科教学阶段,化学生物学理论课程体系已逐步完善,但实验课程建设却严重滞后,缺少普遍适用的化学生物学实验教材[2]。如何结合学科前沿,加快实验项目开发,完善化学生物学实验教材是建设高校化学生物学实验课程体系亟待解决的问题。
本实验结合化学生物学研究前沿,针对本科三年级学生,设计了一个综合创新实验:将3D细胞培养技术引入本科实验教学,通过聚乙烯亚胺(PEI)介导荧光标记基因和绿色荧光蛋白报告基因的转染,观察基因在3D细胞模型中的传输及表达情况。该实验将3D细胞培养、细胞转染和激光扫描共聚焦显微镜三维重构等先进的实验技术和现代化分析方法有机地融合起来,形成了一个内容新颖、技术先进的综合创新实验,旨在向学生介绍最新的实验技术和分析方法,提高学生实践探索和分析解决问题的能力,为今后参与科研项目或从事相关领域的研究工作奠定基础。
1 实验
1.1 实验目的
学习并掌握3D细胞的培养方法;了解PEI与质粒DNA的复合方法;了解基于3D细胞模型的转染方法;基本掌握激光扫描共聚焦的原理和使用方法;提高学生查阅文献、设计实验方案的能力;加强学生对化学生物学先进实验技术、研究方法的认知。
1.2 实验原理
细胞转染是将外源基因导入真核细胞并使其获得特定遗传标志的过程[3]。传统的细胞转染实验是以单层细胞(2D细胞)作为研究模型。最新研究发现,由于2D细胞所表现的生物学特性,如细胞的形态、功能、细胞与细胞间的相互作用等[4]与体内细胞存在较大差异[5],在研究中经常会出现体内外结果无法相互支持的情况。因此,构建一种更接近于体内细胞生长环境的体外细胞模型是十分必要的。与2D细胞不同,3D细胞模型中细胞生长的微环境几乎接近于体内,可以真实地反映体内细胞与细胞、细胞与基质、细胞与微环境之间的相互作用[6-7],在一定程度上重现疾病发生发展的过程[8]。目前,3D细胞模型已经成为化学生物学学科前沿中最重要的体外研究模型[9-10]。本实验将3D细胞模型引入本科教学实验,对传统的细胞转染实验重新设计、改造,形成了一个内容充实、技术先进的综合创新实验。
PEI是一种聚阳离子载体材料,在3D细胞模型中具有良好的基因转染效率。聚乙烯亚胺含有多级胺的结构,分子表面带有较强的正电荷,在溶液中可以与带负电荷的质粒DNA通过分子间静电作用相结合,形成纳米尺寸的复合物[11]。该复合物与细胞膜表面接触,通过细胞内吞作用将外源基因导入细胞[12-13]。
1.3 实验试剂和仪器
1.3.1实验试剂
甲基纤维素,美国Amresco公司;琼脂糖、DMEM培养基和澳洲胎牛血清,美国赛默飞世尔科技公司;氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钾均为国产分析纯。
1.3.2实验仪器
TS-100型倒置显微镜,日本尼康公司;LSM780共聚焦显微镜,德国蔡司公司;二氧化碳培养箱,美国赛默飞世尔科技公司;超净工作台,苏州安泰空气技术有限公司等。
1.4 实验方法
1.4.13D细胞培养
首先,将Hela细胞消化成单细胞悬液,并计数。然后,用含0.24%甲基纤维素的完全培养基将细胞悬液稀释至1×105个/mL,并在混合均匀后将其滴加至细胞培养皿内盖上,每滴为25μL,将内盖反扣盖好后放置于温度为37℃,5% CO2的培养箱中培养。次日,将内盖上已形成的多细胞团转移至琼脂糖(质量体积比为1%)预包被的96孔板中,每孔一个细胞团,单孔加入100μL完全培养基。最后,置于培养箱中继续培养,备用[14]。
1.4.2Cy5标记质粒的转染实验
多细胞团培养72h后用于基因转染实验。转染方法包括:
1)PEI与Cy5标记质粒DNA复合。复合步骤为:PEI和质粒分别用Opti-MEM培养基稀释至50μL;然后将稀释后的质粒滴加至PEI中,室温下轻轻混匀复合30min(复合质量比为10,DNA用量为0.8μg/孔),备用。
2)细胞转染。转染步骤为:实验前,吸去96孔板内的培养基,并加入50μL无血清培养基,将PEI/DNA复合物滴加至96孔板中;培养4h后,吸去无血清培养基,加入新鲜的完全培养基(100μL/孔),将96孔板置于培养箱中继续培养20h;然后在共聚焦扫描显微镜下观察荧光信号的分布情况,随机选取3~6个视野拍照。
重复实验三次。
1.4.3报告基因的转染实验
报告基因增强绿色荧光蛋白(EGFP)的转染方法同1.4.2节步骤:将PEI与pEGFP质粒在室温下复合30min(复合质粒比为10,DNA用量为0.8μg/孔);然后滴加至96孔板中,培养4h后,更换新鲜的培养基,继续培养48h;利用激光扫描共聚焦显微镜观察绿色荧光在3D细胞模型中的分布情况,随机选取3~6个视野拍照。重复实验三次。
1.4.4观察与拍照
利用激光扫描共聚焦显微镜对3D细胞球做多层光学切片扫描后再进行三维重构,观察基因在3D细胞模型中的传输及表达情况。其中,Cy5的激发波长为633nm,最大发射波长为670nm;绿色荧光蛋白的激发波长为488nm,最大发射波长为507nm。
2 实验结果与分析
2.1 建立3D细胞培养模型
3D细胞转移至96孔板后,分别于24h、48h和72h时,在倒置显微镜下观察细胞的形态,实验结果如图1所示。其中,物镜放大倍数为4,图中标尺的长度代表100μm。培养24h时,细胞出现明显的聚集现象,形成多细胞团。此时,细胞呈圆形,大小均一,细胞与细胞间彼此接触,形成松散的细胞球,球体直径约为500μm(如图1(a)所示)。培养48h后,细胞球的直径未见明显变化,但是细胞层增厚,边缘更加光滑,形成了大小均一、结构致密的3D细胞球(如图1(b)所示)。如图1(c)所示为72h时观察到的细胞形态,3D细胞球的直径增加,细胞与细胞间的接触更加紧密,结构更加致密,此时可用于转染实验。
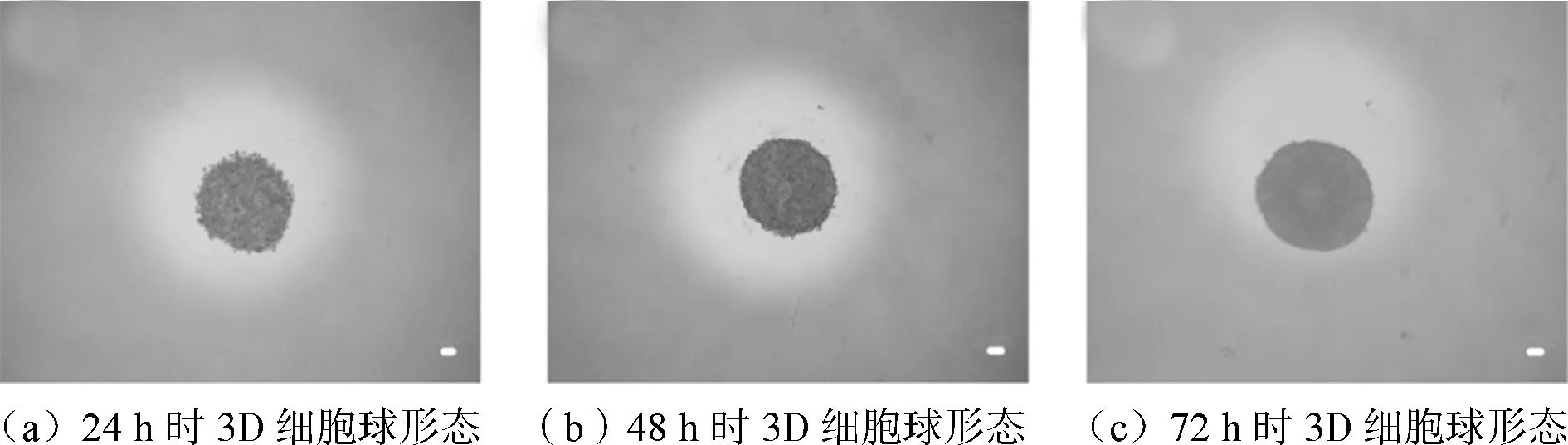
图1 培养时间对3D细胞球形态的影响
2.2 Cy5标记基因在3D细胞模型中的传输
为了考察基因在3D细胞中的传输情况,实验将荧光染料Cy5标记的质粒用于转染实验,并采用激光扫描共聚焦成像的方法进行观察,得到如图2所示的结果。其中,物镜放大倍数为10,图中标尺的长度代表5μm。Cy5标记质粒在图中显示为红色荧光,如图2所示,可观察到大量的红色荧光,且强度较强,PEI在3D细胞模型中表现出良好的DNA传输能力。三维重构(3D)效果图显示有大量的DNAcy5存在于3D细胞球内层细胞中。

图2 Cy5标记DNA在3D细胞模型中的传输情况
2.3 增强绿色荧光蛋白在3D细胞模型中的表达
为了考察PEI介导绿色荧光蛋白报告基因在3D细胞模型中的表达情况,实验将质粒pEGFP用于转染实验,实验结果如图3所示(物镜放大倍数为10,图中标尺的长度代表5μm)。结果显示:3D细胞模型中有零星绿色荧光分布,表明在该质量比时,PEI介导的报告基因在3D细胞模型中有一定的表达,但表达效率较低。在后续教学实验中可以增加转染条件优化的设计。

图3 绿色荧光蛋白在3D细胞模型中的表达
3 实验结论
本实验改变基于单层细胞的转染模型,建立了3D细胞转染体系。在质量比为10时,PEI介导的外源基因在3D细胞模型中具有良好的传输能力和一定的表达能力。
4 教学模式设计和讨论
1)将创新型设计实验的实施与开放式实验管理相结合。本实验包含了3D细胞模型的构建、基因转染、基因传输及表达结果检测等内容,所需教学时间长。在教学过程中,可以灵活调整实验室管理方法,在不影响本科实验教学的前提下,采用开放式管理模式,每个小组的学生根据实验进度来安排实验时间,确保每位同学都可以完成全部的实验操作。
2)规范实验操作,提高实验成功率。例如,3D细胞培养实验中,多细胞团转移至孔板时,需要注意移液器插入孔板的方向和吸取的力度,避免多细胞团被吹散。因此,在进行该实验教学时,需要提前指出实验操作的要点,并针对关键性步骤进行操作示范,提高实验的成功率。
3)利用多媒体教学,激发学生学习兴趣。例如:采用多媒体技术将3D细胞培养模型的发展过程和技术要点以图片和视频的方式展示给学生,通过强烈的感观刺激激发学生学习的兴趣。
5 结束语
将先进的实验技术和现代化分析方法引入本科教学,不断充实实验教学内容是四川大学实验课程教学改革的基本思路。“基于3D细胞模型的基因转染”综合创新实验的设计是化学生物学实验教学改革的一次重要尝试,也是化学生物学实验课程建设的试金石。而这种将先进的实验技术和现代化分析方法转化为本科实验教学内容,实现科研与教学相互支持、相互转化的模式也必将成为四川大学化学生物学实验项目开发的特色。

