结核分枝杆菌耐氯法齐明相关基因研究进展
刘柏杉,贺仁忠
世界卫生组织(WHO)发布的最新全球结核病报告显示,2017年全球范围内新发结核病患者数量约为1 000万,其中因结核病死亡患者数量约为160万,估计新发耐利福平结核病(RR-TB)患者数量约为55.8万,新发耐多药结核病(MDR-TB)患者数量约为45.756万;近一半新发耐药结核病患者集中于印度(占24%)、中国(占13%)、俄罗斯(占10%)。近年来,随着一线抗结核药物耐药率逐渐升高,二线抗结核药物及新研发的抗结核药物逐渐应用于临床;目前,共有17种抗结核药物处于Ⅰ~Ⅲ期临床试验阶段,其中8 种抗结核药物为新化合物[1]。
氯法齐明最初主要用于治疗麻风病,目前,含氯法齐明抗结核化疗方案治疗MDR-TB处于Ⅲ期临床试验阶段[1],但已有多项研究证实,多种含氯法齐明二线抗结核治疗方案可能作为治疗MDR-TB的标准化组合,并可缩短药物敏感结核病及MDR-TB疗程,改善患者预后[2-6]。2010年,VAN等[7]进行的一项研究结果显示,加替沙星、乙胺丁醇、吡嗪酰胺、氯法齐明联用并于4个月强化期或痰涂片转阴后加用卡那霉素、丙硫异烟胺、异烟肼(总疗程9个月)可将MDR-TB治疗失败率降低至1%,将复发率控制在12%左右。据统计,1993—2011年全球范围内采用含氯法齐明抗结核化疗方案治疗MDR-TB的治愈率及有效率>75%[8]。氯法齐明常见毒副作用以皮肤变黑、胃肠道反应为主,严重毒副作用很少见,QT间期延长亦较为罕见[9-10]。氯法齐明是目前WHO推荐的二线核心抗结核药物之一,主要用于治疗RR-TB、MDR-TB等,但近年来结核分枝杆菌对氯法齐明耐药现象增多。本文综述了结核分枝杆菌耐氯法齐明相关基因,旨在为结核分枝杆菌对氯法齐明的耐药机制研究提供参考。
1 作用机制
目前,氯法齐明的具体作用机制尚不完全清楚,多数研究认为其作用机制主要包括以下3个方面:(1)烟酰胺腺嘌呤二核苷酸(NADH)贡献电子是结核分枝杆菌呼吸链的初始事件,氯法齐明通过与重组Ⅱ型烟酰胺腺嘌呤二核苷酸脱氢酶(NDH-2)底物甲基萘醌竞争NADH贡献的电子而产生还原型氯法齐明,随后被分子氧化并形成超氧化物、过氧化氢(H2O2),最终通过释放活性氧而产生抗结核分枝杆菌作用[3,11-13];(2)氯法齐明通过溶血磷脂介导的膜功能障碍而几乎完全地抑制K+的吸收,并可能通过干扰革兰阳性菌、结核分枝杆菌膜电位而导致其三磷腺苷(ATP)含量降低,因此氯法齐明介导的磷脂酶增强作用可导致抗增殖溶血磷脂分泌增多,进而造成K+转运蛋白功能障碍并发挥抗结核分枝杆菌作用[3,12,14]。(3)氯法齐明能逆转结核分枝杆菌衍生因子对吞噬细胞细胞内杀伤机制的抑制作用,有助于增强吞噬细胞对结核分枝杆菌的吞噬作用,且氯法齐明的t1/2较长、药代动力学较好[10]。
2 耐药基因
目前已知的结核分枝杆菌对氯法齐明耐药相关基因包括3种,分别为Rv0678、Rv2535c、Rv1979c。
2.1 Rv0678基因 Rv0678基因ID为888235,全长498 bp,编码产物为调控蛋白。Rv0678属MarR调控基因之一,广泛存在于细菌中,具有多种生物学效应,如对抗菌药物的耐药性、对氧化应激的敏感性及毒力因子的调控等[15]。Rv0678突变是结核分枝杆菌对氯法齐明耐药的重要机制。2015年,ZHANG等[16]通过对96株耐氯法齐明结核分枝杆菌进行全基因组测序、Sanger测序发现,97%(93/96)的耐氯法齐明结核分枝杆菌突变体存在Rv0678突变,其中70%(65/93)的耐氯法齐明Rv0678突变结核分枝杆菌Rv0678功能失活;该研究同时发现两个突变热点,分别为G193和C466T,其中G193突变频率为43.8%(42/96),主要为删除/插入突变,而C466T突变频率为11.5%(11/96);此外,该研究还发现C364插入、A202G〔丝氨酸(Ser)68甘氨酸(Gly)〕突变频率均为5.2%(5/96),其余34个基因突变散布、无明显重叠。2017年,ISLAM等[3]研究证实,Rv0678突变以G193和C466T突变最为常见(见表1)。
2017年,PANG等[17]以氯法齐明对结核分枝杆菌最低抑菌浓度(MIC)>1 μg/ml为耐氯法齐明结核分枝杆菌判定标准,结果发现结核分枝杆菌对氯法齐明耐药率为5.6%(5/90),其中3株耐氯法齐明结核分枝杆菌由于53位密码子突变、1株耐氯法齐明结核分枝杆菌由于157位密码子突变而导致氨基酸替换,另1株耐氯法齐明结核分枝杆菌未发现基因突变;该研究同时发现,贝达喹啉对这5株耐氯法齐明结核分枝杆菌的MIC均升高≥4倍,以贝达喹啉对结核分枝杆菌MIC>0.25 μg/ml为耐贝达喹啉结核分枝杆菌判定标准,则其中4株对贝达喹啉耐药。此外,该研究还发现两株结核分枝杆菌Rv0678基因53位密码子突变导致Ser53脯氨酸(Pro),氯法齐明对其MIC为2~4 μg/ml,贝达喹啉对其MIC为0.50 μg/ml;1株结核分枝杆菌Rv0678基因53位密码子突变导致Ser53亮氨酸(Leu),氯法齐明对其MIC为2 μg/ml,贝达喹啉对其MIC为0.25 μg/ml;1株结核分枝杆菌Rv0678基因157位密码子突变导致酪氨酸(Tyr)157天冬氨酸(Asp),氯法齐明对其MIC为2 μg/ml(见表1)。
综上所述,Rv0678常见突变类型以G193删除/插入、C466T〔精氨酸(Arg)156终止密码子〕、A202G(Ser68Gly)、Ser53Pro、Ser53Leu为主,结核分枝杆菌对氯法齐明耐药率为5.6%,同时Rv0678突变可导致贝达喹啉与氯法齐明交叉耐药。
2.2 Rv2535c基 因(PepQ基 因) Rv2535c基 因ID为888409,全长1 119 bp,编码产物可能是细胞质肽酶。Rv2535c编码具有两个结构域的蛋白,即a100-aa N-末端α/β结构域和250 kDa C-末端肽酶结构域,推测Rv2535c编码Pro特异性氨肽酶并可能优先水解氨基酸中位于较大的寡肽末端的Xaa-Pro键。2016年,ALMEIDA等[18]研究发现3株耐氯法齐明结核分枝杆菌均存在Rv2535c突变,分别为14位密码子〔丙氨酸(Ala)〕中插入C碱基导致移码突变、催化结构域中271位密码子(Arg)中C碱基删除导致移码突变、N-末端结构域中非同义单核苷酸突变(Leu44Pro),且贝达喹啉、氯法齐明对这3株耐氯法齐明结核分枝杆菌的MIC升高4~8倍,分别为 0.12~0.25 μg/ml、0.5~1.0 μg/ml(见表 1),证实Rv2535c突变与结核分枝杆菌对氯法齐明、贝达喹啉耐药有关;该研究还指出,广泛耐药结核分离株(X16和X23;北京株系)Rv2535c存在Ser66Pro。2015年,ZHANG等[16]研究发现,对氯法齐明耐药结核分枝杆菌突变体CT1-5中存在G265T突变,并于Rv2535c基因E89形成终止密码子(见表1)。
综上所述,目前研究发现的结核分枝杆菌Rv2535c突变较少,但可以明确的是Rv2535c突变与氯法齐明耐药有关,且Rv2535c突变可导致结核分枝杆菌对氯法齐明与贝达喹啉交叉耐药。
2.3 Rv1979c基因 Rv1979c基因ID为885819,全长1 446 bp,编码产物可能为通透酶。研究发现,对氯法齐明耐药的结核分枝杆菌突变体CT3-5存在T1052C突变并导致Rv1979c缬氨酸(Val)351Ala,对氯法齐明耐药的结核分枝杆菌突变体存在Rv0678 G193插入、G193删除同时出现Rv1979c T1052C(Val351Ala)并可能会导致结核分枝杆菌对氯法齐明的耐药性升高(MIC>1 μg/ml)[3,10,16-17](见表 1)。目前,关于Rv1979c突变的研究报道较少,虽可通过有限的研究资料发现Rv1979c突变与结核分枝杆菌对氯法齐明耐药有关,但其具体机制尚不完全清楚,可能与该基因编码参与氨基酸转运的通透酶而直接或间接影响氯法齐明的转运或摄取有关[16]。
3 耐药机制
3.1 Rv0678基因 目前研究认为,Rv0678基因突变与药物外排是结核分枝杆菌对氯法齐明耐药的主要机制,其中MMPS5-MMPL5转运体是具有重要作用的外排泵。MMPS5与跨膜MMPL5组合形成的通道及MMPS5-MMPL5外排泵复合体属耐药结节化细胞分化家族(RND),小结核分枝杆菌膜蛋白(MMPS)常作为辅助性蛋白协同质子依赖型多药耐药泵(MMPL)转运蛋白及相关毒力因子。研究表明,MMPS5-MMPL5转运体的表达主要受MARR调节剂Rv0678调控,其开放阅读框位于MPS5-MMPL5操纵子下游[11,15,19]。Rv0678编码MMPS5-MMPL5外排泵基因的转录阻遏物,是MMPS5、MMPL5的负调控因子;在基因组中,共识框启动子蛋白回文区域与Rv0678编码的MMPS5-MMPL5外排泵基因转录阻遏物结合可阻止转录,Rv0678突变导致MMPS5-MMPL5外排泵基因过表达及药物过度外排,继而导致结核分枝杆菌对氯法齐明耐药。外排泵抑制剂如维拉帕米、利血平等可能使氯法齐明、贝达喹啉对结核分枝杆菌的MIC下降,但当MIC较高时外排泵抑制剂敏感性降低,反而对野生型结核分枝杆菌的抑制作用更强,其原因可能与体内流出物水平与体外不同、不同作用的抗结核药物相互作用导致组合体内作用丧失等有关[11,20-23]。
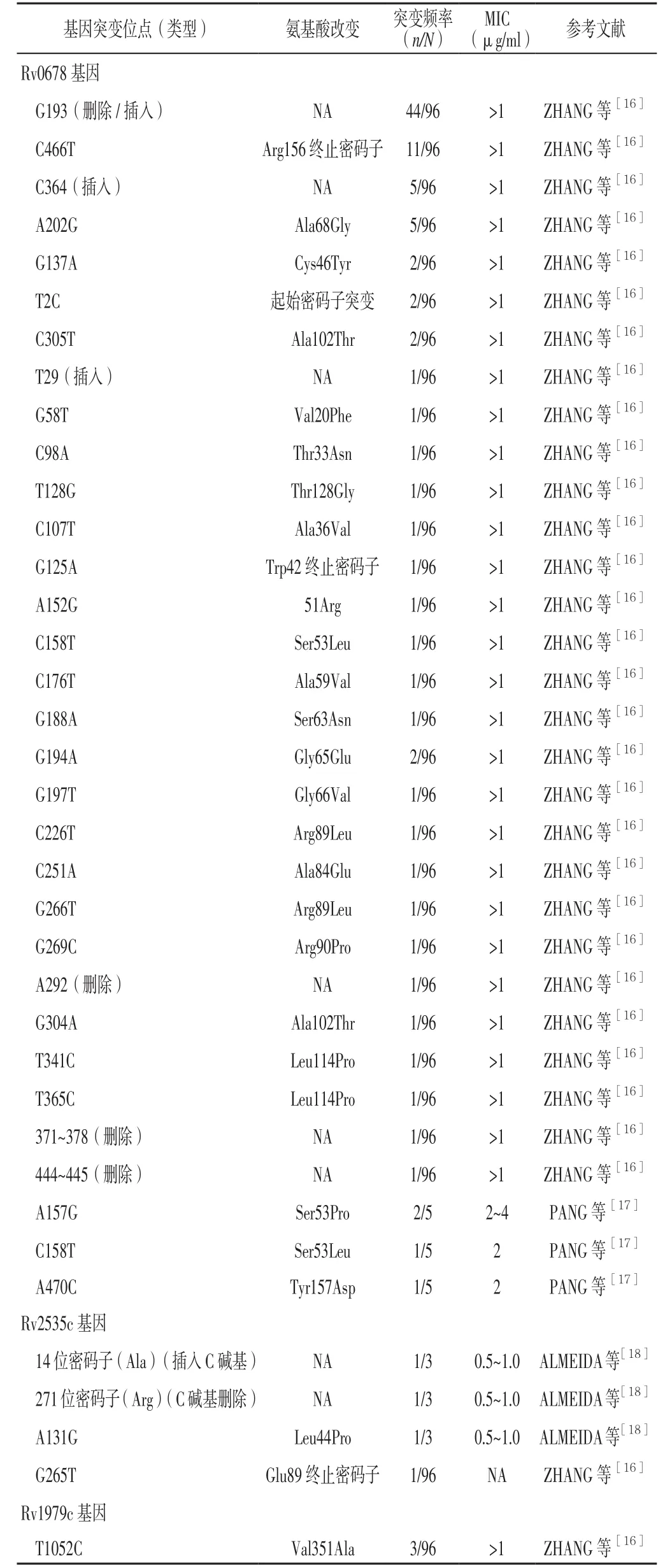
表1 已知的氯法齐明耐药相关基因突变位点(类型)、氨基酸改变及MICTable 1 Known drug resistance related gene mutation site(types)to cycloserine,changes of amino acids and the MIC
3.2 Rv2535c基因 Rv2535c基因突变导致结核分枝杆菌对氯法齐明耐药的机制与Rv0678较为相似,但确切机制尚未完全明确。2016年,ALMEIDA等[18]研究表明,细菌中延长因子P(EF-P)支持Rv2535c调节过程中以某种方式成熟和/或特定蛋白的更新并维持结核分枝杆菌的代谢状态敏感性,而与Rv0678突变不同的是,Rv2535c突变与MMPL5或MMPS5过表达无关,Rv2535c突变介导的结核分枝杆菌对氯法齐明耐药可能与药物外流增加、MMPS5-MMPL5转运体增加或其他外排调节机制(如防止MMPL5降解)等有关。
3.3 氯法齐明与贝达喹啉交叉耐药 值得关注的是,多项研究提及氯法齐明与贝达喹啉具有相同的外排泵底物及耐药基因(如Rv0678、Rv2535c),因此氯法齐明与贝达喹啉存在交叉耐药性,且贝达喹啉、氯法齐明不会减少彼此的耐药性[17-18,20]。有研究表明,基于外排泵的基因突变通常导致较低水平的耐药性,一般基于外排泵的基因突变导致氯法齐明对结核分枝杆菌的MIC是敏感菌株的2~16倍,而基于目标基因突变导致氯法齐明对结核分枝杆菌的MIC是敏感菌株的16~1 000倍,因此Rv0678、Rv2535c突变所致结核分枝杆菌对氯法齐明或氯法齐明与贝达喹啉交叉耐药是低水平耐药[3,18,20]。
3.4 Rv1979c基因 Rv1979c基因突变频率较低,而Rv1979c突变导致结核分枝杆菌对氯法齐明耐药的具体机制尚不完全清楚,Rv1979c可能编码参与氨基酸转运的通透酶,因此Rv1979c突变可能通过直接或间接影响氯法齐明的转运或摄取而导致结核分枝杆菌对氯法齐明耐药[16];此外,Rv1979c突变可与Rv0678突变同时存在并导致结核分枝杆菌对氯法齐明耐药风险升高。
4 小结与展望
综上所述,目前已知的结核分枝杆菌耐氯法齐明相关基因包括Rv0678、Rv2535c、Rv1979c 3种,其中Rv0678突变频率较高,是结核分枝杆菌对氯法齐明耐药的主要机制之一。氯法齐明作为WHO推荐的二线核心抗结核药物之一,具有独特的作用机制且耐药率较低、毒副作用较轻,治疗MDR-TB的前景广阔,但其耐药性不容忽视、耐药机制仍有未明确之处,仍需通过全基因测序、大样本量研究等进一步探索新的耐药基因及确切耐药机制,为有效防控耐药结核病提供参考。

