富硒黄芪提取物对链脲霉素诱导的糖尿病大鼠胰岛素抵抗的影响
李永荣,程 涛,王永胜,李 钦,高 博,贺 云,白 宇
(1甘肃中医药大学附属医院,兰州 730020;2甘肃省中医药研究院,兰州 730050;3甘肃省中医院,兰州 730050;4甘肃卫生职业学院,兰州 730200;5甘肃中医药大学,兰州 730000)
胰岛素抵抗(insulin resistance,IR)是组织对胰岛素反应不灵敏,胰岛素受体后信号传导障碍所导致[1]。机体长期处于代偿性高胰岛素状态,随着胰岛功能减退,胰岛素分泌出现相对不足从而诱发2型糖尿病(type 2 diabetes mellitus,T2DM)[2]。改善胰岛素抵抗是缓解T2DM重要策略[3]。目前改善T2DM胰岛素抵抗药物主要通过提高胰岛素分泌和增加外周胰岛素靶器官的胰岛素敏感性实现的[4-5]。临床用药以化学药为主,中药为辅。T2DM是慢性疾病,需长期服药,对于我国糖尿病患者,化学药价格昂贵,药费是一笔巨大的开支,由此所导致的用药持续性降低,将使药效不尽如人意[6-7]。因此,在我国中医宝库中寻找对T2DM疗效好、价格便宜的药物变得尤为重要和迫切。国内不少学者也在努力从中药开发治疗T2DM药物[8-9]。黄芪作为常用中药,性温味甘,归肺、脾经,有补气固表、利尿托毒、排脓、敛疮生肌之效。黄芪具有很强的硒富积能力,硒可增强机体抗氧化能力和免疫力,以黄芪为载体富积硒元素生产富硒黄芪将会有更高的药用价值[10]。研究发现黄芪提取物成分有毛蕊异黄酮苷、芒柄花苷、总皂苷、总黄酮、总酚酸、总多糖[11],其中主要含有皂苷(9.01%)、黄酮(8.12%)、多糖(81.12%)以及酚酸(1.75%),现代药理学发现,黄芪中提取的黄芪多糖、皂苷、黄酮等化合物具有增强免疫功能、抗细胞凋亡、抗应激、抗衰老、保护心肌细胞及改善心功能和心肌纤维化、保肝、利尿、降压降脂以及抗炎等多种药理作用[12-14]。但是富硒黄芪提取物的主要成分及其药理作用并未有人进行研究,对T2DM胰岛素抵抗的影响尚未见报道。本研究将以链脲霉素(STZ)诱导的糖尿病大鼠为研究对象,探索富硒黄芪提取物对胰岛素抵抗的作用,为富硒黄芪提取物改善胰岛素抵抗提供理论依据,为进一步研究富硒黄芪提取物成分及其各成分药理作用提供理论参考。
1 材 料
1.1 药物与试剂
富硒黄芪,产地甘肃渭源,由渭源县康荣中药材科技有限公司培育;提取物的制备:将药材粉碎过10目筛,加水浸泡30 min,经超声提取2次,每次45 min,然后合并滤液,浓缩,滤过,加适量蒸馏水,将溶液pH调至近中性,G4垂熔玻璃漏斗滤过,使其成为1 g/mL水溶液,灭菌,冷藏备用。使用前用生理盐水稀释成40 mg/mL。
胰岛素(insulin)ELISA试剂盒、肿瘤坏死因子α(TNF-α)ELISA试剂盒、白细胞介素6(IL-6)ELISA试剂盒、C反应蛋白(CRP)ELISA试剂盒、白细胞介素1β(IL-1β)ELISA试剂盒均购自上海酶联生物有限公司;兔抗胰岛素受体底物蛋白1(IRS1)多克隆抗体、兔抗磷酸化IRS1(p-IRS1)多克隆抗体、兔抗核因子κB抑制子激酶β(IKKβ)单克隆抗体、兔抗磷酸化IKKβ(p-IKKβ)多克隆抗体、兔抗c-Jun氨基末端激酶(JNK1)单克隆抗体、兔抗磷酸化JNK1(p-JNK1)多克隆抗体均购自英国Abcam公司;HRP标记山羊抗兔二抗(中国碧云天生物科技有限公司)。
1.2 仪 器
血糖仪(德国罗氏公司);2700型全自动生化仪(日本Olympus公司);酶标仪(美国伯乐公司);电泳装置、转膜装置、电泳仪(北京六一公司)。
1.3 动 物
SPF级雄性SD大鼠90只,7~8周龄,SPF级动物房条件下饲养,自由饮水、摄食。由甘肃中医药大学实验动物中心提供,许可证号:SYXK(甘)2015-0005。
2 方 法
2.1 造 模
参照文献造模[15]:大鼠适应性饲养1周后,空白组10只,其余给予高糖高脂饲料(配方:18%猪油,20%蔗糖,3%胆固醇,基础饲料59%),4周末根据血脂含量对大鼠进行筛选,选择高血脂大鼠尾静脉注射STZ(25 mg/kg),1周后取尾静脉血测定血糖,随机血糖稳定大于16.7 mmol/L者诊断为2型糖尿病,未成功模型追加注射1次STZ(12.5 mg/kg),最终有72只成模,成模率为90.00%。筛选造模成功的大鼠50只,随机分为模型组、药物组[富硒黄芪提取物低(LESAM)、中(MESAM)、高剂量(HESAM)]、阳性对照组(吡格列酮),每组10只。
2.2 分组给药
参照文献[16]:LEASM、MESAM、HESAM组分别按100,200,400 mg/kg体质量灌胃;正常组、模型组灌服相同体积的生理盐水;阳性对照组按10 mg/kg灌服吡格列酮。每日1次,连续4周。
2.3 一般情况与体质量
观察大鼠一般状况、饮水量、摄食量、体质量、随机血糖。其中体质量在造模前1次、造模后第0,2,4周各1次分别检测记录。
2.4 样本采集
给药4周末,禁食不禁水12 h,测定空腹血糖和体质量后,4%水合氯醛麻醉大鼠,摘眼球采血,分离血清,-20 ℃保存。采血后处死大鼠,分离肝脏,将肝脏切成若干份,根据不同检测方法,分别置于液氮中储存,待检测。
2.5 空腹血糖(FBG)和空腹胰岛素(FINS)检测
禁食不禁水12 h,FBG采用尾静脉取血法在造模前1次、造模后第0、2、4周各1次分别检测记录。FINS采用放射性免疫吸附法在灌药4周末,禁食不禁水12 h,采血进行检测。胰岛素抵抗稳态评估模型(homeostesis model assessment of insulin resistance,HOMA-IR)=(FBG×FINS)/22.5[17]。
2.6 血清生化指标检验
采用全自动生化仪检测给药4周后采集的血清中总胆固醇(CHOL)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。
2.7 血清中TNF-α、IL-6、CRP、IL-1β检测
根据ELISA试剂盒说明书进行检测。简要步骤如下:设置标准孔和样品孔,标准孔加入标准品50 μL,样品孔以每孔50 μL加入待测样品,以不加样品和酶标试剂的孔作为空白孔,37 ℃孵育30 min,洗涤甩干,加酶标试剂50 μL,孵育后洗涤甩干,显色15 min,终止后450 nm处于酶标仪上检测吸收度。
2.8 肝脏组织中IRS1、p-IRS1、IKKβ、p-IKKβ、JNK、p-JNK蛋白检测
取新鲜液氮速冻的肝脏组织,PBS洗涤后,组织中加入预冷RIPA裂解液在冰上研碎,待裂解后收集于离心管中,继续裂解30 min,13 000 r/min离心,收集上清,测定蛋白浓度,加入4×上样缓冲液,煮沸5 min,充分变性,-20 ℃保存备用。制胶:10%分离胶+5%浓缩胶;按蛋白浓度确定上样量;然后经过电泳,转膜,封闭,一抗孵育过夜(IRS1、p-IRS1、IKKβ、p-IKKβ抗体均以1∶2 000稀释;JNK1、p-JNK1抗体均以1∶1 500稀释;内参以1∶3 000 稀释),PBS洗涤,二抗(以1∶6 000稀释)室温孵育1.5 h,PBS洗涤,ECL发光液显色,X射线片显影,拍照。
2.9 统计学方法
3 结 果
3.1 ESAM对STZ诱导的糖尿病大鼠一般情况的影响
正常组大鼠行动活跃、毛色光泽、精神状态良好、行动敏捷、反应灵敏,尿量、饮食正常。模型组大鼠毛色灰暗、行动迟缓、精神不佳、对外界刺激不灵敏、活动少,尿量和饮食量增加。给予药物干预后,各干预组大鼠与模型组相比,毛色、活动量、灵敏度、精神状态以及尿量和饮食量均出现不同程度的恢复,其中ESAM高剂量组大鼠与吡格列酮组在各项指标的恢复程度上无明显区别。
3.2 ESAM对STZ诱导的糖尿病大鼠体质量、FPG、FINS以及HOMA-IR的影响
与正常组相比,模型组体质量显著下降(P<0.01),血液中FPG显著上升(P<0.05),HOMA-IR显著增大(P<0.01),血液中FINS无显著变化(P>0.05);与模型组相比,阳性药物组、ESAM中、高剂量组大鼠体质量显著上升(P<0.05),血液中FPG含量显著下降(P<0.05),血液中FINS无显著变化(P>0.05),HOMA-IR显著降低(P<0.05),其中ESAM高剂量组大鼠与吡格列酮组在各项指标上无显著区别。
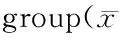
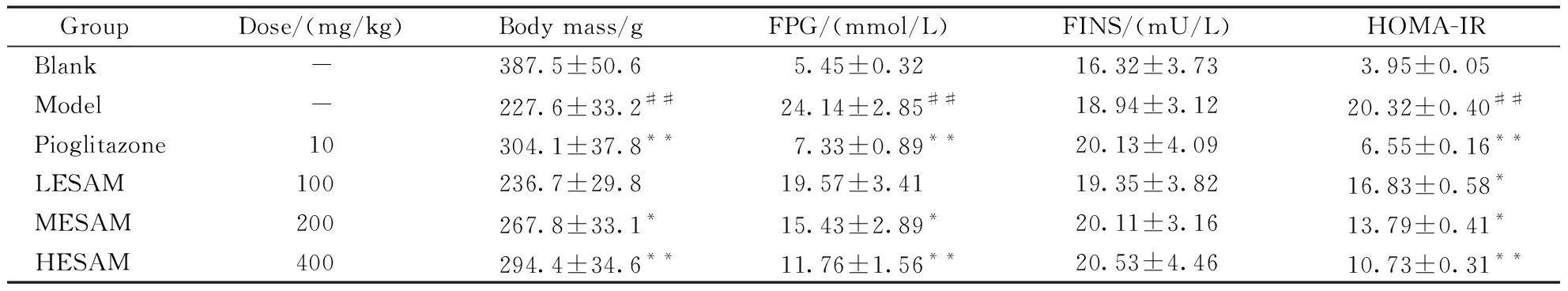
GroupDose/(mg/kg)Body mass/gFPG/(mmol/L)FINS/(mU/L)HOMA-IRBlank-387.5±50.65.45±0.3216.32±3.733.95±0.05Model-227.6±33.2##24.14±2.85##18.94±3.1220.32±0.40##Pioglitazone10304.1±37.8**7.33±0.89**20.13±4.096.55±0.16**LESAM100236.7±29.819.57±3.4119.35±3.8216.83±0.58*MESAM200267.8±33.1*15.43±2.89*20.11±3.1613.79±0.41*HESAM400294.4±34.6**11.76±1.56**20.53±4.4610.73±0.31**
LESAM:Low-dose group of extract of selenium-enrichedAstragalusmembranaceus(ESAM);MESAM:Medium-dose group of ESAM;HESAM:High-dose group of ESAM;FPG:Fasting plasma glucose;FINS:Fast serum insulin
##P<0.01vsblank group;*P<0.05,**P<0.01vsmodel group
3.3 ESAM对STZ诱导的糖尿病大鼠CHOL、TG、HDL以及LDL的影响
与正常组相比,模型组大鼠血液中CHOL、TG、HDL含量显著上升(P<0.05),HDL无显著变化(P>0.05);与模型组相比,阳性药物组、ESAM中、高剂量组大鼠血液中CHOL、TG、HDL含量显著下降(P<0.05),HDL含量无显著变化(P>0.05)。ESAM高剂量组大鼠与吡格列酮组在各项指标上无显著区别。
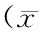
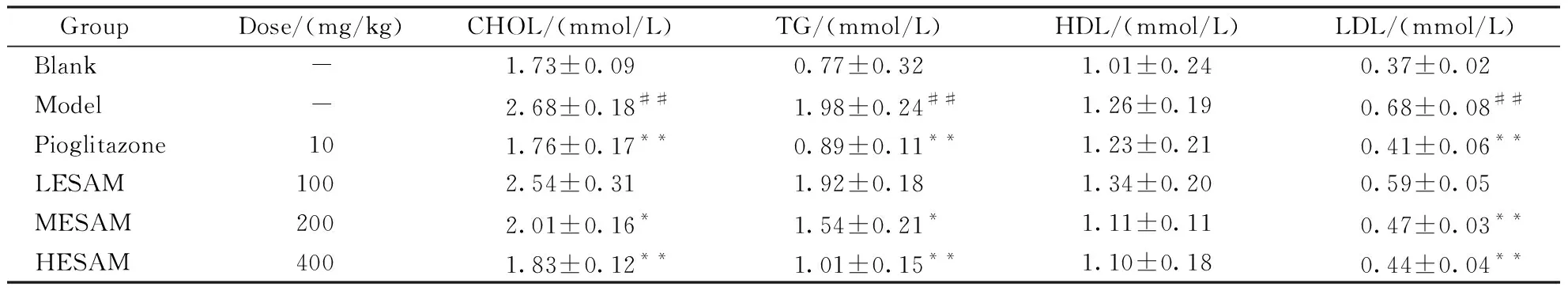
GroupDose/(mg/kg)CHOL/(mmol/L)TG/(mmol/L)HDL/(mmol/L)LDL/(mmol/L)Blank-1.73±0.090.77±0.321.01±0.240.37±0.02Model-2.68±0.18##1.98±0.24##1.26±0.190.68±0.08##Pioglitazone101.76±0.17**0.89±0.11**1.23±0.210.41±0.06**LESAM1002.54±0.311.92±0.181.34±0.200.59±0.05MESAM2002.01±0.16*1.54±0.21*1.11±0.110.47±0.03**HESAM4001.83±0.12**1.01±0.15**1.10±0.180.44±0.04**
CHOL:Cholesterol;TG:Triglyceride;HDL:High density lipoprotein;LDL:Low density lipoprotein
##P<0.01vsblank group;*P<0.05,**P<0.01vsmodel group
3.4 ESAM对STZ诱导的糖尿病大鼠肝脏组织中IRS1、p-IRS1的影响
IRS1总蛋白在各组大鼠肝脏组织中无显著变化(P>0.05);与空白组相比,模型组大鼠肝脏组织中p-IRS1蛋白含量显著增加(P<0.05);与模型组相比,阳性药物组、ESAM中、高剂量组大鼠肝脏组织中p-IRS1含量显著减少(P<0.05)。p-IRS1蛋白变化在ESAM高剂量组大鼠与吡格列酮组之间比较无显著区别。
3.5 ESAM对STZ诱导的糖尿病大鼠肝脏组织中IKKβ/p-IKKβ、JNK/p-JNK蛋白的影响
IKKβ和JNK总蛋白在各组大鼠肝脏组织中无显著变化(P>0.05);与空白组相比,模型组大鼠肝脏组织中p-IKKβ、p-JNK蛋白含量显著增加(P<0.05);与模型组相比,阳性药物组、ESAM中、高剂量组大鼠肝脏组织中p-IKKβ、p-JNK蛋白含量显著减少(P<0.05)。各蛋白变化在ESAM高剂量组大鼠与吡格列酮组之间比较无显著区别。
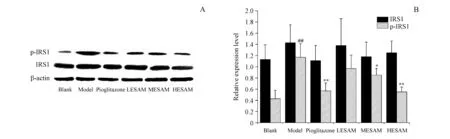
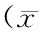
A:Western blot strips;B:Statistical analysis of Western blot strips
##P<0.01vsblank group;*P<0.05,**P<0.01vsmodel group
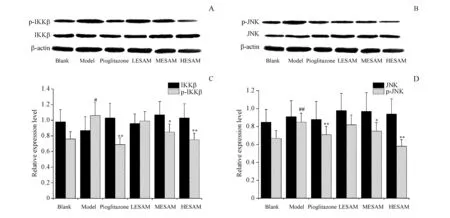
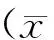
A,B:Western blot strips;C,D:Statistical analysis of Western blot strips
##P<0.01vsblank group;*P<0.05,**P<0.01vsmodel group
3.6 ESAM对STZ诱导的糖尿病大鼠血清中TNF-α、IL-6、CRP、IL-1β的影响
与正常组相比,模型组大鼠血清中TNF-α、IL-6、CRP、IL-1β显著上升(P<0.05);与模型组相比,阳性药物组、ESAM中、高剂量组大鼠血清中TNF-α、IL-6、CRP、IL-1β含量显著下降(P<0.05)。各因子变化在ESAM高剂量组大鼠与吡格列酮组之间比较无显著区别。
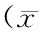
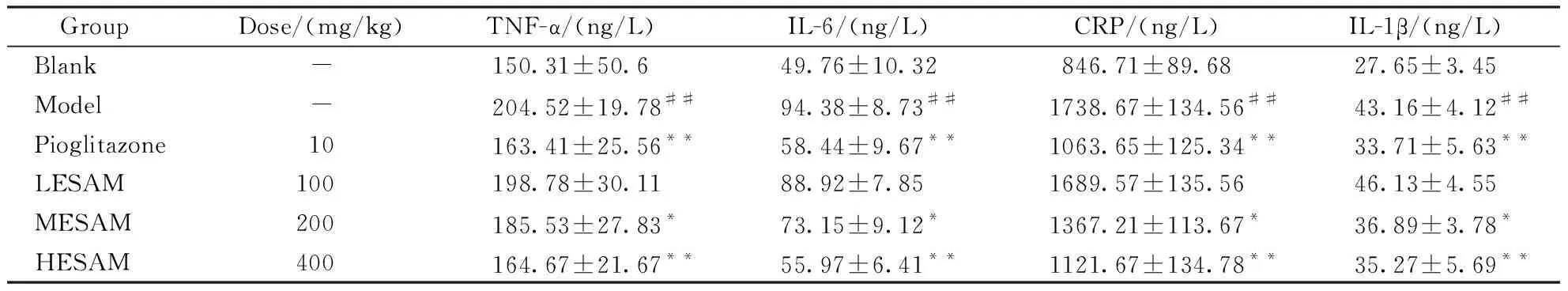
GroupDose/(mg/kg)TNF-α/(ng/L)IL-6/(ng/L)CRP/(ng/L)IL-1β/(ng/L)Blank-150.31±50.649.76±10.32846.71±89.6827.65±3.45Model-204.52±19.78##94.38±8.73##1738.67±134.56##43.16±4.12##Pioglitazone10163.41±25.56**58.44±9.67**1063.65±125.34**33.71±5.63**LESAM100198.78±30.1188.92±7.851689.57±135.5646.13±4.55MESAM200185.53±27.83*73.15±9.12*1367.21±113.67*36.89±3.78*HESAM400164.67±21.67**55.97±6.41**1121.67±134.78**35.27±5.69**
##P<0.01vsblank group;*P<0.05,**P<0.01vsmodel group
4 讨 论
IR是诱发T2DM的主要病因,其伴随T2DM发生、发展的整个过程。目前对T2DM的治疗药物大部分都基于改善IR开发的。为研究富硒黄芪提取物对IR的作用,本实验采用高脂高糖饲料喂养,低剂量STZ注射损伤胰岛β细胞建造T2DM模型,造模后,对比各组大鼠一般状况发现与空白组大鼠相比,模型组大鼠毛色灰暗、活动减少、反应迟钝。对FPG和FINS检测发现与空白组相比,模型组FPG显著升高(P<0.05),FINS略微上升(P>0.05),HOMA-IR显著升高(P<0.05),可知虽然FINS分泌量有所升高,空腹血糖却依然稳定在高水平,导致INS相对不足,出现IR特征。以上结果初步提示T2DM建模成功。
进一步本研究用不同浓度富硒黄芪提取物干预T2DM模型,经过4周后检测血液中FPG和FINS,结果发现与模型组相比,富硒黄芪提取物中、高剂量组大鼠血液中FPG含量显著下降(P<0.05)、FINS含量各组间无显著变化(P>0.05),HOMA-IR显著下降(P<0.05),体重显著上升(P<0.05),提示富硒黄芪提取物可改善T2DM的IR,提高T2DM的INS敏感性,降低FPG。
肥胖是导致IR的重要原因。研究显示[18]由肥胖所导致的脂质代谢紊乱、炎症因子分泌增加以及胰岛素靶细胞信号通路异常、线粒体功能障碍均可引起IR。血清中游离脂肪酸(FFA)如CHOL、TG以及LDL含量变化是脂质代谢紊乱的重要指标。已有研究发现血液中高水平FFA可导致外周组织对胰岛素敏感性下降,葡萄糖摄取减少[19-20],长期降低血液中FFA水平,可改善IR[21-22]。FFA导致IR的关键分子机制在于胰岛素信号通路中IRS蛋白的化学修饰发生改变。一般情况下IRS1以ser307位点非磷酸化状态存在,该状态下胰岛素信号通路激活,而FFA能通过活化IKKβ(ser181)和JNK(Thr183/Tyr185)介导IRS1 ser307位点发生磷酸化,导致胰岛素信号通路抑制[23-25]。炎症因子可抑制甘油三脂合成,促进脂解,导致血液中FFA水平上升,继而引发IR[26-28],同时炎症因子也可直接对胰岛素信号通路产生抑制作用[29]。为研究富硒黄芪提取物改善IR的分子机制,本研究对富硒黄芪提取物干预后的各组大鼠血液中FFA;肝脏组织中IRS1、p-IRS1、IKKβ/p-IKKβ和JNK/p-JNK蛋白;以及血清中TNF-α、IL-6、CRP、IL-1β炎症因子水平进行检测。研究发现模型组大鼠中CHOL、TG以及LDL含量显著上升,富硒黄芪提取物中、高剂量可显著降低T2DM大鼠血液中CHOL、TG以及LDL含量,对HDL影响不大。提示富硒黄芪提取物可通过降低T2DM大鼠血液中FFA含量对IR起一定的改善作用。对T2MD大鼠肝脏组织中IRS1、p-IRS1检测发现富硒黄芪提取物对各组大鼠肝脏组织中总IRS1蛋白表达无显著影响,各组间表达无差异。但与模型组相比,富硒黄芪提取物中、高剂量组肝脏组织中p-IRS1表达量显著降低(P<0.05)。在总IRS1蛋白不变的情况下,p-IRS1降低,则非磷酸化IRS1升高。进一步检测IKKβ、p-IKKβ和JNK、p-JNK蛋白表达发现富硒黄芪提取物对T2DM大鼠肝脏组织中IKKβ和JNK总蛋白表达无影响,但可降低肝脏组织中p-IKKβ和p-JNK含量,其中与模型组相比,中、高剂量组差异有统计学意义(P<0.05)。综上提示富硒黄芪提取物可降低T2DM大鼠血液中FFA含量,抑制IKKβ和JNK磷酸化活化,进一步抑制IRS1的磷酸化,进而改善T2DM大鼠的IR。
在炎症水平上,本研究发现富硒黄芪提取物可降低T2DM大鼠血液中TNF-α、IL-6、CRP、IL-1β炎症因子的含量,提示富硒黄芪提取物可通过抑制T2DM大鼠炎症因子,间接抑制由此介导的脂解和FFA水平或直接解除炎症因子对胰岛素通路的抑制,改善T2DM大鼠IR。
本研究还发现ESAM对T2DM模型胰岛素抵抗的改善作用与目前临床上使用的吡格列酮的改善作用相似,无显著差别。加之ESAM作为中药提取物可具有较低的不良反应,因此具有较好的临床应用优势,但需要进一步进行实验证实。
综上所述,富硒黄芪提取物可通过降低T2DM大鼠炎症因子的表达,抑制FFA的升高,降低周围组织中IKKβ和JNK磷酸化活化,进而激活胰岛素通路,改善T2DM的IR作用。

