HPV16 E6-G350基因表达促进宫颈癌C33A细胞增殖且抑制凋亡
潘贞贞 ,宋宇宁 ,者湘漪 ,吴文礼 ,许静 ,徐航 ,辛皖潮 ,张斌 ,辛慧珍,曹冬冬,潘泽民*
(1新疆兵团第四师医院,新疆 伊犁 835000;2新疆地方与民族高发病教育部重点实验室/石河子大学医学院生物化学教研室,新疆 石河子 832002;3新疆伊犁哈萨克自治州友谊医院,新疆 伊犁 835000)
子宫颈癌是全球女性常见恶性肿瘤,也是导致癌症死亡的主要原因,据统计在2012年全球有527624例新发病例和265653例死亡病例[1]。宫颈癌的发生和发展与诸多因素相关,德国科学家最先发现人乳头瘤病毒(HPV)可导致宫颈癌发生。在已经被检测出的HPV型别中有20余种被划分为高危型HPV,其中HPV16与宫颈癌的发生关系最密切,可引起约70%的宫颈癌。HPV16基因组的E6和E7为最重要的细胞周期调节因子[2],在组织培养系统中,E6和E7的表达可以导致人类角化细胞的永生化[3]。HPV16致癌主要与癌基因E6和E7的活性相关,这些癌基因能与部分细胞蛋白相结合,从而干扰正常细胞的凋亡、分化、粘附、细胞周期和免疫应答,促进宫颈发生癌变[4-5]。有研究表明,E6基因多个位点突变影响HPV16病毒的抗原性,免疫原性以及易感性[6-7]。T350G是欧洲株中最常见的多态性突变,它引起亮氨酸到缬氨酸(L83V)的改变。本课题组前期分析43例新疆维吾尔族宫颈癌 HPV16病毒 E6和E7基因序列,发现E6基因有34例E6基因350位核苷酸发生突变(T350G),突变频率为79.1%[8]。为了进一步分析这种突变,本研究通过真核转染实验研究此突变位点在宫颈癌发展中的作用,有助于人们充分认识HPV,为HPV导致宫颈癌的诊断和治疗提供新思路。
1 材料与方法
1.1 细胞与质粒来源
宫颈癌C33A细胞株由本实验室保存提供,HPV16 E6原型质粒购于美国Addgene公司。
1.2 质粒的构建
HPV16 E6原型和突变型均由上海吉凯基因公司设计合成,质粒名称为GV230,详细信息(表1)。
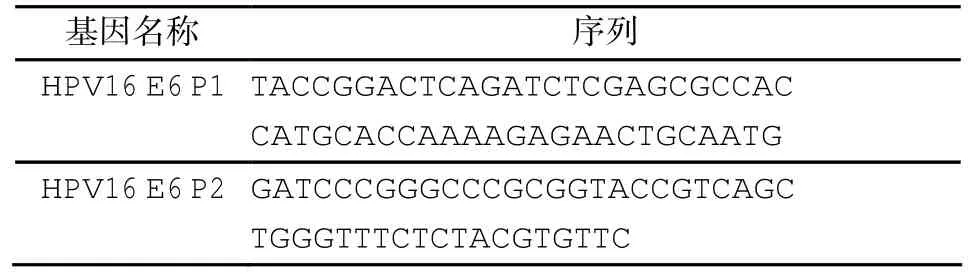
表1 HPV16 E6引物信息Tab.1 HPV16 E6 primer information
1.3 细胞的培养
C33A细胞采用10%FBS DMEM含青霉素-链霉素双抗细胞培养基,37℃,5%CO2培养箱常规培养。
1.4 C33A细胞的稳定转染
C33A细胞接种到6孔板中并分别转染HPV16 E6原型、HPV16 E6突变型和阴性对照质粒,使用FuGENE HD转染试剂(FuGENE HD瑞士罗氏公司),根据试剂说明书进行操作,转染48 h后筛选细胞,将细胞培养液换成含有G418(浓度为500 g/mL)的10%FBS DMEM细胞培养基,每3 d换液一次,14 d后形成稳定表达的单克隆细胞株。
1.5 间接免疫荧光实验
分别将C33A稳转细胞接种到放有盖玻片的六孔板中,每孔接种密度为 1.0×105/mL,37℃,5%CO2培养箱中培养12 h;4%多聚甲醛,在4℃冰箱中固定 30 min;0.25% TritonX-100透化 2-5 min;加入1 mL10%山羊血清室温下封闭30 min;加一抗(SANTA公司 HPV16 E6抗体,5%山羊血清 1∶50稀释),37 ℃,湿盒中孵育 2 h;将 150 μL荧光二抗 (北京中杉金桥公司罗丹明标记抗体,5%山羊血清1∶100稀释)加在玻片上,放入湿盒中,37℃,避光孵育2 h。在荧光显微镜下观察,拍照记录。
1.6 CCK8细胞增殖实验
将筛选好的稳定转染细胞接种于96孔板,每孔加入 100 μL 10%FBS DMEM培养基,每孔接种3000个细胞,每个组设置4个复孔。5%CO2、37℃培养箱过夜至第二天待细胞贴壁设为0 h点,CCK8试剂(日本同仁公司)平衡至室温,分别到 0、24、48、72 h 4个检测时间点每孔加入CCK8试剂10 μL,轻轻敲打孔板使试剂与培养液充分混匀,并置于5%CO2、37℃培养箱中孵育3 h,到时间后将其用锡箔纸避光包好,酶标仪(ELx808,Bio-Rad公司,美国)上测定选择450 nm处吸光度值(optical density,OD)。
1.7 细胞平板克隆实验
分别将C33A稳转细胞接种到六孔板中,每孔接种1000个细胞,继续培养14 d后用4%多聚甲醛2 mL固定细胞,加入0.4%结晶紫染色,显微镜下计数克隆大于50个细胞的克隆数。
1.8 细胞凋亡实验
细胞凋亡实验使用凋亡试剂盒(联科生物,杭州)通过流式细胞仪(BD FACSAria III,BD公司,美国)进行检测,Annexin V-APC和 7-AAD染色 C33A细胞,根据说明书操作。
1.9 统计学分析
所有统计数据均采用SPSS17.0软件进行分析。计量资料用均数±标准差表示,服从正态分布且方差齐的多组比较采用方差分析,对不符合条件的使用多个独立样本的秩和检验,<0.05为差异有统计学意义。
2 结果
2.1 成功构建HPV16 E6原型(T295/T350)和HPV16 E6-G350突变(T295/G350)质粒,且测序正确
成功构建 HPV16E6原型 (T295/T350)和HPV16E6-350突变(T295/G350)质粒且测序正确如图1所示。

图1 HPV16 E6基因真核表达质粒测序图Fig.1 Sequencing map of eukaryotic expression vector of HPV16 E6 gene
2.2 HPV16 E6在宫颈癌C33A细胞中的表达
在宫颈癌C33A细胞中,分别转染GV230空质粒,HPV16E6原型 (T295/T350) 质粒和 HPV16 E6-G350突变(T295/G350)质粒,转染 48 h后利用显微镜观察间接免疫荧光法检测HPV16 E6的表达。如图所示使用HPV16 E6抗体检测各组HPV16 E6蛋白的表达,GV230空质粒组作为对照组没有红色荧光,表明C33A细胞无HPV16 E6蛋白表达;其他两个转染实验组均有红色荧光,显示HPV16 E6蛋白有表达,其中HPV16 E6原型组红色荧光较少,提示HPV16 E6蛋白表达量最少,HPV16 E6-G350突变组红色荧光最多,提示HPV16 E6蛋白表达量最多如图所示(图 2)。
实验结果提示,HPV16 E6-G350突变可增强HPV16 E6蛋白的表达。

图2 间接免疫荧光法检测C33A细胞HPV16 E6蛋白表达情况(200×)Fig.2 The expression of HPV16 E6 in C33A cells by indirect immunofluorescence(200×)
2.3 HPV16 E6突变对C33A细胞增殖的影响
在C33A 细胞中分别转染GV230空质粒,HPV16 E6原型(T295/T350)质粒HPV16 E6-G350突变(T295/G350)质粒,用 CCK8法检测各组在各时间点的OD值,判断C33A细胞的增殖。NC空质粒组作为对照组,HPV16E6原型质粒组和HPV16 E6-G350突变质粒组作为实验组。如图所示,在72 h时间点HPV16 E6原型组与NC组OD值有差异( <0.05);在 24 h和 48 h时间点 HPV16 E6-G350突变组与 NC组OD值均有差异( <0.05),72 h时间点HPV16 E6-G350突变组与NC组OD值均有差异( <0.01),实验重复 3遍,如图所示(图 3)。
实验结果提示,HPV16 E6表达的实验组细胞增殖能力高于对照组,HPV16 E6-G350突变增殖能力比HPV16 E6原型强。

图3 HPV16 E6突变对C33A细胞增殖的影响Fig.3 The effect of HPV16 E6 mutation on the proliferation of C33A cells
2.4 HPV16 E6突变对C33A细胞克隆形成的影响
将稳定转染 GV230空质粒、HPV16E6原型(T295/T350)质粒和 HPV16E6-G350突变(T295/G350)质粒的C33A细胞接种在6孔板中,密度为1000个细胞/孔,培养箱中培养14 d。
显微镜下计数具有50个细胞以上的细胞集落。实验重复3遍,如图所示(图4)。
该实验结果提示与CCK8增殖实验结果一致,两个实验组细胞克隆集落数明显多于NC对照组,HPV16 E6-G350突变C33A细胞克隆数最多。NC组与各HPV16 E6表达组相比存在差异且差异均具有统计学意义(<0.01)。

图4 HPV16 E6突变对C33A细胞克隆形成的影响Fig.4 Effect of HPV16 E6 mutation on the formation of C33A cell clones
2.5 HPV16 E6突变对C33A细胞凋亡的影响
利用流式细胞术进行细胞凋亡分析,检测各组细胞的凋亡率,凋亡率包括Q2和Q4象限总和值,在宫颈癌C33A细胞中,GV230空质粒NC组细胞凋亡率明显高于 HPV16 E6原型质粒组 (<0.05)和HPV16 E6-G350突变质粒组(<0.01)。HPV16 E6原型组与HPV16 E6-G350突变组凋亡率之间存在差异,但差异无统计学意义(>0.05),如图所示(图5)。
这一结果提示HPV16 E6抑制宫颈癌C33A细胞的凋亡,HPV16 E6-G350突变的抑制凋亡作用比HPV16 E6原型强。

图5 HPV16 E6突变对C33A细胞凋亡的影响Fig.5 The effect of HPV16 E6 mutation on the apoptosis of C33A cells
3 讨论
HPV是导致宫颈癌的主要因素之一,其中HPV16是高危型HPV中致癌性最强的基因型。流行病学研究证实,不同的HPV16变异株可表现出不同的致癌潜能和生物学活性,同时也具有一定的地域性,这种地域之间的差异与宿主的人类白细胞抗原(HLA)多态性相关[9-10]。HPV16谱系具有地理区域集中分布现象,以及民族间的差别。中国汉族女性中HPV16亚型的分布主要为欧洲株和亚洲株。在摩洛哥妇女HPV16 E6 T295/G350突变普遍存在于高度宫颈损伤中,并且与宫颈癌的进展关系密切。不同的HPV16亚型具有不同的致癌潜能,可能与某些重要序列位点突变有关[11-14]。一些实验研究表明HPV16 E6基因突变体的自然变异性足以改变由E6诱导的细胞功能活性,例如对血清/钙分化的抗性,原代人角质细胞寿命的延长和人永生化细胞中p53和Bax表达水平的减少,人角质细胞的凋亡、转化和永生化,但是,负责这些改变的以及基因参与其调节的机制尚未明确[15-16]。每一种突变都有特定的基因表达,这些基因大多参与粘附、增殖、凋亡、迁移和侵袭。
我们通过一系列细胞学实验来分析HPV16 E6致癌蛋白基因不同突变体的作用,选取HPV阴性的宫颈癌C33A细胞进行转染,比较HPV16E6 T295/T350欧洲原型和HPV16 E6 T295/G350欧洲突变型。选择此细胞模型是由于C33A为一个具有pRB和p53基因突变的宫颈癌细胞,它不具有高危型HPV癌蛋白E6的致癌作用[17]。我们的研究结果显示,HPV16 E6 T295/T350欧洲原型和HPV16 E6 T295/G350欧洲突变型两者均可促进宫颈癌细胞的增殖,抑制凋亡;HPV16 E6 T295/G350欧洲突变型的促癌作用更强。我们的结果可能可以部分解释这种突变的致癌潜能,为HPV导致宫颈癌的诊断和治疗提供新靶标。
4 结论
HPV16E6 T295/T350欧洲原型和HPV16 E6 T295/G350欧洲突变型均可以促进宫颈癌细胞的增殖,抑制凋亡,HPV16 E6 T295/G350欧洲突变型的促癌作用比HPV16 E6 T295/T350欧洲原型强。

