心肌梗死中lncRNAs、mRNAs基因表达谱分析
李珊珊,王悦竹,宋一帆,白雪峰
(哈尔滨医科大学大庆校区医学信息学院,黑龙江 大庆 163319)
0 引言
心血管病患病率及死亡率仍将不断上升,而其中尤其严重的是急性心肌梗塞。临床上急性心肌梗死发病率高,预后多不良,已经引起医学界的高度关注。急性心肌梗塞(acute myocardial infarction,AMI)是全球范围内指致死和致残的主要疾病之一。
国内外对心肌梗死的生物学标志进行了大量而广泛的研究。研究发现lncRNA在心肌梗死中更为灵活的调控多个mRNA在通路中的异常表达。
研究证实,有些lncRNA通过靶向作用于其他基因参与调控病理性心肌细胞凋亡[1],有些lncRNA在梗死组织中被发现通过抑制其表达可以减弱心肌梗死[2-3]。还有些在外周血中被发现这些lncRNA可能在AMI的发展中具有潜在作用[4-5]。lncRNA还可作为 ceRNA参与调控细胞死亡,Wang等[6]发现了一种lncRNA APF(autophagy promoting factor)可以调节细胞自噬。人体发生急性心肌梗塞后体内的mRNAs和lncRNAs表达异常,通过转录后水平参与MI及其并发症的病理生理过程,有望成为急性心肌梗死新的生化标志物和治疗靶点。
本文根据mRNA与lncRNA的概述以及近年来心肌梗塞与mRNA和lncRNA的相关研究进程来讨论mRNA-lncRNA相互作用的调控机制对心肌梗死发生与发展过程的影响,为研究者在mRNAs、lncRNAs和AMI诊断方面的研究提供帮助。
1 lncRNA与心肌梗塞
1.1 数据准备
我们从NCBI上下载平台数据(GPL96)、基因芯片数据(GSE974)和GENECODE数据库中下载人类的基因序列,利用计算机软件建库比对,对lncRNA与mRNA进行分离。芯片数据包括38个病人样本(16 normal/22 MI),对平台数据进行探针重注释得出11083个mRNA和382个lncRNA。通过SAM算法选取差异基因,通过R语言进行数据处理选取的差异的mRNA和lncRNA(foldchange>2),得到了9937个差异mRNA和86个差异lncRNA。这些差异表达的mRNA和lncRNA作为心肌梗死的潜在致病因素。利用R语言构出mRNA与lncRNA互做网络(pearson>0.8)用Cytoscape插件对网络进行功能模块挖掘,获得5个功能显著性模块,最后通过David进行基因的功能注释,结果见图1。
1.2 表达谱网络分析
得到mRNA-lncRNA互作网络,结点数1309个,其中包含1276个mRNA和33个lncRNA,1680条边。网络图中的点代表基因,边表示两个基因间的联系,其中度越大的基因表示与其连接的基因越多,表明在网络中可能起着重要作用。另外,还存在一些虽然度小但在网络图中起桥梁作用的结点。这些节点可能作为MI中的潜在的致病基因。
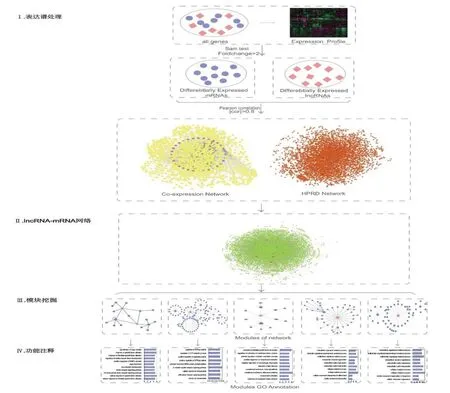
图1 数据分析流程图
1.3 网络模块挖掘
对HPRD网络与共表达网络进行整合构建更为全面的lncRNA-mRNA互作网络,其中包括33个lncRNA,4522个mRNA,9134条边。利用Cytoscape中的JActivemodule和Netmine插件进行模块挖掘。获得5个功能性显著模块(module1-module5)。
1.4 Gene ontology(GO)分析
通过David在线平台进行对模块中重要基因进行功能注释,筛选出具有诊断意义的基因。分析后的结果发现lncRNA在心肌梗死发病机制中扮演多重角色。
2 结果
2.1 差异表达lncRNAs、mRNAs
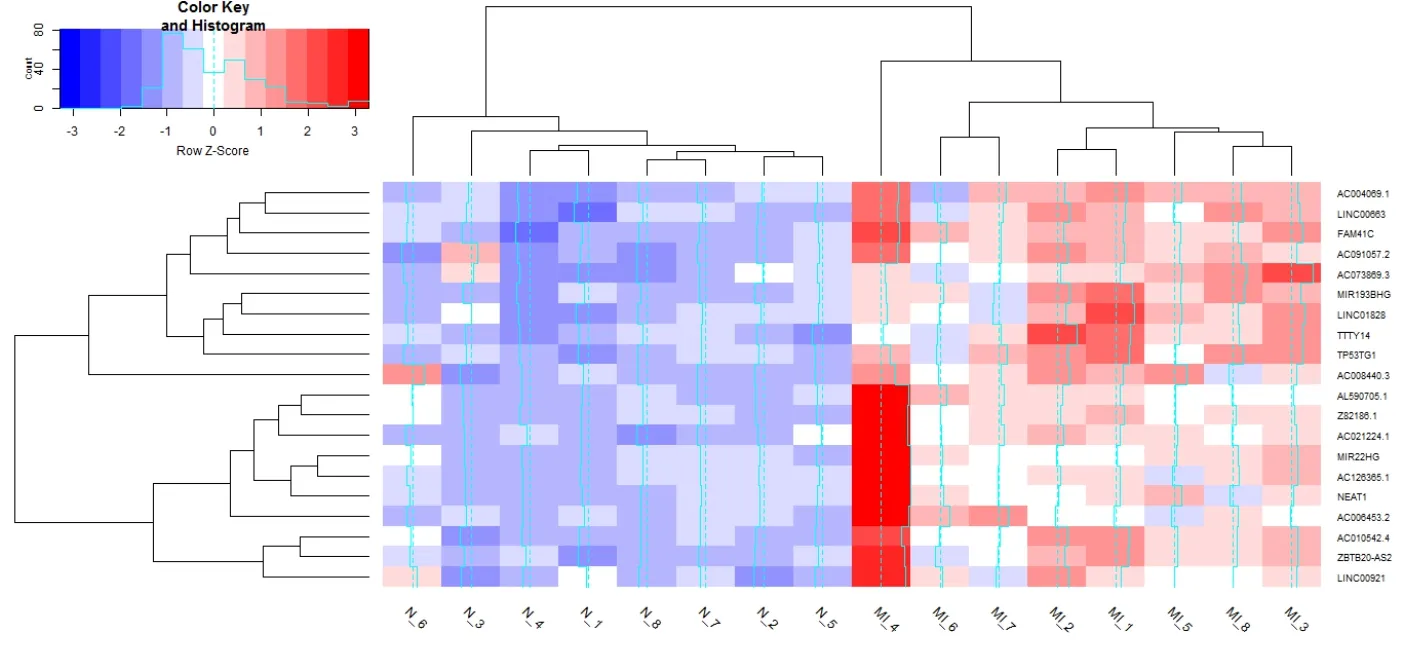
图2 lncRNA 表达谱热图
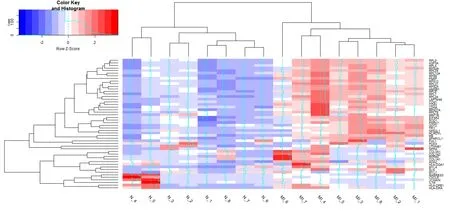
图3 mRNA 表达谱热图
对MI表达谱数据进行处理,得到的差异lncRNA与mRNA数量分别为86/9937个 。我们根据foldchange值进行排序,提取了差异mRNA前0.5%的表达谱与差异lncRNA前5%的表达谱绘制热图,结果见图2、3。树状图表示对来自不同样本的不同基因的聚类分析结果,从整体上来看疾病组与对照组在基因表达上有显著差异。
2.2 miRNAs-mRNAs网络模块
对建立的疾病网络已经证明显现幂律分布[7],从网络分析来看,网络中结点度越大的点,表明可能会影响更多的邻居结点,因此,这些点被考虑扮演hubs结点的角色。图4显示lncRNAs-mRNAs网络结点的度分布是幂律分布。通过模块挖掘来研究lncRNAs、mRNAs在癌症当中的共调控方式、以及基于局部策略来分析miRNAs的在心肌梗塞中的功能。
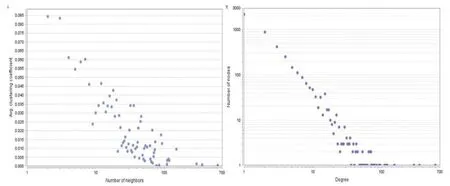
图4 网络度分布
根据得到的5个功能模块当中,大部分 lncRNAs具 有 较 大 的 度, 如:LINC00483、AL031598、AC009283、AC126365、H19、AP000654等,结果见表1。在各个模块中有些结点的度较大,AP000654在模块四、五的度数为:18、20。模块一中度较大的节点GNAQ,它的度数为17,同时该基因已被研究证实参与调节多种细胞活动,包括细胞增殖、分化和凋亡,并在损伤和动脉粥样硬化的血管中参与反应。研究表明有多个基因能够促进动脉粥样硬化,例如:lncRNA H19通过调节MAPK和NF-kB信号通路来促进动脉粥样硬化的形成[8]。动脉粥样硬化可能会导致人体发生心肌梗死。模块二中度较大的节点IGF2R可能在调节心肌细胞生长和凋亡中发挥重要作用[9]。模块四中的MMP1,MMP2,MMP7,MMP9,MMP12和MMP13 也被文献证实在心肌梗死发病机制中起到重要作用[10]。
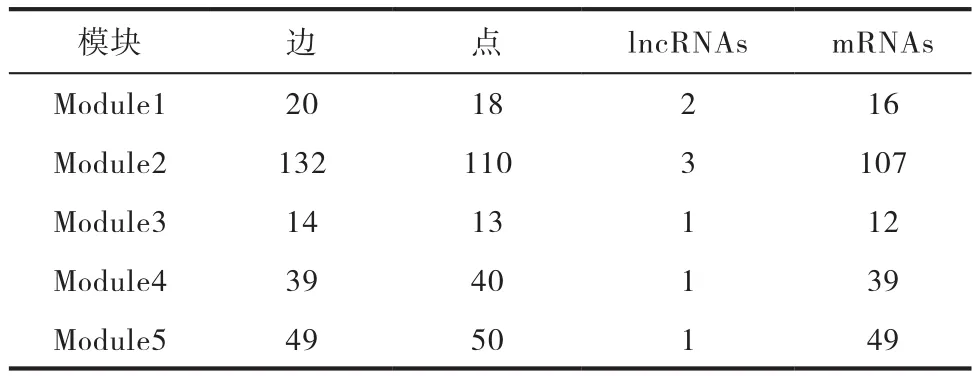
表1 各模块中边、点数量和所含lncRNAs,mRNAs数量
在五个模块中,对模块进一步分析,通过clusterone插件对模块进行挖掘,通过挖掘每个模块中重要节点用红色标出,结果见图5。这表明除了度大的点起到了HUB结点的作用,在网络中还有一些结点度虽然小,在局部联系较为紧密,成为一个团队发挥着作用,这些合作的结点可能在疾病发生过程中起到作用。在模块二中TGFA、MAGI2、ADAM17聚在一个集合中,其中已被研究证实的增强ADAM17表达与大鼠急性心肌梗死后心肌重塑相关[11]。模块四中ZC3H12A是位于人类一号染色体上的基因,已有文献证实该基因与AHSP、HBA2存在互作关系。基因ZC3H12A别名为MCPIP,近期研究发现MCPIP在缺血心肌组织中的表达可以通过调节局部心肌炎症来保护MI后的心脏重塑[12]。
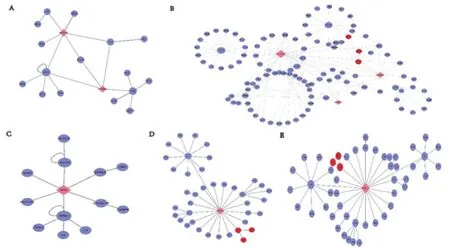
图5 lncRNAs-mRNAs功能显著性模块
2.3 模块功能分析
根据得到的五个模块的功能注释结果,我们发现多个模块中的多个基因都被注释到血管内皮生长因子的生产调节、炎症反应、细胞凋亡,结果见图6。其中模块三中的C3和C5被注释到与血管内皮生长因子的生产调节与炎症反应。模块一中的基因还被注释到多对相反功能上,如:regulation of apoptotic process in bone marrow和negative regulation of vascular endothelial growth factor signaling pathway,regulation of vascular endothelial growth factor signaling pathway和negative regulation of vascular endothelial growth factor signaling pathway。这表明其实组织中本身就存在平衡调控机制,若这些机制失衡也会导致疾病发生。
3 结语
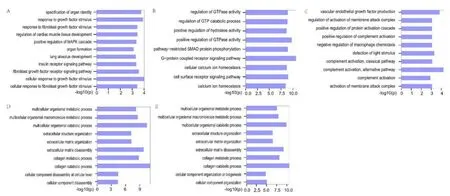
图6 模块功能注释
为了探究心肌梗死中lncRNA与mRNA的调控机制,我们通过对心肌梗死芯片数据进行分析,得到lncRNA-mRNA网络,并且对网络进行模块挖掘获得五个显著性模块,对模块进行分析LINC00483、AL031598、AC009283、AC126365、H19、AP000654在网络中起到了HUB节点的作用,在网络中还有一些结点度虽然小,但在局部联系较为紧密,成为一个团队发挥着重要作用, 如:TGFA、MAGI2、ADAM17。其中regulation of apoptotic process in bone marrow和negative regulation of vascular endothelial growth factor signaling pathway出现在多个模块功能注释中。通过本文的研究,发现lncRNA与mRNA协同作用,为研究者在lncRNAs、mRNAs和MI诊断方面的研究提供帮助。
[1] Wang K, Liu F, Liu C Y, et al. The long noncoding RNA NRF regulates programmed necrosis and myocardial injury during ischemia and reperfusion by targeting miR-873[J]. Cell Death &Differentiation, 2016, 23(8): 1394-1405.
[2] Li X, Zhou J, Huang K. Inhibition of the lncRNA Mirt1 Attenuates Acute Myocardial Infarction by Suppressing NF-κB Activation[J].Cellular Physiology and Biochemistry, 2017, 42(3): 1153-1164.
[3] Wu T, Wu H, Xu Z, et al. Abnormal expression of long non-coding RNAs in myocardial infarction[J]. Heart and Vessels, 2017: 1-9.
[4] Zhai H, Li X M, Liu F, et al. Expression pattern of genome-scale long noncoding RNA following acute myocardial infarction in Chinese Uyghur patients[J]. Oncotarget, 2017, 8(19): 31449.
[5] Vausort M, Wagner D R, Devaux Y. Long Noncoding RNAs in Patients With Acute Myocardial Infarction Novelty and Significance[J]. Circulation research, 2014, 115(7): 668-677.
[6] Wang K, Liu C Y, Zhou L Y, et al. APF lncRNA regulates autophagy and myocardial infarction by targeting miR-188-3p[J]. Nature communications, 2015, 6: ncomms7779.
[7] Hu G, Agarwal P. Human disease-drug network based on genomic expression profiles[J]. PloS one, 2009, 4(8):e6536.
[8] Pan J X. LncRNA H19 promotes atherosclerosis by regulating MAPK and NF-kB signaling pathway[J]. European Review for Medical and Pharmacological Sciences, 2017, 21: 322-328.
[9] Chen Z, Ge Y, Kang J X. Down-regulation of the M6P/IGFII receptor increases cell proliferation and reduces apoptosis in neonatal rat cardiac myocytes[J]. BMC cell biology, 2004, 5(1):15.
[10] Ye S. Influence of matrix metalloproteinase genotype on cardiovascular disease susceptibility and outcome[J].Cardiovascular research, 2006, 69(3): 636-645.
[11] Zheng D Y, Zhao J, Yang J M, et al. Enhanced ADAM17 expression is associated with cardiac remodeling in rats with acute myocardial infarction[J]. Life sciences, 2016, 151: 61-69.
[12] Niu J, Jin Z, Kim H, et al. MCP-1-induced protein attenuates post-infarct cardiac remodeling and dysfunction through mitigating NF-κB activation and suppressing inflammation-associated microRNA expression[J]. Basic research in cardiology, 2015,110(3): 26.

