新乡市冬季PM 2.5组分分析及其对人Ⅱ型肺泡上皮细胞的炎性作用
刘影影,高 霞,李海斌,张光辉,吴 辉,张瑞芳,吴卫东
(新乡医学院公共卫生学院 河南省空气污染健康效应与干预国际联合实验室,河南 新乡 453003)
近年来,在冬季中国频发大面积的雾霾污染。颗粒物是我国一种重要的城市空气污染物,颗粒物的大小、形态和组成与健康密切相关。粒径大小不同的颗粒物,被吸入并沉积在呼吸系统的不同部位,对机体的危害也有差异。细颗粒物是指空气动力学直径≤2.5μm的颗粒物(PM2.5)。高浓度的PM2.5是雾霾的根本成因[1]。流行病学和实验研究表明,暴露PM2.5与心、肺及脑血管疾病存在关联[2]。当PM2.5年均浓度达到35μg·m-3时,人群的死亡风险比 10μg·m-3时约增加 15%[3-4]。但是,PM2.5与心肺疾病的关联机制尚不清楚。研究证明,炎性反应和氧化应激在颗粒污染物诱发毒性效应过程中发挥着重要作用[5]。尽管目前空气质量标准是根据颗粒物的动力学直径而制定的,但颗粒物大小并不是唯一的危害决定因素,在不同的观测地点与季节可以观察到颗粒物对人群健康的影响存在差异[6],这可能与环境中颗粒物复杂的化学成分(如金属、有机物等)、物理性质(如大小、表面积等)以及宿主特异性状(如已患疾病、基因的多态等)有关。颗粒污染物的排放源不同,其主要成分也随之而异。深入了解颗粒物的来源、成分及其与毒性的内在联系有助于有效控制污染源颗粒物的排放[7]。有研究报道,西安市 PM2.5的化学组分有机碳、元素碳、氨离子、硝酸根离子、氯元素、金属镍等与人群总死亡率、呼吸系统疾病病死率呈正相关[8]。因此,深入了解大气颗粒物化学组分对追踪颗粒物来源以及阐明其对人体健康的影响有重要意义。本实验以人Ⅱ型肺泡上皮细胞A549为体外细胞模型,检测新乡市冬季大气中PM2.5对A549细胞的损伤及炎性因子表达的诱导作用,为进一步阐明PM2.5诱导呼吸道炎症的机制及制定雾霾防护措施提供依据。
1 材料与方法
1.1 细胞来源人Ⅱ型肺泡上皮细胞株A549购自中国科学院细胞库。
1.2 主要试剂与仪器大流量采样器、石英采样膜(美国Tisch公司),超声振荡仪(宁波新芝生物科技股份有限公司),真空冷冻干燥机(德国CHRIST公司),CO2恒温培养箱(美国 Thermo Forma公司),倒置显微镜(厦门麦克奥迪医疗诊断系统有限公司),酶标仪(美国Perkin Elmer公司),超声波清洗机、针头过滤器(Millex FILTER 0.22μM)、离子色谱仪、电感耦合等离子体质谱仪(inductive coupled plasma emission spectrometer,ICP-MS)(美国 Thermo Fisher公司),Ethos微波消解仪器(意大利 Milesone公司),3-(4,5-二甲基噻唑-2)-2,5二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、2.5 g·L-1EDTA-胰蛋白酶、HNO3、淋洗液(3.5 mmol·L-1Na2CO3和1.0 mmol·L-1NaHCO3)(美国 Sigma公司),磷酸盐缓冲液(phosphate buffered solution,PBS)、白细胞介素(interleukin,IL)-1β酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、IL-8 ELISA试剂盒(武汉博士德生物工程有限公司),洛斯维·帕克纪念研究所-1640培养基(Roswell Park Memorial Institute-1640,RPMI-1640)、胎牛血清(美国Gibco公司)。
1.3 实验方法
1.3.1 空气中 PM 2.5采集采样地点位于新乡医学院院系楼7楼平台,距地面约20 m。采样时间为2016年1月份,采样时避开雨雪天气,采样时间为早晨 8:00至次日早晨 8:00(24 h),连续采样 24 h后更换新的采样膜。采样流量为40 NL·min-1,滤膜有效面积为193 mm×244 mm。采样前与采样后滤膜均置于干燥器中,室温下平衡24 h,使用万分之一电子天平快速称量。采样后将准确称量的滤膜放入锡箔纸,再放入密封袋中,置于 -20℃冰箱内保存备用。空白滤膜的处理方法与采样滤膜相同,在检测分析过程中作为空白对照使用。观测期间PM2.5的质量浓度值参照中国大气质量PM2.5浓度限值二级标准(24 h平均质量浓度不超过75μg·m-3)。
1.3.2 样品前处理及水溶性阴离子测定将采样滤膜和空白滤膜采用冷冻干燥法处理。将载有颗粒物的滤膜剪成1~2 cm宽的碎片,浸入15 mL双蒸水中,在超声振荡器上振荡3次,每次振荡5 min,所得混合液采用多层无菌纱布过滤,收集洗脱液,置于真空冷冻干燥机内冷冻干燥,取出收集干燥后的颗粒物,迅速置于-20℃冰箱内避光保存备用。样品使用前,用过滤的细胞培养液RPMI-1640加入浓缩颗粒物中,超声震荡混匀,制备成颗粒物悬液。另取收集好颗粒物的滤膜,浸泡到淋洗液中,用超声波发生器间隔处理,每次 5 min,共处理 4次,总计20 min。使用标准注射器经0.22μm水相针头过滤器滤去其中可能存在的不溶性大颗粒物质,防止堵塞离子色谱仪进样器,采用离子色谱仪检测其PM2.5中可溶性阴离子成分,每个样品平行测2次,取其平均值,得到新乡市PM2.5中可溶性阴离子F-、Ac-、Cl-、NO2-、Br-、NO3-、SO42-、HPO4-的质量浓度。
1.3.3 金属元素测定检测PM2.5中金属元素质量浓度的样本与检测PM2.5中阴离子质量浓度的样本相同,保证了实验样品的统一性。具体检测方法如下:每个消解罐中分别加入7.00 mL HNO3、1 mL H2O2和1.0 mg颗粒物,密封后置于微波消解仪器中进行消解。微波消解程序为:700 W加热3 min到180℃,1 000 W加热3 min到190℃,1 000W加热5 min到195℃,保持25 min,充分冷却后卸压,用超纯水稀释至8.00 mL。采用ICP-MS分析其中 Ca、Zn、Mg、Al、Cu、Mn、Se、Cr、Pb、Cd、Ni、As等元素的含量。
1.3.4 细胞培养及染毒将人Ⅱ型肺泡上皮细胞株A549置于细胞培养瓶中,采用含体积分数10%胎牛血清的RPMI-1640培养液于37℃含体积分数5%CO2的培养箱中过夜培养,细胞密度达约80%时加入1.5 mL 2.5 g·L-1胰蛋白酶消化,离心收集细胞。加入1 mL RPMI-1640培养液清洗细胞1次,再次离心后,使用RPMI-1640培养基重悬并进行细胞计数,将细胞浓度调整为5×107L-1,然后将细胞接种于96孔板用于细胞活性检测,接种于12孔板用于蛋白表达检测。
1.3.5 人Ⅱ型肺泡上皮细胞株A549细胞活性检测将人Ⅱ型肺泡上皮细胞株A549细胞悬液密度调整为5×107L-1,每孔100μL接种于96孔培养板中,继续培养24 h后,PBS清洗细胞2次,将细胞暴露于 0.0、12.5、25.0、50.0、100.0、200.0、400.0 mg·L-1的PM2.5悬液中,每个浓度每孔加入PM2.5悬液100μL,每个染毒剂量设6个复孔。在96孔板周边加入RPMI-1640培养基,置于37℃含体积分数5%CO2的培养箱中培养24 h。每孔加入5 g·L-1MTT 20μL,继续培养4 h,吸出培养液,加入150μL二甲基亚砜(dimethyl sulfoxide,DMSO),轻微振荡溶解结晶,自动酶标仪于490 nm处测定吸光度值,计算细胞生长抑制率,细胞生长抑制率=(1-染毒组吸光度/对照组吸光度)×100%。细胞生长抑制率越高,细胞活性越低。
1.3.6 人Ⅱ型肺泡上皮细胞株A549细胞培养液上清液中IL-8和IL-1β蛋白水平检测将人Ⅱ型肺泡上皮细胞株A549细胞悬液浓度调整为5×107L-1,每孔1 mL接种于12孔板中继续培养24 h后,PBS清洗细胞2次,将细胞暴露至25.0、50.0、100.0 mg·L-1的颗粒物悬液中,置于37℃含体积分数5%CO2的培养箱中培养24 h,收集上清液,置于1.5 mL离心管内,1 500 r·min-1离心 5 min,采用双抗体夹心ELISA法检测上清液中IL-8和IL-1β蛋白水平。
1.4 统计学处理应用Graphpad Prism 5软件进行数据处理与统计学分析,计量资料以均数±标准差(±s)表示,各组间比较采用方差分析,组间比较采用t检验;检验水准α=0.05。
2 结果
2.1 新乡市冬季大气中PM 2.5水平新乡市冬季大气中PM2.5水平见表1。采样期间,新乡市大气中PM2.5的质量浓度在11~244μg·m-3。1月份大气中PM2.5的24 h平均质量浓度超过中国大气质量PM2.5浓度限值二级标准的时间为18 d。

表1 新乡市2016年1月份大气中PM 2.5质量浓度Tab.1 M ass concentration of PM 2.5 in Xinxiang city in January 2016
2.2 新乡市PM 2.5中可溶性阴离子成分水平新乡市中可溶性阴离子 F-、Ac-、Cl-Br-、NO3-、SO42-、HPO4-的质量浓度分别为(0.426±0.031)、(2.348±0.337)、(4.693±0.479)、(0.088±0.010)、(0.052±0.004)、(24.350±1.832)、(18.563±1.761)、(0.086±0.013)μg·m-3,NO3-、SO42-为PM2.5的主要阴离子成分,NO3-/SO42-为1.311。
2.3 新乡市PM 2.5中金属元素水平结果见表2。PM2.5中不同金属元素质量浓度差别很大,Ca、Mg、Zn和Al质量浓度较高,其中Ca元素平均质量浓度 >1 000 ng·m-3,Ca/Al为 4.8。
表2 颗粒物中金属元素平均质量浓度Tab.2 Average mass concentration of metal elements in PM 2.5 (±s)
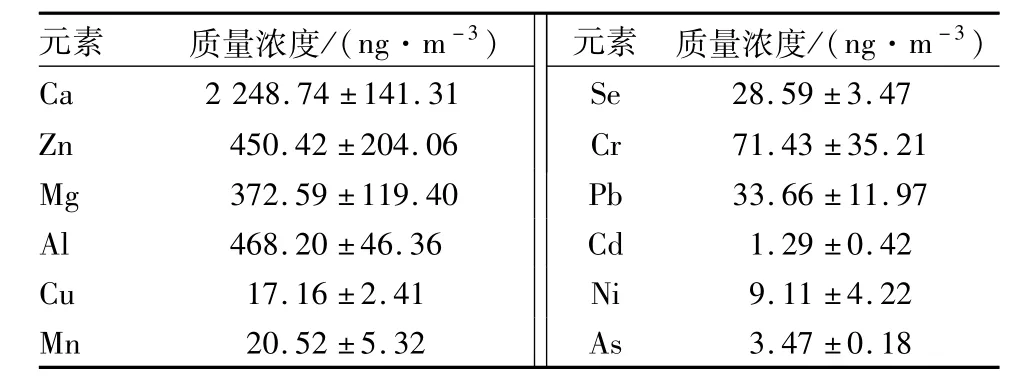
表2 颗粒物中金属元素平均质量浓度Tab.2 Average mass concentration of metal elements in PM 2.5 (±s)
元素 质量浓度/(ng·m-3)元素 质量浓度/(ng·m-3)Ca 2 248.74±141.31 Se 28.59±3.47 Zn 450.42±204.06 Cr 71.43±35.21 Mg 372.59±119.40 Pb 33.66±11.97 Al 468.20±46.36 Cd 1.29±0.42 Cu 17.16±2.41 Ni 9.11±4.22 Mn 20.52±5.32 As 3.47±0.18
2.4 PM 2.5对人Ⅱ型肺泡上皮细胞活性的影响结果见表 3。与 0.0 mg·L-1PM2.5组比较,12.5、25.0、50.0、100.0、200.0、400.0 mg·L-1PM2.5组人Ⅱ型肺泡上皮细胞株A549生长抑制率均显著升高,差异有统计学意义 (P<0.05);200.0、400.0 mg·L-1PM2.5组人Ⅱ型肺泡上皮细胞株A549生长抑制率均显著高于12.5、25.0、50.0、100.0 mg·L-1PM2.5组,差异有统计学意义(P<0.05);12.5、25.0、50.0、100.0 mg·L-1PM2.5组人Ⅱ型肺泡上皮细胞株A549生长抑制率两两比较差异均无统计学意义(P>0.05);200.0 mg·L-1PM2.5组与400.0 mg·L-1PM2.5组人Ⅱ型肺泡上皮细胞株A549生长抑制率比较差异无统计学意义(P>0.05)。
表3 不同浓度PM 2.5对人Ⅱ型肺泡上皮细胞株A549生长抑制率的比较Tab.3 Comparison of inhibition ratio of PM 2.5 w ith different concentration on A549 of human typeⅡalveolar epithelial cell (n=6,±s)
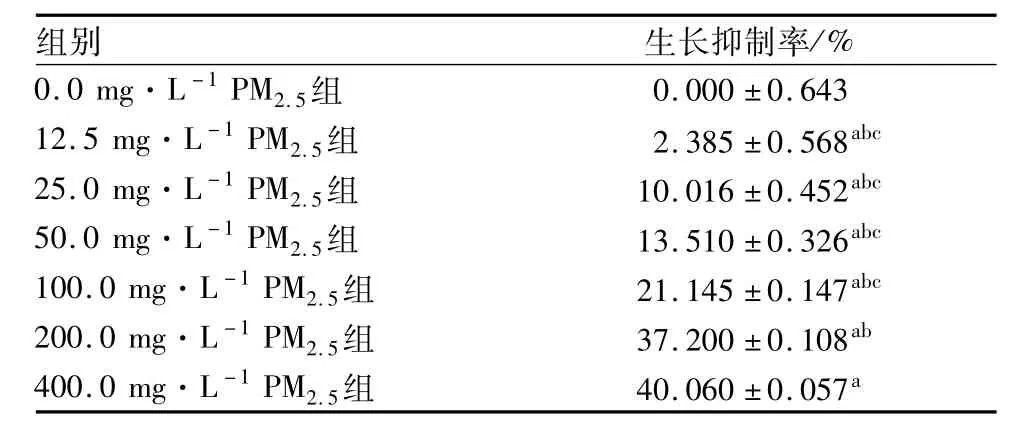
表3 不同浓度PM 2.5对人Ⅱ型肺泡上皮细胞株A549生长抑制率的比较Tab.3 Comparison of inhibition ratio of PM 2.5 w ith different concentration on A549 of human typeⅡalveolar epithelial cell (n=6,±s)
注:与 0.0 mg·L-1 PM2.5组比较a P<0.05;与 400 mg·L-1 PM2.5组比较b P<0.05;与200 mg·L-1 PM2.5组比较c P<0.05。
组别 生长抑制率/%0.0 mg·L-1 PM2.5组0.000±0.643 12.5 mg·L-1 PM2.5组 2.385±0.568abc 25.0 mg·L-1 PM2.5组 10.016±0.452abc 50.0 mg·L-1 PM2.5组 13.510±0.326abc 100.0 mg·L-1 PM2.5组 21.145±0.147abc 200.0 mg·L-1 PM2.5组 37.200±0.108ab 400.0 mg·L-1 PM2.5组 40.060±0.057a
2.5 不同浓度 PM 2.5对人Ⅱ型肺泡上皮细胞株A549培养液上清液中IL-1β和IL-8蛋白表达的影响结果见表4。与0.0 mg·L-1PM2.5组比较,25.0、50.0、100.0 mg·L-1PM2.5组人Ⅱ型肺泡上皮细胞培养液上清液中IL-1β和IL-8蛋白表达均显著升高,差异有统计学意义(P<0.05)。25.0、50.0、100.0 mg·L-1PM2.5组人Ⅱ型肺泡上皮细胞培养液上清液中IL-1β和IL-8蛋白表达两两比较差异均无统计学意义(P>0.05)。
表4 不同PM 2.5浓度对人Ⅱ型肺泡上皮细胞株A549培养液上清液中IL-1β和IL-8蛋白表达的影响Tab.4 Effect of PM 2.5 on expression of IL-1βand IL-8 protein in A549 of human typeⅡalveolar epithelial cell culture supernatants (n=6,±s)

表4 不同PM 2.5浓度对人Ⅱ型肺泡上皮细胞株A549培养液上清液中IL-1β和IL-8蛋白表达的影响Tab.4 Effect of PM 2.5 on expression of IL-1βand IL-8 protein in A549 of human typeⅡalveolar epithelial cell culture supernatants (n=6,±s)
注:与0.0 mg·L-1 PM2.5组比较a P<0.05。
组别 IL-1β/(ng·L-1) IL-8/(ng·L-1)0.0 mg·L-1 PM2.5组0.821±1.231 51.36±12.27 25.0 mg·L-1 PM2.5组 3.415±0.570a 738.40±99.76a 50.0 mg·L-1 PM2.5组 3.984±1.109a 858.60±37.66a 100.0 mg·L-1 PM2.5组 6.089±1.471a 969.20±51.12a F 3.69 66.10 P <0.05 <0.05
3 讨论
本研究结果显示,新乡市冬季大气中PM2.5质量浓度在整个采样期间均处于PM2.5污染较严重水平。从可溶性阴离子成分测定结果分析,新乡市大气气溶胶的水溶性成分主要是NO3-和SO42-。一般认为,NO3-是机动车尾气排放的二次转化产物。而SO42-则可能是燃煤排放到大气中的SO2被氧化形成SO3,后者进而与大气中的水形成硫酸,最后形成SO42-,导致大气中 SO42-含量升高。采样期间PM2.5中SO42-的质量浓度为(18.563±1.761)μg·m-3,提示所收集的污染物中煤烟型硫氧化物较多。大气颗粒物中NO3-与SO42-的质量比(NO3-/SO42-)可以用来比较固定源(如燃煤)和移动源(如汽车尾气)对大气中硫和氮的贡献量。如果大气颗粒物中NO3-/SO42-较高,说明机动车对大气中 PM2.5的贡献要大于固定源;反之,若NO3-/SO42-较低,则说明SO2和NOx主要来自于煤的燃烧。具体而言,我国大部分地区燃煤排放的NOx是大气中NOx的主要来源,NO3-/SO42-一般为0.3~0.5。新乡市冬季雾霾组分含有大量NOx,而且NO3-/SO42-为1.311,比值较高,说明移动源(如汽车尾气)对大气中氮的贡献量较大。
本研究还发现,新乡市冬季PM2.5中不同金属元素的质量浓度差别很大,其中 Ca、Mg、Zn、Al质量浓度较高。Ca是建筑扬尘的标志性元素,Al是地壳源的代表性元素,Ca/Al可以识别建筑尘和土壤扬尘在气溶胶中的贡献[9]。河南省土壤背景的Ca/Al约为0.38,而新乡市冬季 PM2.5中 Ca/Al达4.8,这表明新乡市的建筑活动非常活跃,建筑扬尘在PM2.5中的贡献率非常大。一般认为,交通尾气及扬尘污染源以其释放的 Pb、Cu、Zn元素组合为特征[10]。本研究发现,大气中Pb、Cu、Zn 3种元素的质量浓度均处于较高水平,说明交通尾气及扬尘污染源可能是所收集空气污染物的重要元素来源,此与阴离子分析的结果相一致。
IL-8为肺上皮细胞分泌的一种趋化因子,可募集炎性细胞进入肺组织。研究表明,IL-8水平与肺损伤的严重程度有关[11-12],IL-8过表达是慢性肺炎症性疾病的病理生理改变指标[13-14]。炎症机制由趋化因子调节,它通过与跨膜受体的相互作用控制各种类型的白细胞运输。IL-8在炎症过程中的主要作用是趋化靶细胞(特别是中性粒细胞)到炎症部位[15-16]。IL-1β是一种重要的炎症介质[17-18],能够促使细胞间细胞黏附分子1的释放,并能促进呼吸道内嗜酸性粒细胞激活,促使其释放炎性介质,在气道变应性炎症发生中发挥重要作用[19]。
暴露PM2.5对人Ⅱ型肺泡上皮细胞A549的生长抑制率随着PM2.5浓度加大而增高,表明高浓度的PM2.5具有较强的细胞毒性。本研究结果表明,暴露PM2.5可明显增加人Ⅱ型肺泡上皮细胞内炎性因子IL-1β和IL-8蛋白的表达,表现为随着PM2.5染毒剂量的增加,IL-1β和IL-8蛋白表达水平随之升高。IL-1β和IL-8在炎症发生过程中发挥重要作用,在体外研究中常作为细胞炎性反应的重要生物标志物。PM2.5暴露能明显增加肺泡上皮细胞炎性因子IL-1β和IL-8蛋白的表达水平,这提示吸入高浓度的PM2.5可诱导呼吸道炎症,也可能加重呼吸道炎性疾病(如慢性阻塞型肺疾病、哮喘及肺炎)患者的炎性症状。新乡市冬季PM2.5中的可溶性阴离子及金属阳离子在PM2.5所致上述细胞损伤以及炎性效应中的贡献目前尚不清楚,有待进一步研究。
总之,新乡市冬季PM2.5中的可溶性阴离子主要是NO3-和SO42-,且 NO3-/SO42-值较高,提示移动源(如汽车尾气)对大气PM2.5污染贡献量较大;新乡市冬季 PM2.5中 Ca、Mg、Zn、Al质量浓度较高,说明交通尾气及扬尘可能是新乡市PM2.5的重要空气污染源;暴露PM2.5可引起人Ⅱ型肺泡上皮细胞损伤和细胞炎性反应。
[1]张小曳,孙俊英,王亚强,等.我国雾霾成因及其治理的思考[J].科学通报,2013,58(13):1178-1187.
[2]STAFOGGIA M,CESARONIG,PETERSA,etal.Long-term exposure to ambient air pollution and incidence of cerebrovascular events:results from 11 European cohorts within the ESCAPE project[J].Environ Health Perspect,2014,122(9):919-925.
[3]顾东风.雾霾、健康与疾病预防[J].中华预防医学杂志,2013,47(4):291-293.
[4]ZANOBETTIA,SCHWARTZ J.The effect of fine and coarse particulate air pollution on mortality:a national analysis[J].Environ Health Perspect,2009,117(6):898-903.
[5]DAVEL A P,LEMOSM,PASTRO LM,etal.Endothelial dysfunction in the pulmonary artery induced by concentrated fine particulatematter exposure is associated with local but not systemic inflammation[J].Toxicology,2012,295(1/2/3):39-46.
[6]GRAHAME T J,SCHLESINGER R B.Health effects of airborne particulatematter:do we know enough to consider regulating specific particle types or sources[J].Inhalation Toxicology,2007,19(6/7):457-481.
[7]LIN C H,NAIP L,YU C C,et al.Thrombin-induced CCAAT/enhancer-binding proteinβactivation and IL-8/CXCL8 expression via MEKK1,ERK,and p90 ribosomal S6 kinase1 in lung epithelial cells[J].J Immunol,2014,192(1):338-348.
[8]LIN C H,YU M C,CHIANG C C,et al.Thrombin-induced NF-κB activation and IL-8/CXCL8 release ismediated by c-Src-dependent Shc,Raf-1,and ERK pathways in lung epithelial cells[J].Cell Signal,2013,25(5):1166-1175.
[9]刘章现,王国贞,郭瑞,等.河南省平顶山市大气降尘的化学特征及其来源解析[J].环境化学,2011,30(4):825-830.
[10]刘春华,岑况.北京市街道灰尘的化学成分及其可能来源[J].环境科学学报,2007,27(7):1181-1188.
[11]MAZA P K,OLIVEIRA P,TOLEDO M S,et al.Paracoccidioides brasiliensis induces secretion of IL-6 and IL-8 by lung epithelial cells[J].Microbes Infect,2012,14(12):1077-1085.
[12]杜春艳,卢强,李玉品,等.大叶性肺炎患儿血清肿瘤坏死因子-α、白细胞介素-6、白细胞介素-8、白细胞介素-10和高迁移率族蛋白B1表达意义[J].中华实用儿科临床杂志,2014,29(16):1224-1226.
[13]BACON K,BAGGIOLINIM,BROXMEYER H,et al.Chemokine/chemokine receptor nomenclature[J].J Interferon Cytokine Res,2002,22(10):1067-1068.
[14]CAO J,XU H,XU Q,et al.Fine particulate matter constituents and cardiopulmonarymortality in a heavily polluted Chinese city[J].Environ Health Perspect,2012,120(3):373-378.
[15]JEDRZKIEWIEZ S,NAKANKRA H,SILVERMAN E S,et al.IL-1 beta induces eotaxin gene transcription in A549 air way epithelial cells through NF-kappa B[J].Am J Physiol Lung Cell Mol Physiol,2000,279(6):1058-1065.
[16]彭素芬,韩泉洪,李丽华,等.LED光源对人视网膜色素上皮细胞分泌单核细胞趋化因子-1和白细胞介素-8的影响[J].眼科新进展,2016,36(3):201-205.
[17]魏春,徐杰.腰椎间盘突出症患者外周血白细胞介素-1β、前列腺素E2及基质金属蛋白酶-3水平变化[J].新乡医学院学报,2017,34(1):76-78.
[18]韩梦雨,金明,王志军.炎性细胞因子与新生血管性眼病[J].眼科新进展,2017,37(11):1088-1092.
[19]JIN C,WANG F,TANG Y,et al.Distribution of graphene oxide and tio2-graphene oxide composite in A549 cells[J].Biol Trace Elem Res,2014,159(1/2/3):393-398.

