超声内镜在胃黏膜下肿瘤诊断中的局限性*
(天津医科大学总医院 消化内科,天津 300052)
胃黏膜下肿瘤(submucosal tumors,SMTs)指来源于胃黏膜上皮层以下组织的肿瘤,主要起源于黏膜肌层、黏膜下层和固有肌层。常规内镜检查发现病变很容易,但很难对其起源和病变性质进行诊断。目前,超声内镜(endoscopic ultrasonography,EUS)已经成为诊断胃SMTs的首选方法,其能清晰显示胃壁的层次结构、毗邻脏器和组织的情况,并根据其起源层次及回声特点,初步明确病变性质,鉴别病变来源[1],并为治疗方法的选择提供参考依据,但EUS不能作为最后的诊断方式,确诊病变需结合病理结果。因此,具有一定的局限性。胃SMTs主要通过内镜或外科手术切除治疗,术后病变组织经病理学联合免疫组化染色或基因检测而明确病理类型。本研究以近几年经EUS检查后行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)切除治疗的胃SMTs患者为研究对象,旨在评估EUS在胃SMTs诊断中的价值,并分析胃SMTs的EUS下特点。
1 资料与方法
1.1 一般资料
收集2008年9月-2016年12月在天津医科大学总医院内镜中心行EUS检查并经ESD术后病理及免疫组化确诊为胃SMTs的614例患者(合并654例肿瘤)的临床病理资料。其中,男195例(31.76%),女419例(68.24%),年龄18~80岁,平均(53.08±12.51)岁。
1.2 研究方法
本研究为回顾性研究。病变起源层次以内镜治疗术中诊断为金标准,病变类型以术后病理学及免疫组化结果为金标准,分别统计EUS诊断的符合率,并分析胃SMTs的EUS结果。计数资料以百分比表示;计量资料以均数正负标准差(±s)表示。
2 结果
2.1 胃SMTs的基本特征
共纳入胃SMTs患者614例,病变单发者579例(94.30%),多发者35例(5.70%),总计654例SMTs。病变位于胃底371例(56.72%),胃体97例(14.83%),底体交界19例(2.91%),胃窦167例(25.54%);病变平均直径(1.35±0.88)cm,直径小于2.0 cm者517例(79.05%),大于等于2.0 cm者为137例(20.95%)。在常规内镜下均表现为胃的隆起性病变,多与正常组织界限清晰,大部分与邻近黏膜颜色相同。
2.2 EUS诊断符合率
本研究中654例胃SMTs经ESD切除,病变起源层次以内镜治疗术中诊断为金标准,其中37例术中未详细描述病变的来源层次,EUS对617例病变起源层次的诊断与ESD术中结果的符合率为91.25%,其中起源于黏膜肌层、黏膜下层和固有肌层的诊断符合率分别为66.67%、80.85%和94.50%,见表1。胃SMTs中以胃肠间质瘤(gastrointestinal stromal tumor,GIST)、平滑肌瘤、异位胰腺和脂肪瘤相对较常见。病变类型以术后病理学及免疫组化结果为金标准,EUS对这4种病变类型的诊断与ESD术后病理结果的符合率为65.99%,其中胃GIST、平滑肌瘤、异位胰腺和脂肪瘤的诊断符合率分别为91.85%、18.56%、79.76%和90.70%,见表2。EUS对其余少见病变如错构瘤、炎性纤维性息肉、类癌、纤维瘤和神经鞘瘤等的诊断符合率为0.00%。
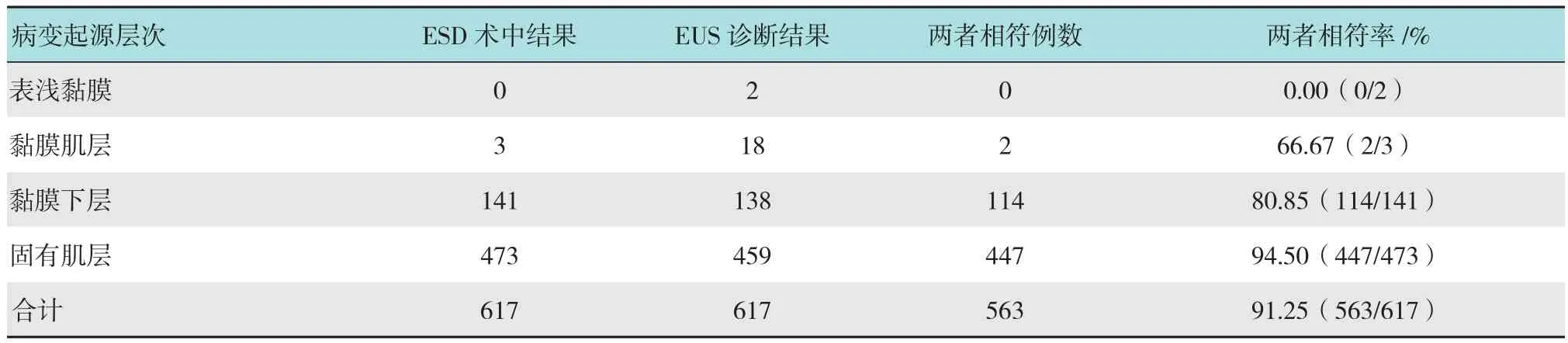
表1 不同起源胃SMTs的EUS诊断结果及ESD术中结果Table 1 EUS diagnoses and intraoperative results of ESD of gastric SMTs originating in different layers
2.3 胃SMTs的EUS下特点
EUS对654例SMTs术前做出了初步诊断,分别为GIST 426例、异位胰腺91例、平滑肌瘤64例、脂肪瘤45例、息肉10例、囊肿9例、类癌6例、纤维瘤2例和神经鞘瘤1例,与ESD术后病理结果有一定的差异。以病理学及免疫组化结果为金标准,EUS下不同病理类型的病变有不同的来源层次和回声强度。见表3。

表2 不同类型胃SMTs的EUS诊断结果及内镜手术后病理结果Table 2 EUS diagnoses and postoperative pathological results of gastric SMTs of different types
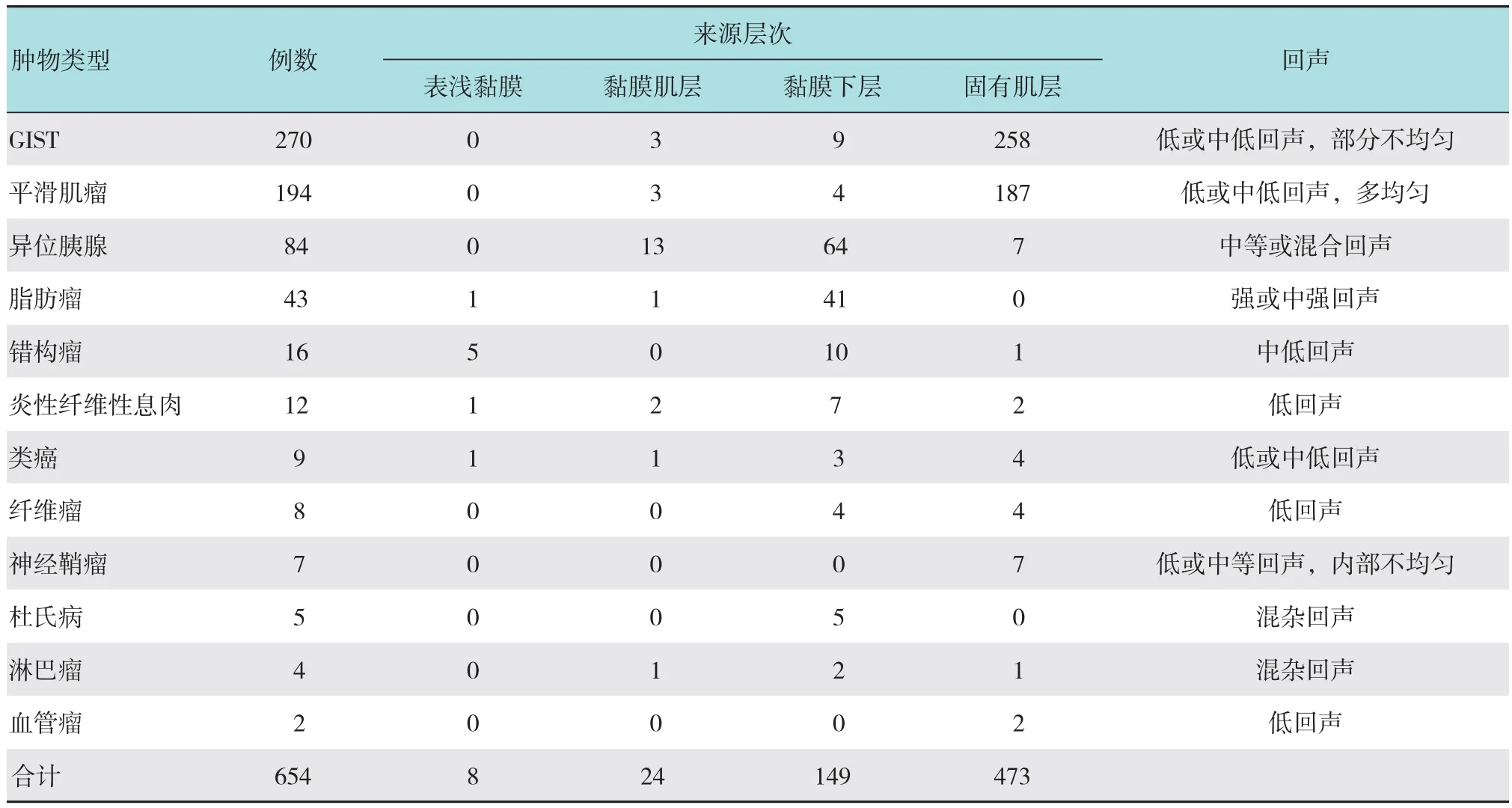
表3 不同病理类型胃SMTs的EUS下特点 例Table 3 Characteristics under EUS of gastric SMTs of different pathological types n
3 讨论
随着内镜检查的不断普及,胃黏膜下肿瘤的发现率越来越高。胃SMTs主要包括胃肠间质瘤、平滑肌瘤、异位胰腺、脂肪瘤、错构瘤和类癌等,多为良性肿瘤,少数为恶性肿瘤,部分良性肿瘤有恶变倾向。常规内镜可观察肿物的位置、大小、边界、表面是否光滑和是否伴有糜烂等情况,但不同类型的SMTs肉眼观察极为相似,无法判断其起源层次和病变性质[2]。EUS将内镜直视与超声扫描相结合,既能清晰显示胃壁的各层结构及邻近组织器官的结构,又能定位并显示病变与胃壁的关系,探查病变的起源、大小、回声、边界和生长方式等特点,从而对病灶进行定性诊断[3]。本研究中应用EUS诊断胃SMTs,对病变起源的诊断与ESD术中结果的符合率为91.25%,EUS检查显示病变多起源于固有肌层和黏膜下层,这与术中结果相一致,可见EUS对胃SMTs的起源具有较高的诊断价值。本研究发现部分瘤体EUS下显示的起源层次与实际切除时不相符,部分瘤体在EUS下显示位于黏膜肌层,而实际操作中发现位于黏膜下层,也有部分瘤体EUS下显示位于黏膜下层,而操作中发现位于固有肌层。这可能受多种因素的影响。其一,SMTs的起源层次和生长方式可能对其实际位置有较大影响,部分起源于黏膜下层的病变若以腔内生长为主要生长方式,则实际治疗时可能发现瘤体主要嵌于黏膜肌层;相反若以腔外生长为主要生长方式,则术中可能发现瘤体主要位于固有肌层。另外由于EUS仅显示病变的某一个截面,提示的起源层次可能与其他截面不相符合;其二,超声系统分辨率的限制以及各种超声伪像的干扰,使得EUS成像不稳定[4];其三,EUS医师及内镜手术医师的诊断水平存在差异,主观判断和不正确的操作方法都可能导致误诊[5]。
EUS对病变类型的诊断主要依据病变的起源层次、回声强弱及均匀度。本研究中,EUS对4种常见病变类型的诊断与ESD术后病理结果的符合率为65.99%。GIST是胃肠道最常见的间叶源性肿瘤,起源于胃肠道Cajal细胞[6],于胃中最多见(60.00%~70.00%)[7]。GIST有潜在恶性的生物学行为,较大的间质瘤应积极切除,但是对于小于2.0 cm的胃小间质瘤处置策略有争议[8-10]。GIST和平滑肌瘤在EUS下均表现为固有肌层或黏膜肌层的低回声病变,两者不易区分。但研究发现,GIST是最常见的胃SMTs,大部分位于胃底和胃体,表面可出现溃疡,多起源于固有肌层,若EUS下发现瘤体内部回声不均匀、局部强回声则提示GIST可能性大[5]。本研究中,EUS对GIST的诊断符合率较高,达到91.85%。平滑肌瘤在胃中亦较常见,主要位于胃底近贲门,大部分起源于固有肌层,多呈均匀低回声表现。但EUS对平滑肌瘤的诊断符合率很低,只有18.56%,大部分被误诊为GIST。异位胰腺是一种先天性畸形,可能与胚胎期胰腺组织的异常迁移有关,以胃窦多见[11],多起源于黏膜下层,典型者在EUS下呈特征性的脐样凹陷和管状结构样回声,内部回声不均匀,呈混合回声,边界不清。本研究EUS对其诊断符合率为79.76%。被误诊的异位胰腺EUS下多位于黏膜肌层和固有肌层,且并无明显的“管状结构”[12],不易与GIST相区别。脂肪瘤在EUS下表现为起源于黏膜下层的均匀强回声病变,属于良性病变,本研究中EUS对其诊断符合率为90.70%。错构瘤是间叶组织先天性发育障碍所形成的瘤样增生,非真性肿瘤,多分布于胃窦部,RYAN等[13]认为错构瘤是胚胎发育过程中胰腺异位所致。本研究中其EUS下多表现为黏膜下层的中低回声,往往被误认为异位胰腺。由于错构瘤有癌变风险,一经诊断最好行内镜下切除。炎性纤维性息肉由小的薄壁血管周围环绕具有长的胞浆突起的梭形细胞构成,伴有嗜酸性粒细胞浸润,多分布于胃窦,EUS下多起源于黏膜下层,呈低回声,不易与异位胰腺相鉴别。类癌又称神经内分泌肿瘤,具有恶变倾向。本研究中其在EUS下多表现为固有肌层的低或中低回声,故多被误诊为GIST。其他少见病变如纤维瘤、神经鞘瘤、杜氏病、淋巴瘤和血管瘤等通常表现为低回声或中等回声,部分回声不均匀,因缺乏特异性表现且发病率低,常不能被识别,而被误诊为GIST、平滑肌瘤或异位胰腺。
对于胃SMTs中少见的恶性肿瘤以及部分有恶变倾向的良性肿瘤,需早期诊断,尽早切除。EUS引导下细针穿刺针吸活检(endoscopic ultrasonography guided fine needle aspiration,EUS-FNA)可取得细胞学材料而获得病理结果,细胞学诊断敏感性为78.40%[14]。但术前穿刺活检的必要性、取材的成功率及诊断的准确率都不确定,并且有增加出血和肿瘤播散的风险[15-16],所以EUS-FNA目前并未在临床上广泛开展。因此,最终的确诊需要依靠术后组织标本的病理学和免疫组化联合诊断。
综上所述,EUS可以较准确地判断胃SMTs的起源层次;对GIST和脂肪瘤的诊断价值较高,但对诊断平滑肌瘤、错构瘤、炎性纤维性息肉、类癌和纤维瘤等少见病变存在一定的局限性,需结合术后病理及免疫组化检查。因此,必要时应积极地切除病变,以明确诊断,防止恶变。
[1]杨爱明, 陆星华, 鲁重美, 等. 超声内镜在上消化道粘膜下肿瘤诊断中的应用[J]. 中华消化内镜杂志, 2000, 17(3):163-165.
[1]YANG A M, LU X H, LU Z M, et al. Use of endoscopy ultrasonography to diagnose submucosal tumors of upper gastrointestinal tract[J]. Chin J Dig Endosc, 2000, 17(3):163-165. Chinese
[2]任育宏, 张志强, 高鸿亮, 等. 经胃镜治疗胃黏膜下肿瘤61例临床分析[J]. 中国内镜杂志, 2016, 22(3):18-22.
[2]REN Y H, ZHANG Z Q, GAO H L, et al. Clinical analysis of endoscopic treatment for patients with gastric submucosal tumors (61 cases)[J]. China Journal of Endoscopy, 2016, 22(3):18-22. Chinese
[3]PAPANIKOLAOU I S, TRIANTAFYLLOU K, KOURIKOU A, et al. Endoscopic ultrasonography for gastric submucosal lesions[J]. World J Gastrointest Endosc, 2011, 3(5):86-94.
[4]郭花, 盛剑秋, 金鹏, 等. 超声内镜对消化道黏膜下肿物的诊断价值[J]. 中华消化内镜杂志, 2014, 31(9):508-512.
[4]GUO H, SHENG J Q, JIN P, et al. The diagnostic value of endoscopic ultrasonography for gastrointestinal submucosal tumors[J]. Chin J Dig Endosc, 2014, 31(9):508-512. Chinese
[5]LANDI B, PALAZZO L. The role of endosonography in submucosal tumours[J]. Best Pract Res Clin Gastroenterol, 2009, 23(5):679-701.
[6]KINDBLOM L G, REMOTTI H E, ALDENBORG F, et al. Gastrointestinal stromal tumours show phenotypic characteristics of the interstitial cells of Cajal[J]. Am J Pathol, 1998, 152(5):1259-1269.
[7]DE VOGELAERE K, VAN LOO I, PETERS O, et al. Laparoscopic resection of gastric gastrointestinal stromal tumors (GIST) is safe and effective, irrespective of tumor size[J]. Surg Endosc, 2012, 26(8):2339-2345.
[8]CASALI P G, JOST L, REICHARDT P, et al. Gastrointestinal stromal tumours:ESMO clinical recommendations for diagnosis, treatment and follow-up[J]. Ann Oncol, 2009, 20(Suppl 4):64-67.
[9]BLACKSTEIN M E, BLAY J Y, CORLESS C, et al. Gastrointestinal stromal tumours:consensus statement on diagnosis and treatment[J]. Can J Gastroenterol, 2006, 20(3):157-163.
[10]VON MEHREN M, BENJAMIN R S, BUI M M, et al. Soft tissue sarcoma, version 2.2012 featured updates to the NCCN guidelines[J]. J Natl Compr Canc Netw, 2012, 10(8):951-960.
[11]GOKHALE U A, NANDA A, PILLAI R, et al. Heterotopic pancreas in the stomach:a case report and a brief review of the literature[J]. JOP, 2010, 11(3):255-257.
[12]SAKAMOTO H, KITANO M, KUDO M. Diagnosis of subepithelial tumors in the upper gastrointestinal tract by endoscopic ultrasonography[J]. World J Radiol, 2010, 2(8):289-297.
[13]RYAN A, LAFNITZEGGER J R, LIN D H, et al. Myoepithelial hamartoma of the duodenal wall[J]. Virchows Arch, 1998, 432(2):191-194.
[14]KIM M N, KANG S J, KIM S G, et al. Prediction of risk of malignancy of gastrointestinal stromal tumors by endoscopic ultrasonography[J]. Gut Liver, 2013, 7(6):642-647.
[15]MOON J S. Endoscopic ultrasound-guided fi ne needle aspiration in submucosal lesion[J]. Clin Endosc, 2012, 45(2):117-123.
[16]DUMONCEAU J M, DEPREZ P H, JENSSEN C, et al. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology:European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline-Updated January 2017[J]. Endoscopy, 2011, 43(10):897-912.

