四步解决氧化还原反应方程式书写难题
摘要:在历年高考中,氧化还原反应方程式和电极方程式的书写都是重点和难点,对学生的综合能力要求较高。学生因为没有清晰地方向和步骤,往往思维混乱或顾此失彼,造成这类题目得分率较差,甚至久而久之变成望而生畏干脆就放弃了。化学反应本应是化学教学中的重点,也是这门学科最迷人之处,放弃这方面的研究,那再学化学就如同嚼蜡索然无味了。失去兴趣,自然再不可能学好。为了帮助学生更好地掌握这个知识,在要求学生掌握有关氧化还原反应基本概念和原理的基础上,我总结了一个“四步曲”,帮助学生梳理解决此类问题的思路。
关键词:高中化学;氧化反应;还原反应
下面我通过研究一道高考真题来讲解这四个步骤:
例1为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
完成NaClO3氧化FeCl2的离子方程式:
ClO-3+Fe2++Cl-+Fe3++(2015天津卷)
【解析】第一步:找出参与氧化还原反应的物质。
在本题中已经明确给出了参与氧化还原反应的四种物质,这为解题指明了方向。
第二步:配平得失电子数目。
依据氧化还原反应中电子得失数目相等或化合价升降数目相等的原则,配平第一步中各物质的系数。
ClO-3→Cl-,得到6e-;Fe2+→Fe3+,失去e-;依据得失电子数目相等,ClO-3的系数为1,Fe2+的系数为6,再根据原子守恒确定Cl-的系数为1,Fe3+的系数为6。
1ClO-3+6Fe2++1Cl-+6Fe3++
第三步:注意介质酸碱性,依据电荷守恒原理配平方程式两边的电荷。
观察方程式可以看到:左边带11个单位的正电荷,右边带17个单位的正电荷,配平电荷需要在左边增加6个单位的正电荷或在右边增加6个单位的负电荷。从题中可知,溶液呈酸性,所以应该增加H+,即左侧填6H+。
1ClO-3+6Fe2++6H+1Cl-+6Fe3++
第四步:依据原子守恒,配平其他物质。
观察方程式两边,可以看到左侧多出6个H原子和3个O原子,所以在右侧填3个H2O分子就可完成此方程式。
1ClO-3+6Fe2++6H+1Cl-+6Fe3++3H2O
例2+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O2-7还原成Cr3+,该反应的离子方程式为。(2016年新课标I卷)
【解析】第一步:写出参与氧化还原反应的物质。
由题意可知Cr2O2-7→Cr3+,所以HSO-3做还原剂,应为HSO-3→SO2-4
Cr2O2-7+HSO-3—Cr3++SO2-4
第二步:配平得失电子数目。
Cr2O2-7→Cr3+,Cr从+6价变成+3价,Cr2O2-7得到6e-,HSO-3→SO2-4,S从+4价变成+6价,HSO-3失去2e-,故:
1Cr2O2-7+3HSO-3-2Cr3++3SO2-4
第三步:配平电荷。
观察到方程式左边带5个负电荷,右边不带电,再特别注意到介质是NaHSO3溶液,一般显酸性,所以在方程式左边增加5个H+。
1Cr2O2-7+3HSO-3+5H+-2Cr3++3SO2-4
第四步:配平其他物质。
依据原子守恒观察到方程式左边比右边多8个H和4个O,所以在右边配上4个H2O即可配平。
1Cr2O2-7+3HSO-3+5H+2Cr3++3SO2-4+4H2O
例3当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO2-3将NO2转化为NO-2,其离子方程式为:。(2015年江苏卷)
【答案】SO2-3+2NO2+2OH-SO2-4+2NO-2+H2O
【解析】pH约为8,说明溶液显碱性,配平氧化剂(产物)、还原剂(产物),根据原子个数守恒和所带电荷数守恒,配平其他,SO2-3+2NO2+2OH-SO2-4+2NO-2+H2O;
【2016江苏卷】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O2-7的酸性废水通过铁炭混合物,在微电池正极上
Cr2O2-7转化为Cr3+,其电极反应式为。
【答案】(1)Cr2O2-7+6e-+14H+2Cr3++7H2O
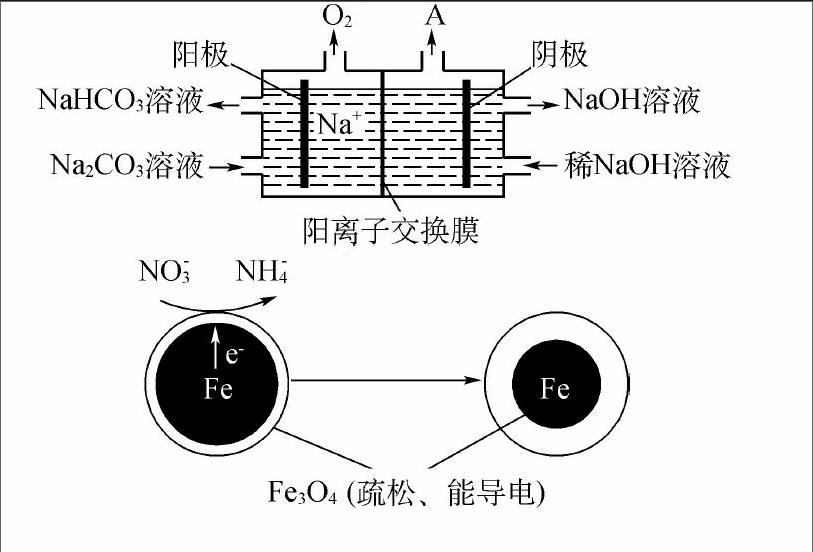
【2017江苏卷】(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为,阴极产生的物质A的化学式为。
【答案】(3)石墨电极被阳极上产生的O2氧化
(4)4CO2-3+2H2O-4e-4HCO-3+O2↑H2
【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO-3)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO-3的反应原理如图所示。
①作负极的物质是。
②正极的电极反应式是。
【答案】(1)①Fe
②NO-3+8e-+10H+NH+4+3H2O
作者簡介:樊云峰,河北省邢台市,河北省邢台市第二中学。endprint

