加速康复外科理念对妇科腹腔镜手术麻醉相关并发症的防治
关宏锐,杨小宇,张伟锋,马志佳
1开平市中心医院麻醉科,广东 开平 529300;2中山大学附属第一医院麻醉科,广东 广州 510315
加速康复外科(ERAS)理念通过基于具有循证医学证据的多学科优化治疗措施,能够起到促进患者术后恢复、缩短住院时间、减轻医疗负担等诸多优势[1]。随着临床实践和研究的不断积累,各专科也逐渐制定自己的专科ERAS指南[2-4]。一些研究对妇科肿瘤手术中ERAS的应用进行了探索,但其内容主要关注围术期ERAS操作对妇科相关结局指标的影响[5-6],却鲜有报道ERAS对麻醉相关指标的作用,同时,微创手术技术越来越广泛的应用于妇科疾病治疗,阐述ERAS对妇科腔镜手术患者麻醉相关指标的影响对临床麻醉工作具有切实的意义。本研究通过妇科腹腔镜手术中ERAS应用对麻醉相关并发症防治的作用,进一步为ERAS的推广应用提供依据。
1 资料与方法
1.1 一般资料
经本院伦理委员会批准,选取我院2015年10月~2016年10月首次接受择期腹腔镜妇科手术的患者156例,年龄25~51岁,ASAⅠ~Ⅱ级,术前取得患者及家属同意并签署知情同意书。排除标准:合并高血压、糖尿病、严重器官功能障碍及心脑血管疾病者;恶性肿瘤患者;营养筛查提示存在重度营养风险者或体质量指数(BMI)大于30 kg/m2者;免疫功能低下或使用免疫抑制剂者;无法取得家属或患者知情同意者。采用随机数字表法将患者随机分成2组:ERAS和对照组,每组78例。两组患者的年龄、BMI、ASA分级、诱导后鼻咽腔温度以及手术和麻醉时间等一般资料差异均无统计学意义(P>0.05,表1)。
1.2 术前访视
所有患者入院后进行健康宣教和心理指导,术前进行常规访视并签署麻醉知情同意书,其中ERAS组访视时根据患者年龄、手术麻醉方式及术后镇痛等方面的不同进行个体化麻醉前宣教。评估患者呼吸功能,吸烟者戒烟锻炼呼吸功能并结合雾化吸入和物理治疗促进痰液排出。ERAS组术前6 h禁固体饮食,术前2 h口服10%葡萄糖液400 mL;对照组术前1 d午夜后开始禁食禁饮。
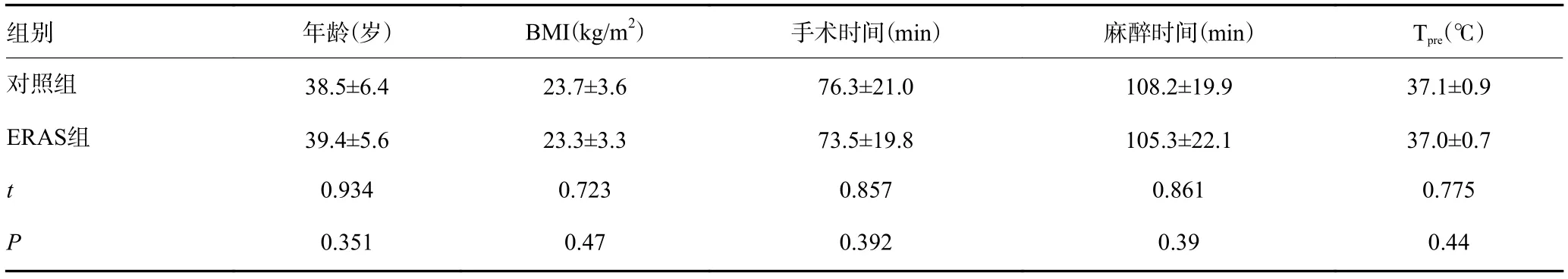
表1 患者一般资料比较(Mean±SD)
1.3 麻醉方式
所有患者入室后常规监护无创血压、心电图和血氧饱和度,麻醉诱导气管内插管后监测鼻咽腔温度和呼气末二氧化碳;ERAS组患者完成诱导后进行脑电双频谱指数监测,术中脑电双频指数维持在45~60。麻醉诱导:采咪达唑仑0.05 mg/kg,丙泊酚1.5~2.0 mg/kg,联合舒芬太尼0.5~1 μg/kg,维库溴铵0.1 mg/kg进行快速诱导气管内插管。术中麻醉维持ERAS组采用丙泊酚血浆靶浓度3.0~3.5 μg/mL联合瑞芬太尼血浆靶浓度5~6 ng/mL靶控输注,对照组采用吸入1.5MAC的七氟烷联合瑞芬太尼静脉泵注维持麻醉,术中根据需要追加维库溴铵和舒芬太尼,手术结束前10 min停止丙泊酚输注,皮肤缝合完成时停止瑞芬太尼输注。ERAS组应用肺保护性机械通气策略,即小潮气量6 mL/kg联合6 cmH2O呼气末正压(PEEP);对照组采用常规容量控制机械通气。
1.4 术中补液
ERAS组术中保持尿量30~50 mL/h,在此前提下给予限制补液6~8 mL/(kg·h),遇血压下降超过基础值的20%者以麻黄碱6~10 mg/kg或去氧肾上腺素0.2 mg/kg静脉注射予以纠正;对照组根据术前禁食水时间采用4-2-1法则进行补液。
1.5 体温保护
控制环境温度保持在22~24℃,ERAS组术中补液采用加温装置,冲洗液预先加温并在无菌区域外加用保温毯;对照组不强调术中保温措施。
1.6 术后镇痛
ERAS组于手术结束前30 min静脉注射40 mg帕瑞昔布钠进行超前镇痛;对照组术后镇痛不作强调或按需镇痛。
1.7 结局指标
记录拔管时间、麻醉复苏室(PACU)停留时间、拔管后30 minVAS评分、术后24 h内恶心呕吐发生率、寒战发生率、苏醒延迟发生率。
1.8 统计分析
采用SPSS19.0进行统计分析,计量资料以均数±标准差表示,组间比较采用独立样本t检验,组内比较采用单因素方差分析,计数资料以百分比(%)表示,采用卡方检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者术后情况
对照组入PACU后气管导管拔出时间长于ERAS组(P<0.05);两组PACU停留时间差异无统计学意义(P>0.05);对照组气管导管拔出后30 min时VAS评分高于ERAS组(P<0.05);手术结束时患者鼻咽腔温度ERAS组高于对照组,差异有统计学意义(P<0.05,表2)。

表2 患者术后情况比较(Mean±SD)
2.2 两组患者麻醉并发症发生率
对照组术后寒战及24 h内恶心呕吐发生率高于ERAS组(P<0.05);手术结束时ERAS组体温高于对照组(P<0.05);对照组2例患者发生术后苏醒延迟,两组差异无统计学意义(P>0.05);两组患者复苏后躁动发生率之间差异无统计学意义(P>0.05,表3)。
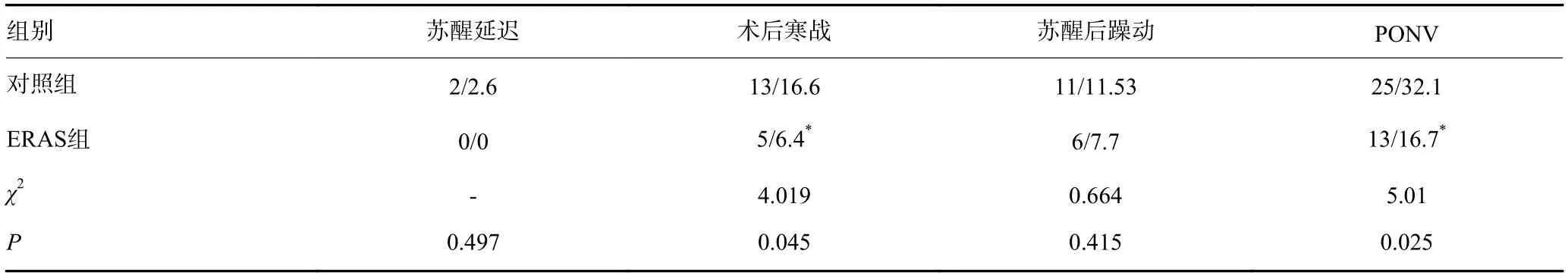
表3 患者麻醉相关并发症发生率比较(n/%)
3 讨论
加速康复外科理念在临床应用中产生的正面效应正得到越来越多临床医师的认可,更有一些研究认为目前ERAS治疗模式常规开展的重要性已经毋庸置疑,如何对ERAS的内容和流程进行规范和优化才是真正诚待解决的问题[7-8]。有研究认为相对于常规经腹手术,腔镜技术和ERAS策略这两者的结合应用虽能够改善临床解决,但腔镜技术的应用似乎才是这中结果的主要原因[9]。而本研究证实,在同样采用腹腔镜技术的情况下,ERAS的应用仍然能够降低术后恶心呕吐、寒战、躁动及苏醒延迟等麻醉后并发症的发生率和疼痛水平,且不延长PACU停留时间,能够有效缩降低围术期麻醉相关并发症发生率,促进妇科腹腔镜手术患者术后早期恢复。
患者的恐惧与焦虑、外科手术的刺激以及麻醉对生理机能的影响是围手术期患者应激的主要原因。术前访视中就对操作流程、预期镇静镇痛效果的沟通能够部分消除患者对未知环境和操作的恐惧和焦虑。腔镜技术的应用大大降低了常规手术创伤造成的应激,但气腹和盆腔操作时的头低位降低了膈肌的活动度和肺顺应性,降低功能残气量并可能导致气泡萎陷和二氧化碳蓄积[10],本研究ERAS组采用小潮气量联合PEEP的肺保护性通气策略,避免高气道压导致的肺泡过度膨胀和终末细支气管反复开闭造成的剪切伤[11],同时PEEP的应用可在一定程度上避免肺泡萎陷,这些措施能够促进术后早期呼吸功能的恢复,缩短气管导管拔除时间。
既往的临床实践中,患者术前午夜后开始禁食禁饮,加之术前口渴焦虑加重患者的烦躁,使得患者术前处于代谢应激的状态,围术期血糖的剧烈波动可能增加患者术后并发症的发生率[12]。本研究采用术前2 h饮用适量含碳水化合物的饮料,也有研究证实,这些术前干预措施能够加速患者的康复[13]。这是因为术前补充碳水化合物能够缓解患者口渴和饥饿感,同时能够抑制患者围术期血糖波动,增加患者的能量储备,促进胰岛素的分泌并减少胰岛素抵抗,这对患者的术后恢复起到促进作用。且胃对清饮的排空时间为1~2 h,此方案应用于无胃肠功能障碍的患者并不增加返流误吸的风险[14]。
腹腔镜操作虽减少了开放体腔导致的体温下降,但环境温度、消毒、冲洗及呼吸道热量丢失等多方面因素仍可导致患者术中体温降低,围术期低体温能够引起凝血功能紊乱,低温引起的寒战可增加能量消耗并产生机体应激反应,其还可能导致术后苏醒延迟[15-16]。本研究结果显示两组患者术后苏醒延迟发生率及PACU停留时间的差异无统计学意义,但妇科腹腔镜手术中积极应用体温保护措施能够减少患者体温降低并明显降低术后寒战的发生率,同时可能缩短术后气管导管拔除时间,这无疑对患者术后的早期恢复起到正面作用。不断优化术后镇痛措施,应用硬膜外镇痛、患者自控镇痛泵等多模式镇痛减轻患者术后疼痛已被证实有利于患者的术后早期恢复。在镇痛环节中,合理减少阿片类药物的用量,既是优化镇痛效果减少镇痛相关并发症的目的也是其重要手段[17-18]。妇科腔镜手术中应用非阿片类药物可明显降低复苏后患者VAS评分,产生良好的镇痛效果,同时减少术后恶心呕吐的发生率[18],本研究结果显示,ERAS组术后术后恶心呕吐和寒战发生率均明显低于对照组,有研究表明相较吸入麻醉药物,丙泊酚也能够减少术后恶心呕吐的发生率[19-20]。
综上所述,妇科腔镜手术中应用ERAS理念进行麻醉实施和管理能够缩短术后气管导管拔除时间、降低术后寒战和术后恶心呕吐的发生率,促进患者术后早期恢复。
[1]中国加速康复外科专家组. 中国加速康复外科围手术期管理专家共识(2016)[J]. 中华外科杂志, 2016, 54(6): 413-8.
[2]Nelson G, Altman AD, Nick A, et al. Guidelines for pre- and intraoperative care in gynecologic/oncology surgery: Enhanced Recovery After Surgery (ERAS (R)) Society recommendations-Part I[J]. Gynecol Oncol, 2016, 140(2): 313-22.
[3]Nelson G, Altman AD, Nick A, et al. Guidelines for pre-and intraoperative care in gynecologic/oncology surgery:Enhanced Recovery After Surgery(ERAS®)Society recommendations--Part II[J]. Gynecol Oncol, 2016, 140(2): 323-32.
[4]De Groot JJ, Maessen JM, Slangen BF, et al. A stepped strategy that aims at the nationwide implementation of the Enhanced Recovery After Surgery programme in major gynaecological surgery:study protocol of a cluster randomised controlled trial[J].Implement Sci, 2015, 46(10): 106-9.
[5]Altman AD, Nelson GS. The Canadian gynaecologic oncology perioperative management survey:baseline practice prior to implementation of enhanced recovery after surgery(ERAS)society guidelines[J]. J Obstet Gynaecol Can, 2016, 38(12): 1105-9.
[6]Lindemann K, Kok PS, Stockler M, et al. Enhanced recovery after surgery for suspected ovarian malignancy a survey of perioperative practice among gynecologic oncologists in Australia and New Zealand to inform a clinical trial[J]. Int J Gynecol Cancer, 2017,27(5): 1046-50.
[7]Kalogera E, Dowdy SC. Enhanced recovery pathway in gynecologic surgery improving outcomes through Evidence-Based medicine[J]. Obstet Gynecol Clin North Am, 2016, 43(3): 551-5.
[8]Abeles A, Kwasnicki RM, Darzi A. Enhanced recovery after surgery: Current research insights and future direction[J]. World J Gastrointest Surg, 2017, 9(2): 37-45.
[9]Spanjersberg WR, van Sambeeck JD, Bremers A, et al. Systematic review and meta-analysis for laparoscopic versus open colon surgery with or without an ERAS programme[J]. Surg Endosc,2015, 29(12): 3443-53.
[10]Bardoczky GI, Yernault JC, Houben JJ, et al. Large tidal volume ventilation does not improve oxygenation in morbidly obese patients during anesthesia[J]. Anesthesia & Analgesia, 1995,81(2): 385-8.
[11]邱晓东, 周 晶, 叶 卉, 等. 术中肺保护性通气策略对开腹手术老年患者术后肺部并发症的影响[J]. 临床麻醉学杂志, 2016, 32(1):28-32.
[12]王天怡, 敖虎山. 非体外循环冠状动脉旁路移植术术中血糖波动与术后高血糖的关系[J]. 安徽医学, 2017, 38(7): 877-80.
[13]Leissner KB, Shanahan JL, Bekker PL, et al. Enhanced recovery after surgery in laparoscopic surgery[J]. J Laparoendosc Adv Surg Tech A, 2017, 27(9): 883-91.
[14]Itou K, Fukuyama T, Sasabuchi Y, et al. Safety and efficacy of oral rehydration therapy until 2 h before surgery: a multicenter randomized controlled trial[J]. J Anesth, 2012, 26(1): 20-7.
[15]John M, Crook D, Dasari K, et al. Comparison of resistive heating and forced-air warming to prevent inadvertent perioperative hypothermia[J]. Br J Anaesth, 2016, 116(2): 249-54.
[16]Adriani MB, Moriber N. Preoperative forced-air warming combined with intraoperative warming versus intraoperative warming alone in the prevention of hypothermia during gynecologic surgery[J]. Aana J, 2013, 81(6): 446-51.
[17]Fawcett WJ, Baldini G. Optimal analgesia during major open and laparoscopic abdominal surgery[J]. Anesthesiol Clin, 2015, 33(1):65-78.
[18]Jouve P, Bazin JE, Petit A, et al. Epidural versus continuous preperitoneal analgesia during fast-track open colorectal surgery: a randomized controlled trial[J]. Anesthesiology, 2013, 118(3): 622-30.
[19]Blanton E, Lamvu G, Patanwala I, et al. Non-opioid pain management in benign minimally invasive hysterectomy: A systematic review[J]. Am J Obstet Gynecol, 2017, 216(6): 557-67.
[20]Kawano H, Ohshita N, Katome K, et al. Effects of a novel method of anesthesia combining propofol and volatile anesthesia on the incidence of postoperative nausea and vomiting in patients undergoing laparoscopic gynecological surgery[J]. Am J Obstet Gynecol, 2016, 66(1): 12-8.