中性粒细胞和淋巴细胞比值对乳腺癌患者总体生存期的预测价值
李 飞,钟玉钗,莫伟平,张拔山
东莞市人民医院,广东 东莞 523059
乳腺癌是女性最常见的肿瘤恶性肿瘤之一,随着年龄的增加患此病的风险也不断增加,19世纪有学者在肿瘤组织中发现炎性细胞的存在,并首次提出炎性反应与肿瘤的发生、发展之间存在某种关联[1-3]。中性粒细胞与淋巴细胞比值(NLR)作为易检测的炎症指标,已有研究证实其同胃肠道癌症、肝细胞癌、肺癌等许多癌症的预后相关,是癌症患者的独立预后因素[4-6]。然而极少报道NLR在女性乳腺癌中的预后价值,虽然以手术治疗为主的综合治疗已显著改善乳腺癌患者的预后,但其总体预后仍不理想。寻求一种简单方便且敏感特异高的乳腺癌癌患者预后预测指标,用于早期发现肿瘤、指导治疗决策,具有重要意义。本研究调查了NLR与女性乳腺癌患者的无病生存期(DFS)和总体生存期(OS)之间的关系。
1 资料与方法
1.1 一般资料
选取本院2010年7月~2012年2月确诊为浸润性乳腺癌(T1-4 N0-3 M0)的患者纳入研究。排除标准:(1)非侵袭性乳腺癌或者Ⅳ期乳腺癌或炎性乳腺癌;(2)采用术前治疗包括新辅助化疗(CT);(3)患者缺乏病理或实验室结果;(4)具有全身性炎症或者慢性疾病例如心力衰竭、系统性红斑狼疮、血液病、肝硬化和冠状动脉疾病的患者。本研究共纳入280例患者,所有患者的病理资料和临床数据均由电子病历收集。本研究获东莞市人民医院伦理委员会批准,所有患者均签署知情同意书。所有患者均随访至5年或退出该研究,由专人负责随访。
1.2 研究方法
1.2.1 检测指标 雌激素受体(ER)、孕激素受体(PR)、表皮生长因子受体-2(HER-2)、肿瘤增殖抗原(Ki-67)。
1.2.2 检测方法和研究分组 所有研究对象均于清晨空腹采血,其中2 mL静脉血用EDTA-K2抗凝,应用SIMENS ADVIA 2120 全血细胞分析仪检测血常规。罗氏全自动免疫组化分析仪检测ER,PR,HER-2及Ki-67。免疫组织化标准:将免疫组化ER、PR阳性细胞表达率≥10% 表示阳性,否则表示阴性;Her-2表达水平为“+”~“+ + +”的表示Her-2 过表达,其余表示Her-2 阴性表达或不详。NLR值主要指在进行手术前且未开始任何治疗时的检测结果。根据ROC曲线(图1、2),同时兼顾敏感性和特异性(曲线下面积的最大值),以NLR=2.63作为评价无病生存期和总体生存期的最佳分界点,分为术前低NLR组(NLR≤2.63,188例)和高NLR组(NLR>2.63,92例)。
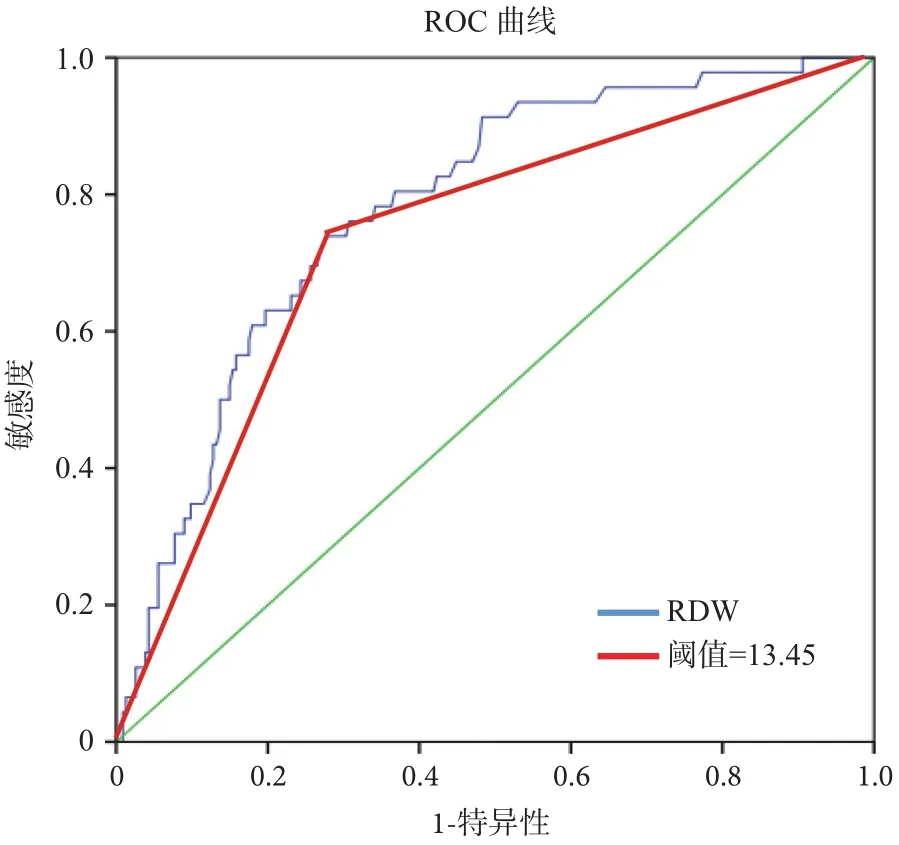
图1 NLR判断乳腺癌患者总体生存率的ROC曲线
1.3 统计学处理
应用SPSS23.0软件进行统计学分析。Kolmogorov-Smirnov检验用于检验正常年龄和NLR值的正态分布情况。非正态分布数据用中位数表示,并用Wilcoxon秩和检验进行比较,卡方检验进行分类变量的比较。以死亡和复发为终点事件,检查时间为最后1次随访时间,Kaplan Meier生存曲线使用对数秩检验和Cox比例风险回归分析来比较存活率及临床病理资料。单变量Cox回归分析中P<0.05的变量使用向前逐步选择进行多变量分析。P<0.05为差异具有统计学意义。
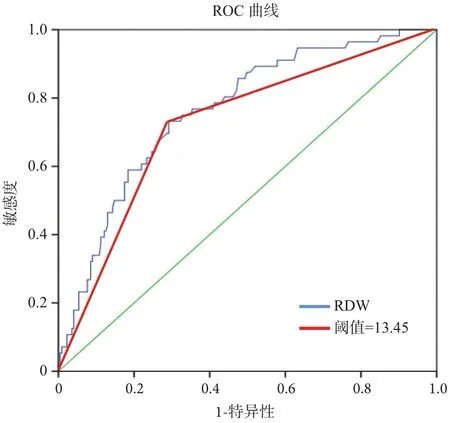
图2 NLR判断乳腺癌患者无病生存率的ROC曲线
2 结果
本研究纳入的女性乳腺癌患者平均年龄是49岁,随访时间中位数为63月(12~74月)。治疗前的NLR分布范围如图3所示(0.65~8.58,平均2.54)。根据ROC曲线将NLR=2.63作为分界点分成高低2组。当NLR的cut-off值为2.63(P=0.001),患者从手术之后到死亡的这段时间,NLR的灵敏度= 69.2%,特异性=76.1%(图1)。对于手术到局部区域复发或远处转移,其灵敏度=70.9%,特异性=73.2%(P=0.001,图2)。
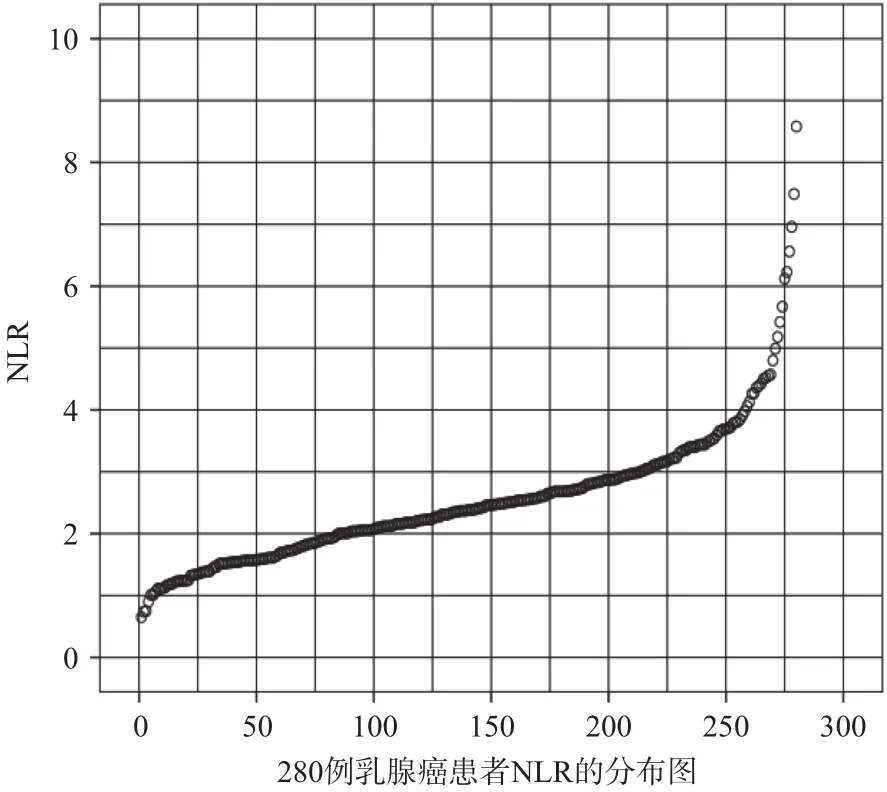
图3 280名乳腺癌患者的NLR的分布曲线
其中172名患者被分到低NLR组以及108名患者被分到高NLR组。NLR与ER、PR、Ki-67、手术类型、是否接受化疗及化疗方案没有相关性(P>0.05);然而高NLR组与年龄(P=0.041)、肿瘤的大小(33.8%vs61.2%,19.6%vs80.4%,P=0.006)、淋巴转移阳性(52.1%vs47.9%,35.9%vs64.1%,P=0.027)、HER-2(67.4%vs37.6%,55.6%vs44.4%,P=0.003)以及TNM分期(恶性程度,P=0.008)具有相关性(表1)。
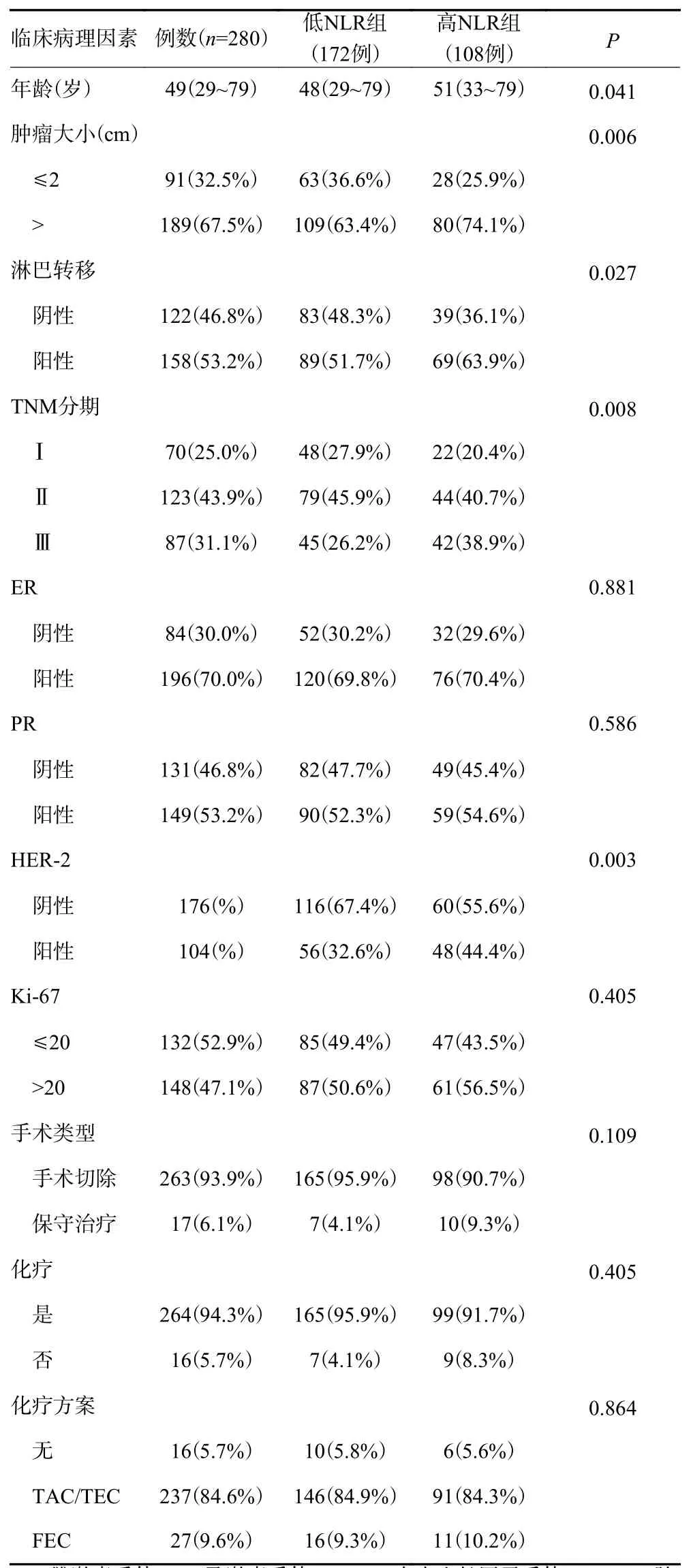
表1 高NLR组和低NLR组乳腺癌患者临床病理特征的比较
高NLR组的总体生存率(5年生存率)比低NLR组低(67.0%vs94.1%,P<0.001,图4),高NLR组的无病生存率也比低NLR组低(61.5%vs91.3%,P<0.001,图5)。
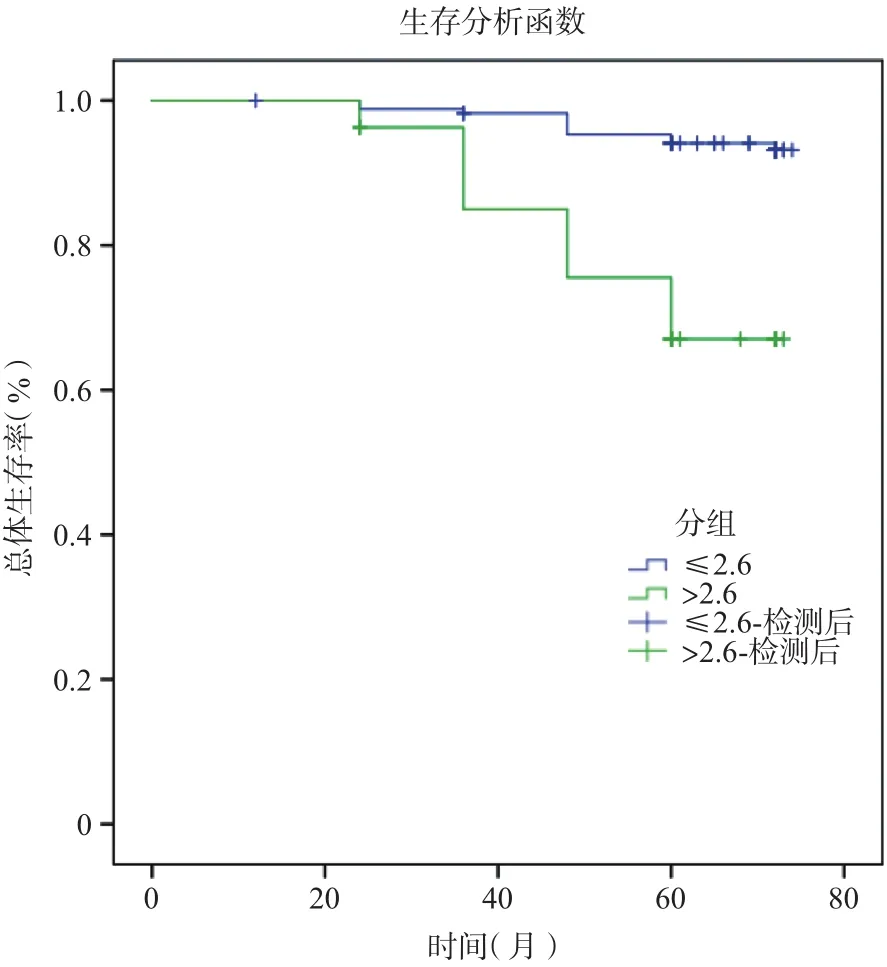
图4 高NLR组与低NLR组总体生存曲线的比较
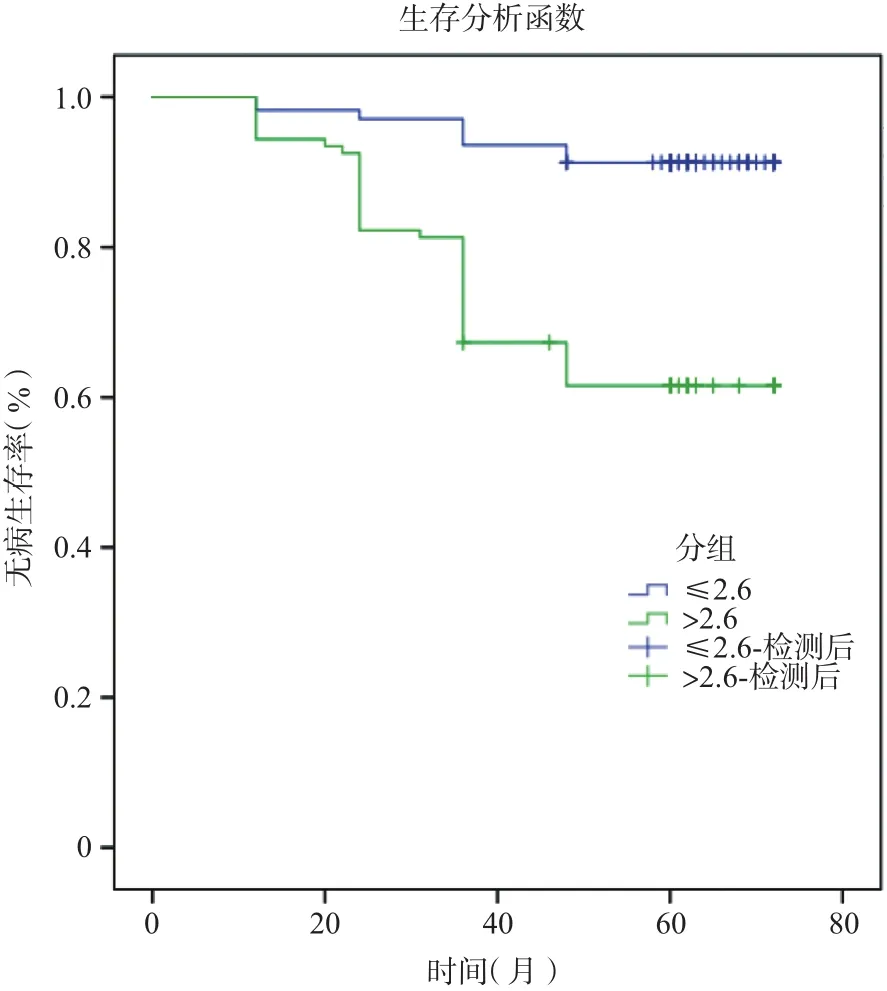
图5 高NLR组与低NLR组无病生存曲线的比较
对于乳腺癌患者的Cox单变量回归分析显示(表2),年龄、高NLR值、TNM分期(晚期程度)及PR阳性是总体生存的预后因子,风险比分别为1.03(95%CI:1.002~1.06 ,P=0.035 )、1.566 (95%CI:1.302~1.884,P<0.001 )、0.421 (95%CI:0.201~0.881 ,P=0.022 )、3.53(95%CI:1.556~8.012,P=0.003)。多变量统计分析,年龄、高NLR值、TNM分期(晚期程度)和PR阳性是总体生存的独立预后因素(P<0.05)。Cox单变量回归分析显示,年龄、高NLR值和PR阳性是无病生存的预后因子,其风险比分别为1.024(95%CI:0.999~1.049,P=0.049)、1.579(95%CI:1.33~1.874,P<0.001)和3.105(95%CI:1.456~6.242,P=0.003)。年龄、高NLR值和PR阳性状态是无病生存的独立预后因素(P<0.05)。
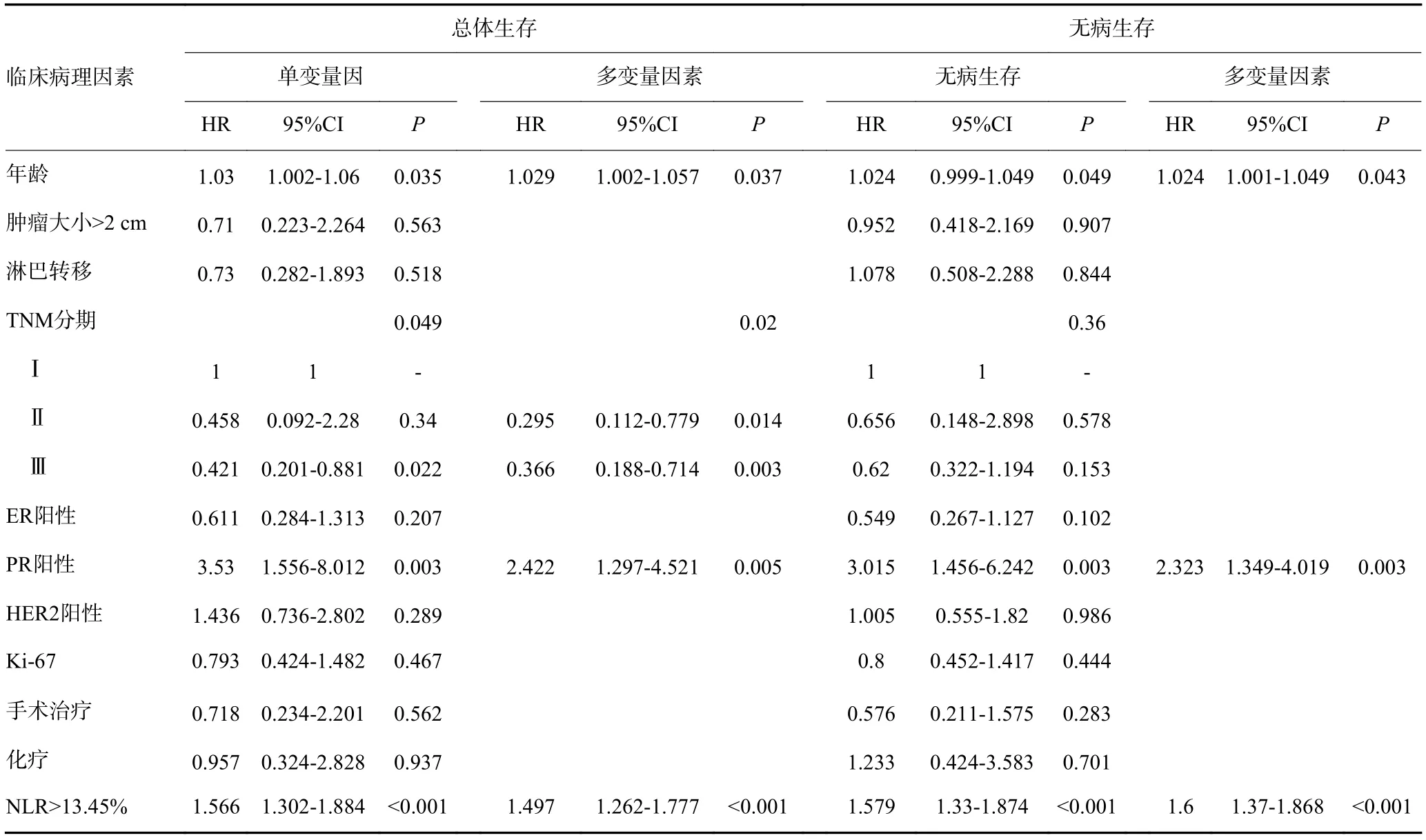
表2 Cox回归分析各临床病理因素对乳腺癌生存的影响
3 讨论
中国每年新增乳腺癌患者高达26万例,死亡7万例,位居中国女性所有肿瘤发病率之首[7]。有研究显示,乳腺癌术后10年内局部复发及转移率高达85%[8]。传统观点认为肿瘤患者的预后主要由肿瘤本身因素决定,比如肿瘤的TNM分期、分化程度等,近年来越来越多的研究显示,肿瘤病人的生存状况不仅与肿瘤的特征有关,还与患者机体的炎症反应状况有关[9-10]。恶性肿瘤被普遍认为可引起机体慢性炎症和营养不良[11],同时有学者也证实在很多实体肿瘤中系统性炎症反应都被视为影响肿瘤患者生存的独立预后因素[12-15]。炎症反应导致肿瘤转移概率的增加,进一步影响患者的预后[16-17]。当患者有炎症反应时,易可引起机体包括如中性粒细胞、淋巴细胞等的改变[18]。因此,NLR是否能成为潜在的肿瘤预后标志物值得探讨。
目前公认的乳腺癌预后指标包括TNM、ER、PR、HER-2、Ki-67等。相对以上预后指标而言,NLR是1个易检测的炎症标记物。NLR作为机体炎性反应最直观的生物标志物,可直观反应机体的炎性反应状态和免疫水平。本研究NLR取值与部分研究[19-20]取值相近,但与Koh[21]的研究结果不同。原因可能为:(1)分组依据不同,Koh依据NLR比值进行连续分组;而本实验依据通过受试者工作特征曲线确定NLR患者无病生存期和总体生存期的截点值,依据截点值将NLR分成两组;(2)观察指标不同,本研究观察所有患者的无病生存期和总体生存期,不同于其他研究观察患者的生存时间;(3)不同研究所用检测仪器不同。
本研究表明,NLR是乳腺癌患者生存预后的一个独立危险因素。同之前乳腺癌的相关报告相符[22]。此外,ROC曲线分析发现,当NLR为2.63时可作为预测复发或死亡的最合适阈值(OS:P=0.001;DFS:P=0.001),其特异性均接近75%,此外,本组资料发现术前高NLR乳腺癌患者其肿瘤大小更大,淋巴结转移数>2个及TNM分期更晚的几率显著增高,复发风险明显增高,生存率明显低于低NLR患者,术前NLR对于乳腺癌的预后具有良好的预测价值。
多因素预后研究分析结果显示,年龄、术前高NLR、TNM分期(晚期程度)和PR阳性是总体生存的独立预后因素,而且年龄、术前高NLR和PR阳性状态是无病生存的独立预后因素。术前NLR是乳腺癌患者预后生存的独立危险因素。加之在血常规检查中极易检测,并且其成本效益非常低廉,术前NLR可作为预测乳腺癌患者预后的良好的实验室指标,用以鉴定乳腺癌患者的预后。
综上,NLR是乳腺癌患者预后生存的独立危险因素,NLR在临床实际应用中容易检测,可为乳腺癌疾病提供方便可靠的预后预测指标。本研究有一定的局限性,属于单一实验中心进行的研究,回顾性收集和分析了少数患者,因而有待于更大规模的临床多研究中心的进一步研究和验证。
[1]Fertay J, Soerjomataram I. Cancer incidence and mortality wordwide: source, method, and major patterns in GLIBOCAN 2012[J]. Int J Cancer, 2015, 13(6): E359-86.
[2]Grivennikov SI, Greten FR, Immunity KM. Inflammation and cancer[J]. Cell, 2010, 140(6): 883-99.
[3]Balta S, Demirkol S, Kucuk U, et al. Neutrophil to lymphocyte ratio May predict mortality in breast cancer patients[J]. J Breast Cancer, 2013, 16(3): 354-5.
[4]马晋平, 王 智, 林建伟, 等. 中性粒细胞/淋巴细胞比值在胃癌预后评估中的应用[J]. 中华胃肠外科杂志, 2011, 14(12): 944-7.
[5]李 坚, 潘海燕, 蔡潮农, 等. 术前外周血中性/淋巴细胞比值对肝癌患者预后的影响[J]. 中山大学学报: 医学科学版, 2012, 33(3):394-7.
[6]Sarraf KM, Belcher E, Raevsky E, et al. Neutrophil/lymphocyte ratio and its association with survival after complete resection in non-small cell lung cancer[J]. J Thorac Cardiovasc Surg, 2009,137(2): 425-8.
[7]陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23(1): 1-10.
[8]Jemal A, Siegel R, Ward E, et al. Cancer statistics[J]. Cancer J Clin, 2013, 310(9): 982-6.
[9]Jo YH, Kim K, Lee JH, et al. Red cell distribution width is a prognostic factor in severe sepsis and septic shock[J]. Am J Emerg Med, 2013, 31(3): 545-8.
[10]Grant BJ, Kudalkar DP, Muti P, et al. Relation between lung function and RBC distribution width in a population-based study[J]. Chest, 2003, 124(2): 494-500.
[11]Seretis C, Seretis F, Lagoudianakis E, et al. Is red cell distribution width a novel biomarker of breast cancer activity, data from a pilot study[J]. J Clin Med Res, 2013, 5(2): 121-6.
[12]Yao M, Liu Y, Jin H, et al. Prognostic value of preoperative inflammatory markers in Chinese patients with breast cancer[J].Onco Targets Ther, 2014, 7(12): 1743-52.
[13]张 兴, 李 森, 郭忠武, 等. 75岁以上老年胃癌患者术前外周血中性粒细胞与淋巴细胞比值的临床意义[J]. 中华胃肠外科杂志, 2016, 19(5): 526-9.
[14]Bhatti I, Peacock O, Lloyd G, et al. Preoperative hematologic markers as Independent predictors of prognosis in resected pancreatic ductal adenocarcinoma: neutrophil-lymphocyte versus platelet-lymphocyte ratio[J]. Am J Surg, 2010, 200(2): 197-203.
[15]Kim HS, Han KH, Chung HH, et al. Neutrophil to lymphocyte ratio for preoperative diagnosis of uterine sarcomas: a casematched comparison[J]. Eur J Surg Oncol, 2010, 36(7): 691-8.
[16]Coussens Lm, Werb Z. Inflammation and cancer[J]. Nature, 2002,420(9): 860-7.
[17]Denardo DG, Johansson M, Coussens LM. Immune cells as mediators of solid tumor metastasis[J]. Cancer Metastasis Rev,2008, 27(1): 11-8.
[18]Nozoe T, Mori E, Takahashi I, et al. Preoperative elevation of serum C-reactive protein as an Independent prognostic indicator of colorectal carcinoma[J]. Surg Today, 2008, 38(7): 597-602.
[19]Noh H, Eomm M, Han AR. Usefulness of pretreatment neutrophil to lymphocyte ratio in predicting disease-specific survival in breast cancer patients[J]. J Breast Cancer, 2013, 16(1): 55-9.
[20]Nakano K, Hosoda M, Yamamoto MA. Prognostic significance of pre-treatment neutrophil: lymphocyte ratio in Japanese patients with breast cancer[J]. Anticancer Res, 2014, 34(7): 3819-24.
[21]Koh CH, Bhoo-Pathy N, Ng KL, et al. Utility of pre-treatment neutrophil-lymphocyte ratio and platelet-lymphocyte ratio as prognostic factors in breast cancer[J]. Br J Cancer, 2015, 113(1):150-8.
[22]Chen J, Deng Q, Pan Y, et al. Prognostic value of neutrophil-tolymphocyte ratio in breast cancer[J]. Open Bio, 2015, 5(12): 502-7.