中国妇女孕期及哺乳期暴露前预防人类免疫缺陷病毒感染的成本-效果分析
李子扬 刘永军 刘 娜 顾英立 杨美家
据世界卫生组织(WHO)数据报告,至2016年底,全球约有367万人患人类免疫缺陷病毒(艾滋病,human immunodeficiency virus,HIV)感染,有10万人死于HIV感染相关疾病。且感染HIV的生育年龄妇女人数迅速增加,已达到或超过感染人数的50%,由于 HIV传播途径中母婴传播为主要途径,严重威胁着儿童的生命安全[1]。因此,控制 HIV母婴传播,也就成为人类对抗艾滋病的重大举措之一。
面对严峻的艾滋病疫情,HIV疫苗正在研制中,已进入临床试验阶段,但最终结果仍无定论。因此,目前最有前景的艾滋病预防手段依然为暴露前预防(pre-exposure prophylaxis,PrEP),用药组合为替诺福韦(Tenofovir,TDF)300 mg加恩曲他滨(Emtricitabine,FTC)200 mg联用,服药方式为口服[2],于2012年进入中国市场,现已由正大天晴药业集团股份有限公司于2017年6月14日注册登记其仿制药的随机临床对照试验。
PrEP用药成本较高,但其若能成功预防HIV感染,控制相关疫情,则亦能降低卫生保健系统对于艾滋病患者治疗费用的成本支出。在中国,PrEP是否能够作为一项公共卫生政策进行推广,国内暂无相关卫生经济学评价,对于预防母婴传播的妇女孕期及哺乳期PrEP手段,更无针对性经济学研究。本研究旨在对中国妇女孕期及哺乳期PrEP HIV感染进行成本-效果分析,从而为PrEP的政策推广落实提供相关证据。
1 资料与方法
1.1 模型设定与假设本研究采用决策树模型,模型分析软件使用Treeage Pro 2011进行药物经济学分析,对 PrEP的有效性进行成本-效果分析,如图 1所示,其中不进行PrEP的决策组进行了分支隐藏,与PrEP组的决策模式完全相同,由于图片本身太大,对图片进行了裁剪,故参数设定部分在图中有所缺失。研究所需数据均来源于公开发表的文献以及相关权威机构发布的数据报告。模型研究对象为平均年龄为26.94岁的中国孕妇[3],模型研究角度为医疗系统角度。
模型假设入组孕妇均在怀孕第19周进行HIV感染检测,第39周进行生产。PrEP组口服药物时间为20周。孕妇可选择进行早产或足月产,产后可进行母乳喂养或非母乳喂养,假设哺乳期为15个月(1.25年),并对婴儿进行HIV感染检测。对于产前检测结果为HIV阴性的妇女于产后继续进行检测。2003年起,中国政府开始为艾滋病患者提供免费治疗机会,但庞大的艾滋病人群数目对于政府而言依然是个巨大的考验。据WHO网站统计结果显示,中国能够接受艾滋病抗逆转录病毒治疗(Antiretroviral Therapy,ART)的覆盖率暂无数据,因此选用与中国国内生产总值(GDP)接近的泰国相关数据,ART覆盖率为69%。
1.2 成本与产出参数根据决策树模型,研究选用的成本参数包括PrEP药物成本、HIV检测成本、生产(早产或足月产)成本、艾滋病ART成本,单位均为人民币(元)。
模型的产出参数一般包括质量调整生命年(quality- adjusted life year,QALY)或伤残调整生命年(disability-adjusted life year,DALY),本研究拟采用DALY作为产出指标[4]。DALY包括了由于早死而导致的寿命损失(years of life lost,YLL),在本模型中假设为婴儿出生时死亡的损失;此外,DALY指标还包括了由于疾病/伤残而导致的健康寿命年损失(yearslived with disability,YLD),在本模型中假设为产妇或者婴儿患HIV感染而导致的损失。研究采用3%的贴现率对成本与产出进行贴现[5]。产出的具体计算公式如下:


图1 决策树模型
其中公式(1)中N表示死亡人数,L表示到死亡时的标准期望寿命;公式(2)中,I表示伤残发生的人数,DW表示伤残权重,L表示伤残持续时间;以上公式中均已将贴现率值以0.03带入。
2 结果
2.1 成本信息结果见表1。
2.2 概率相关信息结果见表2。
2.3 产出相关信息结果见表3。
2.4 其他相关参数信息结果见表4。

表1 成本信息

表2 概率相关信息
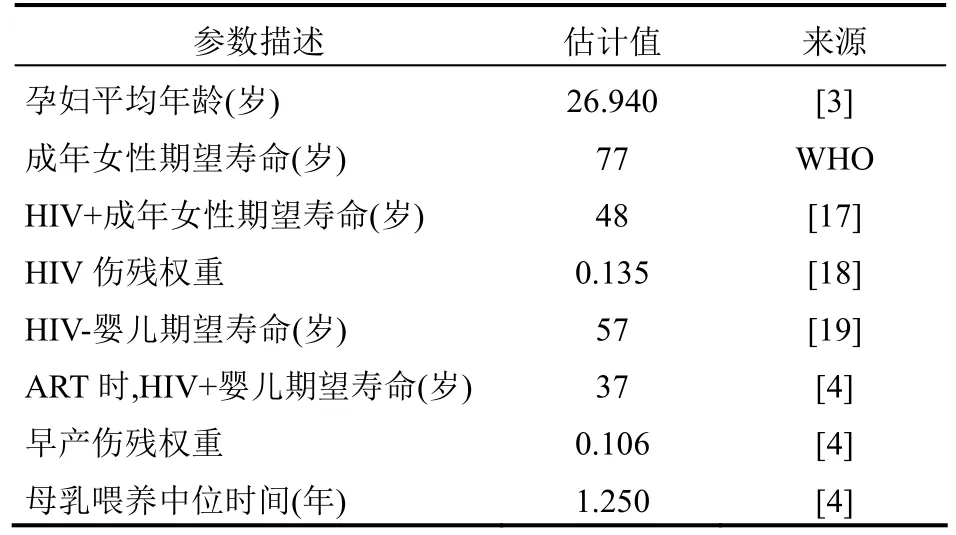
表3 产出相关信息

表4 其他参数信息
2.5 成本-效果分析结果结果如表 5所示,进行HIV PrEP的试验组与未口服PrEP的对照组人均成本分别为 14 893.76元和 8206.11元,其产出分别为0.096DALY和0.039DALY。因此,增量成本效果比值为117 327.37元/DALY,即避免一个DALY需要花费117 327.37元。2016年中国人均GDP为55 412元,由于当ICER值<1倍人均GDP值时为绝对优势方案,当ICER值<3倍人均GDP值时为相对优势方案[5],因此口服PrEP药物相较之下为相对优势方案。
2.6 敏感性分析本研究主要采用确定性敏感性分析,列入单因素敏感性分析的指标主要包括各成本指标以及各概率指标。各参数变动范围如表6所示。
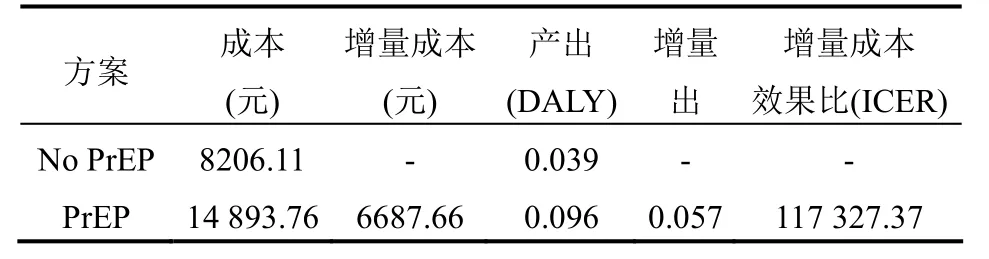
表5 成本-效果分析结果

表6 参数变动区间
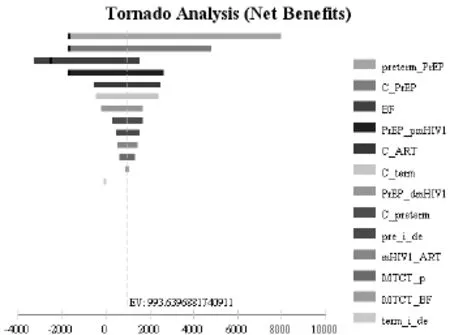
图2 单因素敏感性分析旋风图
单因素敏感性分析旋风图如图 2所示。可见,口服PrEP药物决策中的孕妇早产率、PrEP药物的成本费用以及母乳喂养率对结局影响最为显著。因此分别进行单因素敏感性分析,结果见图3-5。可见,口服 PrEP药物时的早产率在 0.162~0.300之间变动,孕期PrEP药物成本在3810.00~10 315.04元之间变动,母乳喂养率在 0.702~1.000之间变动时,口服PrEP药物进行PrEP较不预防手段依然具有相对成本-效果优势。

图3 口服PrEP时的早产率敏感性分析
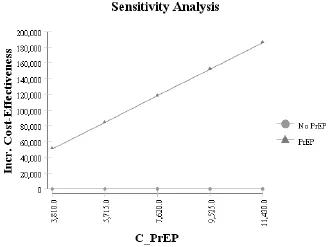
图4 PrEP药物成本的敏感性分析
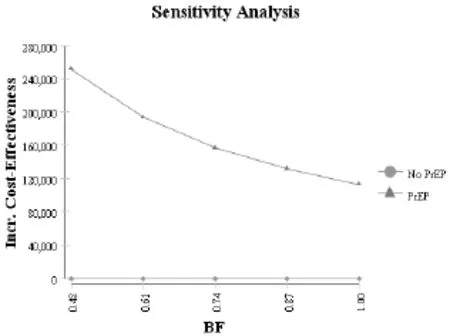
图5 母乳喂养率的敏感性分析
3 讨论
本研究根据一项贵州省四年孕产妇HIV感染流行病学特征报告结果,模拟中国孕妇从待产期至产后的HIV检测与病程情况,结合国内相关成本数据,构建决策树模型,对 PrEP药物的成本-效果进行评价。结果显示,相较于未预防组,PrEP策略的增量成本效果比值为117 327.37元/DALY,低于3倍中国2016年人均GDP值(166 236元),属于相对优势方案。但本研究仍存在以下几方面的不足:①由于数据来源限制,本研究的研究对象与成本、产出数据并不是完全一致的,与真实世界数据存在一定差异;②本研究中的一些假设条件可能存在一定的出入;③单因素敏感性分析中仅对三项影响较大的因素进行了分析,并未对其他因素进行单独分析。
艾滋病是世界首位公共卫生和社会问题之一,世界各国对其预防和治疗均需要投入相对更大的医疗卫生资源,因此防控工作就显得尤为重要。在艾滋病主要传播方式中,母婴传播不仅对母体造成危害,更为严重地影响了下一代的健康质量情况,提示防控工作具备现实意义。中国在放开二胎政策后,母婴安全更加成为一个现实性问题,对于中国妇女孕期及哺乳期的PrEP工作是否需要出台相关的卫生政策或进行大力推广,本研究在一定程度上提供了证据,表明在中国推行该项政策是相对经济可行的。但也由于研究的一系列局限性,还需要更多有力的产出结果,如质量调整生命年等,进行进一步分析,以供决策者进行更为全面的评估和选择。
[1]蒲杰,梁家智.预防艾滋病母婴传播的研究进展[J].现代预防医学,2013,40(6):1122-1124,1127.
[2]韦所苏,吴腾燕,谭毅.暴露前预防艾滋病病毒感染卫生经济学评价研究进展[J].中国临床新医学,2017,10(7):703-707.
[3]张弛,张玉琼,张爱华,等.贵州省2009—2012年孕产妇HIV感染流行病学特征[J].贵阳医学院学报,2013,38(6):604-606.
[4]Price JT,Wheeler SB,Stranix-Chibanda L,et al.Cost-Effectiveness of Pre-exposure HIV Prophylaxis During Pregnancy and Breastfeeding in Sub-Saharan Africa[J].J Acquir Immune D efic Syndr,2016,72(2):145-153.
[5]Edejer TT,Baltussen R,Adam T,et al.Making choices in health:WHO guide to cost-effectiveness analysis[J].Revista Española De Salud Pública,2003,78(3):217-219.
[6]刘春秀,王卫军,傅朝阳,等.2010—2013年钦州市扩大HIV筛查工作的成本效益分析[J].广西医学,2015,37(3):368-371.
[7]初剑英.某三级甲等教学医院孕产妇住院费用及相关因素研究[C].“全国护理管理改革创新”高层论坛、全国护理新理论、新方法、新技术研讨会.北京,2011.
[8]黄美蓉.艾滋病的抗病毒治疗成本与我国的免费治疗现状[J].当代医学,2016,22(31):160-161.
[9]Fonner VA,Dalglish SL,Kennedy CE,et al.Effectiveness and safety of oral HIV pre-exposure prophylaxis for all populations[J].AIDS,2016,30(12):1973-1983.
[10]曾静好,陈江龙,叶肖容.2005—2010年住院新生儿死亡分析[J].中国当代医药,2011,18(22):149-150.
[11]Drake AL,Wagner A,Richardson B,et al.Incident HIV during pregnancy and postpartum and risk of mother-to-child HIV transmission:a systematic review and meta-analysis[J].PloS Med,2014,11(2):1001608.
[12]Read JS.Late Postnatal Transmission of HIV-1 in Breast-Fed Children:An Individual Patient Data Meta-Analysis[J].J Infe ct Dis,2004,189(12):2154-2166.
[13]Blencowe H,Cousens S,Oestergaard MZ,et al.National,regional,and worldwide estimates of preterm birth rates in the year 2010 with time trends since 1990 for selected countries:a systematic analysis and implications[J].Lancet,2012,379(9832):2162-2172.
[14]Lauer JA,Betrán AP,Victora CG,et al.Breastfeeding patterns and exposure to suboptimal breastfeeding among children in developing countries: review and analysis of nationally representative surveys[J].BMC Med,2004,2(1):26.
[15]Wedi CO,Kirtley S,Hopewell S,et al.Perinatal outcomes associated with maternal HIV infection:a systematic review and meta-analysis[J].Lancet HIV,2016,3(1):33-48.
[16]Chi BH,Vwalika B,Killam WP,et al.Implementation of the Zambia Electronic Perinatal Record System for comprehensive prenatal and delivery care[J].Int J Gynaecol Obstet,2011,113(2):131-136.
[17]Collaboration EFAI,Wandel S,Egger M,et al.Duration from seroconversion to eligibility for antiretroviral therapy and from ART eligibility to death in adult HIV-infected patients from low and middle-income countries:collaborative analysis of prospective studies[J].Sex Transm Infe ct,2008,84(1):31-36.
[18]Salomon JA,Vos T,Hogan DR,et al.Common values in assessing health outcomes from disease and injury:disability weights measurement study for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2129-2143.
[19]孙校金.全球2001—2010年公共卫生十大成就[J].中国疫苗和免疫,2012,18(3):283-285.

