Fe2+/Cu2+/H2O2类芬顿体系降解苯酚
武家玉, 李镇镇
(太原工业学院环境与安全工程系,山西 太原 030008)
研究了Fe2+/Cu2+/H2O2类芬顿体系的最佳比例以及苯酚的初始浓度、时间对降解苯酚的影响,使用异丙醇作为羟基自由基淬灭剂研究了芬顿体系降解苯酚的机理。结果表明,处理100 mL 100 mg/L的苯酚溶液时的最佳条件是H2O2(体积分数为30%)为1 mmol、硫酸亚铁为0.5 mmol、硫酸铜为0.3 mmol,反应时间达到60 min时,降解率可达到99%;机理研究部分验证了羟基自由基是降解苯酚的主要因素。
类芬顿体系;苯酚;过氧化氢;亚铁离子;铜离子;降解
引 言
在经济高速发展的时代,水资源的科学规划和可持续利用显得尤为必要[1]。在水资源的可持续利用中,环境污染是制约其发展的关键因素,主要表现为水污染程度[2]。工业废水和生活废水含有很多难降解的有机物,会逐步突破水生态系统的自净能力和承载力,因此,如何高效地去除有机物就成为当前的讨论热点。芬顿反应技术可以在较短的时间内生成羟基自由基并降解有机物,具有去除效率高、反应速度快且二次污染少的优点[3-4]。但也存在着很多不足:首先,H2O2的利用率不高,有机物降解不完全[5];其次,芬顿反应必须在极低的酸性条件下进行,而实际废水的酸度往往达不到要求,需要进行一定程度的酸化,这就造成了处理成本的增加。为了解决这些问题,光、电、微波以及零价铁、各种铁盐、铁金属氧化物和非铁芬顿催化剂等技术引入芬顿反应,形成类芬顿技术[6-7]。类芬顿技术作为一种新型的高级氧化技术备受研究者关注[8-11]。
本文以苯酚作为目标污染物,选择Fe2+/Cu2+/H2O2类芬顿体系对苯酚进行处理,研究其最佳降解条件以及机理。
1 实验部分
1.1 仪器与试剂
752型可见分光光度计,MP523 pH计等。
硫酸亚铁(FeSO4)、硫酸铜(CuSO4)、过氧化氢(H2O2,30%)、氢氧化钠(NaOH)、氯化铵(NH4Cl)、异丙醇、苯酚、铁氰化钾、4-氨基安替比林等均为分析纯;水为超纯水。
1.2 实验方法
在100 mL锥形瓶中加入超纯水,调节至所需的pH值,再加入一定量的硫酸亚铁和硫酸铜以及所需的反应物,最后迅速加入H2O2。一定反应时间后,取出一定量样品,加入甲醇中止反应。将样品使用4-氨基安替比林分光光度法进行测定。根据标准曲线方程计算降解前、后苯酚的浓度,计算苯酚的降解率。
2 结果与讨论
2.1 H2O2/Fe2+比例的确定
100 mL 100 mg/L的苯酚溶液,调节pH值为3.0,H2O2/Fe2+按照一定比例添加,结果如第22页图1所示。H2O2/Fe2+体系降解苯酚时呈现出先上升后下降的趋势,总体在摩尔比2∶1时达到最高的降解率。当Fe2+的浓度不断增加直到和H2O2的浓度相同时,Fe2+主要是促进H2O2的分解,产生羟基自由基,使苯酚得到降解;随着Fe2+的增多,会在溶液中生成铁泥,反而不利于苯酚的降解[12],故降解率有稍微的下降。因此,选定H2O2的投加量为1.0 mmol,Fe2+的投加量为0.5 mmol。

图1 H2O2/Fe2+摩尔比与苯酚降解率的关系图
2.2 类芬顿体系降解苯酚Cu2+投加量的确定
使用已确定的Fe2+/H2O2体系的比例和投加量,改变Cu2+投加量,结果见图2。从图2可以看出,当Cu2+的投加量为0.3 mmol时,苯酚的降解率最高;当反应时间达到40 min时,降解率可以达到90%以上。添加一定量的Cu2+能提高苯酚的降解率,这是因为,Cu2+催化了Fenton反应中·OH的产生,且Cu2+/Cu+能促进Fenton反应中的氧化还原反应,使得·OH循环[13]。当Cu2+的量继续增大,生成的一部分氧化自由基离子来不及与苯酚反应就发生了复合或者与H2O2淬灭,导致·OH的利用率降低,从而降低了苯酚降解率[14]。因此,最佳Cu2+的投加量为0.3 mmol。

图2 Cu2+投加量与苯酚降解率的关系图
2.3 类芬顿体系降解苯酚影响因素的研究
2.3.1 反应时间对降解苯酚的影响
100 mL 100 mg/L的苯酚溶液,调节pH值为3.0,然后加入Fe2+/Cu2+/H2O2体系,摇匀并静置,反应一段时间后,在不同时间取适量溶液进行苯酚含量的测定。反应时间与苯酚降解率的关系如图3所示。由图3可知,苯酚在10 min~60 min快速降解,60 min后降解变缓,降解率基本维持不变。在实际应用中,可以通过优化反应条件达到缩短反应时间的目的。在之后的反应中,我们选取反应时间为60 min。

图3 反应时间对降解苯酚的影响
2.3.2 苯酚初始浓度对降解苯酚的影响
改变苯酚初始浓度,探究苯酚初始浓度对降解苯酚的影响,结果如图4所示。从图4可以得出,当苯酚的初始质量浓度为100 mg/L时,Fe2+/Cu2+/H2O2体系对苯酚降解的效果较好,而且可以在较短时间内使降解率达到90%。当质量浓度高于100 mg/L时,降解率变低。这主要是因为,体系中产生的羟基自由基数量是有限的,当苯酚浓度增大时,不足以降解全部的苯酚,使得降解率降低。因此,苯酚最适初始质量浓度为100 mg/L。

图4 苯酚初始浓度对降解苯酚的影响
2.4 反应机理的研究
加入Fe2+/Cu2+/H2O2类芬顿体系后,苯酚的降解效果有一个明显的提高。为了确定在苯酚降解过程中确实是羟基自由基起了主导作用,选取异丙醇作为羟基自由基淬灭剂进行验证,结果如第23页图5所示。由图5可知,加入异丙醇后,苯酚降解率仅有20%且降解反应停止。这主要是因为,加入异丙醇后,异丙醇会淬灭羟基自由基,减少了羟基自由基和苯酚的反应。由此可以证明,在Fe2+/Cu2+/H2O2类芬顿体系降解苯酚的反应中,羟基自由基是反应的主导因素,并在一定程度上决定着反应速率。
3 结论
1) Fe2+/Cu2+/H2O2类芬顿体系中,Fe2+、Cu2+和H2O2的最佳投加摩尔比为5∶3∶10。
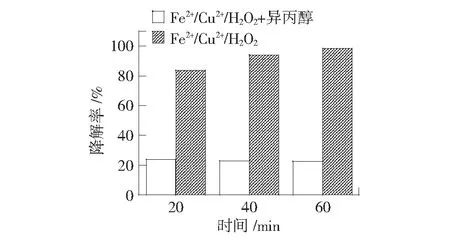
图5 反应机理的研究
2) 处理100 mL 100mg/L的苯酚溶液时的最佳条件是H2O2为1 mmol、硫酸亚铁为0.5 mmol、硫酸铜为0.3 mmol,反应时间达到60 min时,降解率可达到99%。
3) 在Fe2+/Cu2+/H2O2类芬顿体系降解苯酚的反应中,对反应起主导作用的因素是羟基自由基。
[1] 张建云,贺瑞敏,齐晶,等.关于中国北方水资源问题的再认识[J].水科学进展,2015,24(3):303-310.
[2] 刘毅,贾若祥,侯晓丽.中国区域水资源可持续利用及类型划分[J].环境科学,2015,26(1):42-46.
[3] 赵吉,杨晶晶,马军.Cu2+和Mn2+对Fe(Ⅱ)/H2O2及Fe(Ⅲ)/H2O2体系氧化苯酚的影响[J].黑龙江大学自然科学学报,2013(6):787-793,801.
[4] 陈丽玮,马军,李旭春,等.一种新型的类芬顿体系对苯
甲酸的降解效果研究(英文)[J].黑龙江大学自然科学学报,2012(1):110-116.
[5] 孙秀君.超声波预处理含酚废水技术研究[J].应用化工,2016(1):190-191,194.
[6] 张德莉,黄应平,罗光富,等.Fenton及Photo-Fenton反应研究进展[J].环境化学,2006(2):121-127.
[7] 郭幸斐,王姚武,张宏伟,等.类芬顿试剂对亚甲基蓝的降解研究[J].环境科学与技术,2016(5):38-41.
[8] 杨文焕,王超慧,高乃云,等.环丙沙星在水中的高级氧化去除方法研究进展[J].应用化工,2016(10):1959-1964,1968.
[9] 张潇逸,何青春,蒋进元,等.类芬顿处理技术研究进展综述[J].环境科学与管理,2015(6):58-61.
[10]张剑桥,迟惠中,宋阳,等.Ce3+与Cu2+协同强化芬顿体系氧化苯酚的效能与机制研究[J].环境科学,2016(8):3067-3072.
[11]徐夫元,宋天顺,陈英文,等.Cu(Ⅱ)-Fe(Ⅱ)-H2O2协同催化氧化降解甲基橙[J].中南大学学报(自然科学版),2007(3):480-485.
[12]楚文海,高乃云,赵世嘏,等.Fe/Cu催化还原去除饮用水消毒副产物三氯乙酸[J].同济大学学报(自然科学版),2009(10):1355-1359.
[13]周午阳,张朝升,孙志民,等.Cu2+助芬顿法处理高浓度邻苯二甲酸二甲酯废水[J].环境工程学报,2014(7):2789-2794.
[14]马莹莹,吴跃辉,李锦卫,等.镀铜废水中Cu2+-H2O2体系氧化降解硝基苯[J].环境工程学报,2016(9):4775-4782.

