克百威人工抗原合成及其免疫应用
孙凤霞,康立超,庞芳琴,刑丽杰,罗瑞峰,罗小玲,彭夏雨
(省部共建绵羊遗传改良与健康养殖国家重点实验室 / 新疆农垦科学院 分析测试中心,新疆 石河子 832000)
克百威(Carbofuran, CBF),化学名为2,3-二氢-2,2-二甲基-7-苯并呋喃基-N-甲基氨基甲酸酯,商品名为呋喃丹,是一种广谱高效的氨基甲酸酯类农药,主要用于农业生产中多种农作物害虫的防治。克百威可以和胆碱酯酶发生不可逆结合,造成乙酰胆碱不能分解而蓄积在体内,影响神经中枢传导,具有神经毒性和胃毒。克百威在酸性土壤中不易降解,残留期长,可被植物根部吸收并输送到植物体的各器官,主要积蓄在植物叶部;也可能通过径流渗透污染地下水源,给食品安全和环境带来潜在威胁[1-3]。目前,农业部已禁止将克百威用于蔬菜、果树、茶叶和中草药材的生产种植,但仍有不少违法使用现象时有发生,导致克百威残留在果蔬等产品中。因此,在持续加大使用监管力度和完善监管体系的同时,加强克百威残留检测技术研究十分必要。
目前克百威的检测多采用仪器分析法[4-6],需要昂贵的仪器设备和专业技术人员,对检材要求较高,样品前处理和提纯过程费时费力,不能满足现代检测对方便、快速、准确的要求。电化学传感器法具有灵敏度高、选择性好和检测时间短的特点,在克百威残留检测上也得到一定的应用[7-8],但该方法检测样本数量单一,难以实现高通量检测,不能满足现场检测和大批量样品筛选需求。免疫分析法操作简便,对样本要求不高,可实现现场快速检测,是21世纪最有竞争力的分析方法,已被应用于克百威残留检测[9-15]。
农药免疫分析的关键是制备高特异性的抗体,包括半抗原设计、人工抗原合成及抗体制备,而半抗原的设计与合成是农药免疫分析的前提、基础和关键。做为典型的小分子化合物,克百威本身不具有免疫原性,同时其结构中不含有可直接偶联的功能基团,需要进行半抗原衍生化或者人工合成。Abad等[9]设计合成4种克百威半抗原(表1),根据抗体制备和免疫分析结果,确定免疫效果最好的克百威半抗原为4-[〔(2,3-二氢-2,2-二甲基-7-苯并呋喃基氧)羰基〕氨基]丁酸(BFNB)。因而在此后的克百威免疫分析中,多选用BFNB作为免疫半抗原,但其合成方法普遍采用传统的三光气合成工艺,需要使用大量光气和甲苯,极易危害健康,造成环境污染。因此,本研究以克百威水解产物呋喃酚为起始原料,设计新型合成方法制备半抗原BFNB并对其结构进行鉴定,利用活性酯法制备人工抗原,免疫小鼠获得特异性识别克百威的多克隆抗体,为建立克百威免疫检测方法和保障农产品安全提供物质基础。

表1 克百威4种半抗原的结构Table 1 The chemical structures of four haptens
1 材料与方法
1.1 试验材料与试剂
1.1.1 试验动物 4只SPF级BALB/c小鼠(雌性,6~8周龄)购自新疆疾病预防控制中心。
1.1.2 主要试剂 克百威标准品购自农业部环境质量监督检验测试中心(天津);呋喃酚(纯度99%)、二(对硝基苯)碳酸酯(纯度≥99%)、4-氨基丁酸甲酯(纯度≥99%)、三氟醋酸(纯度≥99.8%)、三乙胺(纯度≥99%)、N-羟基琥珀酰亚胺(NHS,纯度98%)、N,N-二环己基碳二亚胺(DCC,纯度≥99%)、牛血清白蛋白(BSA,纯度≥98%)、弗氏完全佐剂和不完全佐剂等均购自Sigma公司;辣根过氧化物酶标记的羊抗鼠二抗(HRP-IgG)为Jackson公司产品;Bradford蛋白浓度测定试剂盒(去垢剂兼容型)购自上海碧云天生物技术有限公司;二氧六环、乙酸乙酯、二氯甲烷、N,N-二甲基甲酰胺(DMF),均购自国药集团上海化学试剂总公司;试验用水为Millipore超纯水;上述试剂若无特别注明均为分析纯。
1.2 试验方法
1.2.1 克百威半抗原BFNB的合成及纯化 取一四口烧瓶置于恒温磁力搅拌器(上海沪西分析仪器厂)上,配置温度计。称取1.64 g呋喃酚溶解于50 mL 二氯甲烷(DCM)中,冰浴下加入1.11 g三乙胺(Et3N)。搅拌10 min后,将3.04 g二(对硝基苯)碳酸酯溶于15 mL二氯甲烷中,缓慢滴加到上述反应体系中,缓慢升温至室温,继续搅拌反应1 h,TLC板监控反应完成,展开剂为V(石油醚)∶V(乙酸乙酯)=10∶1,此为溶液A;称取1.697 g经三乙胺碱化的4-氨基丁酸甲酯盐酸盐溶于10 mL二氯甲烷中,在冰浴下滴加到A液中,将温度升到室温并继续搅拌过夜;用水、饱和食盐水依次洗涤并用无水硫酸钠干燥,滤液真空旋干后用硅胶柱层析纯化,得到半抗原中间体B,收率为58%;将B溶于15 mL 1,4-二氧六环溶液中,加入18 mL三氟醋酸和15 mL水,60 ℃反应4 h后冷却至室温;反应液用乙酸乙酯萃取后,依次用水、饱和碳酸氢钠、水、饱和食盐水进行洗涤,用无水硫酸钠干燥,滤液真空旋干后用硅胶柱层析纯化后即可得到克百威半抗原BFNB,洗脱剂为V(石油醚)∶V(乙酸乙酯)=5∶1,收率为42%,合成路线见图1。
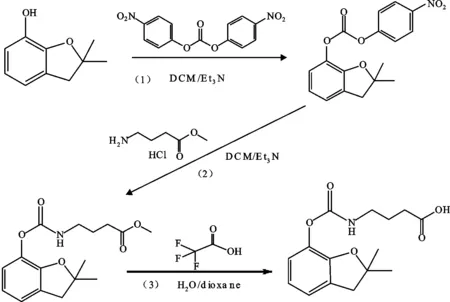
图1 克百威半抗原BFNB合成路线Fig.1 Synthetic route of hapten BFNB
1.2.2 克百威半抗原BFNB的鉴定 将纯化后的克百威半抗原BFNB采用核磁共振仪和LC-MS2进行分子结构鉴定,以确定半抗原是否合成成功。
1.2.3 克百威人工抗原的合成 免疫原(BFNB-BSA)采用活性酯法进行合成,控制半抗原BFNB与载体蛋白BSA的反应摩尔比为80∶1,称取29.3 mg半抗原BFNB、13.8 mg NHS溶于1 mL无水DMF中,待其充分溶解完全后加入24.3 mg DCC,室温搅拌反应过夜;离心去沉淀,收集上清,此为A液;称取BSA 83 mg溶解在5 mL 0.01 mol/L PBS溶液中,为B液;在冰水浴中,将A液逐滴滴加到B液中,4 ℃搅拌过夜。反应混合液用PBS缓冲液透析3 d,6~8 h换液1次,离心取上清,分装于0.5 mL离心管中, 20°C保藏,标记为BFNB-BSA,合成路线见图2。
包被原(BFNB-OVA)在合成中将载体蛋白更改为卵清蛋白(OVA),控制半抗原BFNB与OVA的反应摩尔比为40∶1,其余步骤与免疫原的合成相同。

图2 克百威人工抗原的合成路线Fig.2 Synthetic route of CBF complete antigen
1.2.4 克百威人工抗原的鉴定 采用紫外扫描光谱法对克百威人工抗原进行鉴定,并计算半抗原BFNB和载体蛋白的偶联比,半抗原、人工抗原和载体蛋白用PBS缓冲液稀释后,分别在波长200~400 nm进行全波长扫描,根据紫外扫描光谱的叠加情况判断半抗原和载体蛋白是否偶联成功,并根据半抗原特征吸收波长处的吸光度计算半抗原BFNB和载体蛋白的偶联比[16],公式为:
偶联比=(ε偶联物-ε蛋白)/ε半抗原
式中:ε为在半抗原特征吸收波长 278 nm处的摩尔吸光系数。
1.2.5 抗克百威多克隆抗体的制备 将制备的BFNB-BSA做为免疫原免疫BALB/c小鼠,免疫程序和方法参照文献[17]。首次免疫采用弗氏完全佐剂乳化抗原,背部皮下多点免疫,免疫剂量为每只100 μg。加强免疫采用弗氏不完全佐剂乳化抗原,免疫剂量为每只75 μg。第4次免疫7 d后断尾采血,分离血清测定效价。将BFNB-OVA作为包被抗原,利用方阵法确定最佳的抗原抗体工作浓度,用间接竞争酶联免疫法(ELISA)对血清进行灵敏度测定[18]。
2 结果与分析
2.1 半抗原BFNB的结构分析与鉴定
呋喃酚分子质量为164,4-氨基丁酸甲酯分子质量为169,衍生产物BFNB分子质量为293。由图3可知,在多反应监测模式(MRM)下半抗原BFNB的保留时间为0.92 min,母离子为294.3,其为M+1;对母离子进行能量碰撞,产生165.1的碎片离子,分析165.1是半抗原BFNB的氨基甲酸酯键发生断裂,产生的呋喃酚碎片;当碰撞能量继续提高,呋喃环上的C-O键和C-C键发生断裂,产生了123.1的碎片离子,据此可以推断半抗原BFNB合成成功。

图3 克百威半抗原BFNB的质谱图Fig.3 The MS spectrum of hapten BFNB
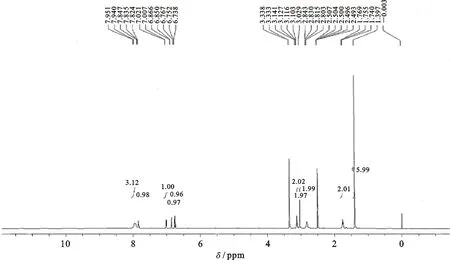
图4 克百威半抗原BFNB的H谱Fig.4 1H NMR of CBF haptens BFNB
半抗原BFNB经1H NMR (500 MHz, CDCl3)测定,鉴定其分子结构(图4),其1H NMR为:δ为6.97 (d, J = 7.0 Hz, 1H), 6.93 (d, J = 8.0 Hz, 1H), 6.78 (t, J = 7.0 Hz, 8.0 Hz, 1H), 5.24 (br, 1H), 3.34 (m, 2H), 3.03 (s, 2H), 2.46 (t, J = 7.0 Hz, 2H), 1.91 (m, 2H), 1.49 (s, 6H),所得结构信息与化合物BFNB的结构信息相同,从而确定该化合物为目标半抗原BFNB。
2.2 克百威人工抗原的紫外扫描鉴定
紫外光谱结果如图5所示,半抗原BFNB和载体蛋白BSA的最大特征吸收均在278 nm,在同样浓度下,BFNB-BSA偶联物相比BSA的最大特征吸收峰的强度发生了明显增强,呈现一定的光谱叠加趋势。另外,BFNB在245 nm处为特征峰间谷点,BSA在252 nm处为特征峰间谷点,而偶联物BFNB-BSA的特征峰间谷点在250 nm处,介于BFNB和BSA的峰间谷点之间,发生了偏移,说明偶联物中形成了新的化合物结构,证明人工抗原BFNB-BSA偶联成功。根据计算得到人工抗原BFNB-BSA的偶联比约为17∶1,同法计算包被原BFNB-OVA的偶联比约为8∶1。
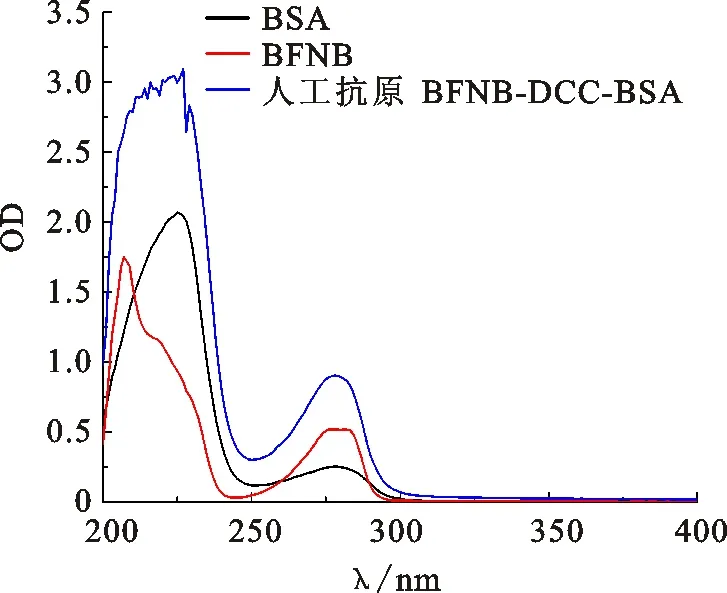
图5 人工抗原BFNB-BSA的紫外扫描图Fig.5 Ultraviolet spectrum of the antigen BFNB-BSA
2.3 多克隆抗体的鉴定结果
2.3.1 多克隆抗体效价测定 采用间接ELISA法对4免抗血清进行效价测定,当包被原BFNB-OVA包被质量浓度为0.5 μg/mL时,4种抗血清效价均达到1∶9 000以上,其中2号小鼠血清效价达到1∶27 000,说明制备的免疫原具有良好的免疫原性,所制备的包被原也可以很好的用于免疫检测。
2.3.2 多克隆抗体灵敏度测定 经方阵法确定包被原最佳包被质量浓度为0.5 μg/mL,抗血清最佳工作稀释倍数为8 000倍。采用间接竞争ELISA法对抗血清进行灵敏度测定,以克百威质量浓度的对数值为横坐标,OD450的吸光值为纵坐标,通过四参数回归方程拟合曲线,得到竞争抑制曲线(图6),定量检测线性(IC20~IC80)为0.023~0.403 μg/mL,半数抑制浓度(IC50)为0.096 μg/mL。

图6 抗体的间接竞争ELISA抑制曲线Fig.6 Standard inhibition curve of polyclonal antiserum detected by icELISA
3 讨 论
免疫分析法是以抗体对抗原的特异性识别作用为基础的分析方法,免疫检测已被应用于农产品中多种农药残留检测[19]。抗体是所有免疫检测方法的关键试剂,对于小分子农药而言,其半抗原设计、筛选和合成是制备抗体的关键环节。克百威的半抗原主要根据Abad等[9]筛选的4种半抗原,其中免疫效果最好的抗体来源于半抗原BFNP和BFNB,半抗原合成方法普遍采用传统的三光气法,如杨金易等[20]采用光气合成法合成BFNB作为半抗原,成功制备了高亲和力的抗克百威单克隆抗体,并建立相应的免疫分析方法。朱国念等[21]和Zhu等[22]利用光气法合成半抗原BFNB、BFNH和BFNP。 由于三光气合成法中需要使用大量有机溶剂甲苯和光气,危害操作人员身体健康,造成二次环境污染,研究者们开始寻找克百威半抗原新的合成方法,如朱德锐[23]以克百威、对硝基苯氯甲酸酯、6-氨基己酸为反应原料,开辟克百威半抗原BFNH新的合成方法,避免传统三光气合成法的危害。本研究以克百威水解产物呋喃酚为起始原料,首先与二(对硝基苯)碳酸酯和4-氨基丁酸甲酯盐酸盐反应生成中间体,再和三氟醋酸反应合成半抗原BFNB,经质谱和核磁共振测定半抗原BFNB合成成功,同时合成步骤简洁有效,得率高,避免传统三光气合成方法中大量使用光气和甲苯的危害性,为克百威半抗原提供了新的合成方法。
人工抗原的结构决定抗体对目标抗原的亲和力、选择性和灵敏度,直接影响免疫分析方法的结果。人工抗原的鉴定主要采用紫外光谱法和蛋白电泳法[24],其中紫外光谱法可以同时计算偶联比,且操作简单快捷,被广泛使用。人工抗原的偶联比即半抗原与载体蛋白的最佳分子结合比对抗体的产生和质量有着重要影响。关于最佳偶联比,不同研究者的结果有所不同。通常认为半抗原分子与载体蛋白的偶联比在5∶1~25∶1最佳[25]。对于克百威半抗原BFNB,杨金易等[20]和朱国念等[21]分别通过活性酯法制备完全抗原BFNB-BSA,其偶联比均为13∶1;本研究制备的克百威免疫原的偶联比约为17∶1,处于适宜范围内。
同时,动物免疫试验结果进一步证明克百威人工抗原合成成功,所获得的鼠源抗克百威多克隆抗体的IC50值为0.096 μg/mL,线性(IC20~IC80)为0.023~0.403 μg/mL。研究所制备的克百威半抗原为进一步制备抗克百威高特异性单克隆抗体和建立克百威免疫分析方法奠定了物质基础。
Reference:
[1] CAMPBELL S,DAVID M D,WOODWARD L A,etal.Persistence of carbofuran in marine sand and water [J].Chemosphere,2004,54(8):1155-1161.
[2] MOREIRA R A,MANSANO A D S,ROCHA O.The toxicity of carbofuran to the freshwater rotifer,Philodinaroseola[J].Ecotoxicology,2015,24(3):604-615.
[3] GBADEGESIN M A,OWUMI S E,AKINSEYE V,etal.Evaluation of hepatotoxicity and clastogenicity of carbofuran in male Wistar rats [J].Food&ChemicalToxicology,2014,65(1):115-119.
[4] KHODADOUST S,TALEBIANPOOR M S,GHAEDI M,etal.Application of an optimized dispersive nanomaterial ultrasound-assisted microextraction method for preconcentration of carbofuran and propoxur and their determination by high-performance liquid chromatography with UV detection [J].JournalofSeparationScience,2014,37(21):3117-3124.
[5] 张 璇,姜 敏,刘 峰,等.高效液相色谱-质谱联用仪检测苹果中的丁硫克百威和克百威的残留量 [J].农药科学与管理,2015,36(6):44-48.
ZHANG X,JIANG M,LIU F,etal.Determination of carbofuran and carbosulfan residues in apples by high performance liquid chromatography-mass spectrometry [J].PesticideScienceandAdministration,2015,36(6):44-48.
[6] 罗俊凯,龚道新,丁春霞,等.气相色谱-质谱法测定烟叶和土壤中丁硫克百威及其代谢产物的残留[J].农药学学报,2014,16(1):66-71.
LUO J K,GONG D X,DING CH X,etal.Determination of carbosulfan and its metabolites residues in tobacco leaf and soil by gas chromatography-mass spectrometry [J].ChineseJournalofPesticideScience,2014,16(1):66-71.
[7] TAN X C,HU Q,WU J W,etal.Electrochemical sensor based on molecularly imprinted polymerreduced graphene oxide and gold nanoparticles modified electrodefor detection of carbofuran [J].SensorsandActuatorsB:Chemical,2015,220(16):216-221.
[8] GRAWE G F,DE OLIVEIRA T R,DE A N E,etal.Electrochemical biosensor for carbofuran pesticide based on esterases fromEupenicilliumsheariiFREI-39 endophytic fungus [J].BiosensorsandBioelectronics,2015,63(1):407-413.
[9] ABAD A,MORENO M J,MONTOYA A.Development of monoclonal antibody-based immunoassays to the N-methylcarbamate pesticide carbofuran [J].JournalofAgriculturalandFoodChemistry,1999,47(6):2475-2485.
[10] DAI Y P,WANG T,HU X Y,etal.Highly sensitive microcantilever-based immunosensor for the detection of carbofuran in soil and vegetable samples [J].FoodChemistry,2017,229(16):432-438.
[11] LIU L,XU D,HU Y Y,etal.Construction of an impedimetric immunosensor for label-free detecting carbofuran residual in agricultural and environmental samples [J].FoodControl,2015,53(7):72-80.
[12] ZHU Y,CAO Y Y,SUN X,etal.Amperometric immunosensor for carbofuran detection based on MWCNTs/GS-PEI-Au and AuNPs-antibody conjugate [J].Sensors,2013,13(4):5286-5301.
[13] YANG J Y,ZHANG Y,WANG H,etal.Development of fluorescence polarisation immunoassay for carbofuran in food and environmental water samples [J].Food&AgriculturalImmunology,2014,26(3):340-355.
[14] GUO Y R,LIU S Y,GUI W J,etal.Gold immunochromatographic assay for simultaneous detection of carbofuran and triazophos in water samples [J].AnalyticalBiochemistry,2009,389(1):32-39.
[15] 金仁耀,朱国念.基于双特异性单克隆抗体的克百威和三唑磷多残留ELISA分析方法研究及在环境样品中应用 [J].核农学报,2013,27(4):515-522.
JIN R Y,ZHU G N.Development of a multi-residue enzyme-linked immunoassay based on bispecific bonoclonal antibody for carbufuran and triazophos and its environmental application [J].JournalofNuclearAgriculturalSciences,2013,27(4):515-522.
[16] 袁 媛.糖皮质激素多残留免疫研究与量子点在免疫分析中的应用 [D].江苏无锡:江南大学,2009.
YUAN Y.Determination of corticosteroids multi-residues and application of quantum dots in immunoassay [D].Wuxi Jiangsu:Jiangnan University,2009.
[17] SUN F X,LIU L Q,KUANG H,etal.Development of ELISA for melamine detection in milk powder [J].FoodandAgriculturalImmunology,2013,24(1):79-86.
[18] KONG N,SONG S S,PENG J,etal.Sensitive,fast,and specific immunoassays for methyltestosterone detection [J].Sensors,2015,15(5):10059-10073.
[19] 王玲玲,职爱民,胡骁飞,等.百菌清人工抗原的合成及多克隆抗血清的制备 [J].西北农业学报,2012,21(9):19-23.
WANG L L,ZHI A M,HU X F,etal.Synthesis of chlorothalonil artificial antigen and development of its mice polyclonal antiserum [J].ActaAgriculturaeBoreali-occidentatisSinica,2012,21(9):19-23.
[20] 杨金易,吴 青,王 弘,等.高亲和力的农药克百威单克隆抗体的制备及鉴定 [J].中国农业科学,2007,40(3):518-523.
YANG J Y,WU Q,WANG H,etal.Production and identification of high affinity monoclonal antibodies against pesticide carbofuran [J].ScientiaAgriculturaSinica,2007,40(3):518-523.
[21] 朱国念,吴银良,程敬丽.克百威人工抗原的合成与鉴定 [J].浙江大学学报(农业与生命科学版),2002,28(1):47-53.
ZHU G N,WU Y L,CHENG J L.Synthesis and identification of the antigens for carbofuran [J].JournalofZhejiangUniversity(Agriculture&LifeSciences),2002,28(1):47-53.
[22] ZHU G N,JIN M J,GUI W J,etal.Development of a direct competitive enzyme-linked immunoassay for carbofuran in vegetables [J].FoodChemistry,2008,107(4):1737-1742.
[23] 朱德锐.呋喃丹半抗原合成与多克隆抗体制备及其检测应用 [D].武汉:华中师范大学,2008.
ZHU D R.Design and synthesis the hapten molecular of carbofuran and the preparation of polyclonal antibody for the application on testing [D].Wuhan:Central China Normal University,2008.
[24] 胡骁飞,邓 歌,柴书军,等.玉米赤霉醇完全抗原的制备及质量鉴定 [J].西北农业学报,2016,25(5):637-645.
HU X F,DENG G,CHAI SH J,etal.Preparation and quality identification of complete antigen of zeranol[J].ActaAgriculturaeBoreali-occidentatisSinica,2016,25(5):637-645.
[25] EILANGE B F.The preparation of antigenic hapten-carrier conjugates:a survey [J].MethodsinEnzymology,1980,70(A):85-104.

