高生物量富硒产朊假丝酵母培养基优化
李俊杰,管轶男,管 斌*,孔 青
(1.中国海洋大学 食品科学与工程学院,山东 青岛 266003;2.青岛蔚蓝生物股份有限公司,山东 青岛 266101)
硒是人体必需的微量元素之一,对机体至关重要。其保护机体免受自由基的损伤,参与重金属解毒,调控机体免疫系统[1],是生物体内谷胱甘肽过氧化物酶、硫氧还蛋白还原酶、碘化甲腺原氨酸脱碘酶等多种蛋白的重要组成部分[2]。机体可以摄入无机硒和有机硒进行补硒,其中有机硒化合物生物利用率高,毒性较小。酵母在培养过程中可以通过自身的代谢活动,将无机硒与体内大分子结合转化为有机形式,主要以硒代氨基酸和含硒蛋白形式存在[3]。富硒酵母由于富含蛋白质和B族维生素、食用安全性强以及生物利用率高等优点而成为缺硒人群的膳食补充剂[4]。酵母对硒的富集受菌种、培养基的成分及硒浓度的影响[2]。目前常用的富硒酵母菌株有:酿酒酵母(Saccharomyces cerevisiae)和产朊假丝酵母(Candida utilis)[4-6]。C.utilis可以在胞内大量积累谷胱甘肽(glutathione,GSH),作为美国食品药品监督管理局评价食品添加剂安全性指标(generally regarded as safe,GRAS)微生物,应用前景广阔[7]。高生物量是酵母富硒研究的基础,但目前,常用的培养基加硒后酵母生长会受到明显的抑制,不利于无机硒的生物转化。常见培养基的优化多集中在酿酒酵母上,对C.utilis培养基优化的研究较少[8-9]。因此本试验从富含GSH的C.utilis菌株出发,运用Plackett-Burman设计和响应面法对培养基组成进行优化,以期为提高菌株性能,实现工业化生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
产朊假丝酵母(Candida utilis)2.0281:中科院微生物保藏中心,按照参考文献[10]的方法高效选育得到菌株U-16。
1.1.2 试剂
葡萄糖、蛋白胨、酵母粉、变色酸、盐酸苯肼、氯酸钾(分析纯或生化试试):国药集团化学试剂有限公司;谷胱甘肽标准品(≥98%):美国Sigma公司;庚烷磺酸钠、甲醇(均为色谱纯):百灵威科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YPD)(种子培养基):葡萄糖2%,蛋白胨2%,酵母粉1%。斜面培养基:在种子培养基中加入2%琼脂。
酵母浸出粉胨蔗糖(yeast extract peptone sucrose,YPS)培养基:蔗糖5%,蛋白胨2%,酵母粉1%。
普通培养基:按照参考文献[11]配制。
G培养基:按照参考文献[12]配制。
G改良培养基:葡萄糖30 g/L,蛋白胨10 g/L,(NH4)2SO46 g/L,KH2PO43 g/L,肌醇 3 mg/L,MgSO42.4 g/L,FeSO4·7H2O0.01g/L,ZnSO4·7H2O0.12g/L,MnSO4·6H2O 0.024g/L,CuSO4·5H2O0.006g/L,维生素B61.2mg/L,生物素0.06mg/L。
S培养基:按照参考文献[9]配制。
以上培养基pH均为6.0,发酵12 h加入亚硒酸钠(滤膜过滤除菌)[11]。
1.2 仪器与设备
Agilent 1100高效液相色谱仪(high performance liquid chromatography,HPLC):上海荆和分析仪器有限公司;TGL-16C离心机:上海安亭科学仪器厂;722N型可见分光光度计:上海精科电子有限公司;HZQ-X100型振荡培养箱:东联电子技术开发有限公司;ZDX-35BI型高压蒸汽灭菌锅:上海申安医疗器械厂。
1.3 方法
1.3.1 培养方法
种子培养:接种一环菌株U-16至种子培养基中,于28℃、200 r/min培养20 h。
发酵培养:接入10%的种子液(出芽率>20%,死亡率<1%,细胞数>106个/mL),30 ℃、200 r/min培养48 h[10]。
菌株保藏:4℃斜面保藏。
1.3.2 不同发酵培养基对产朊假丝酵母性能的影响
将种子液接种于上述6种不同的发酵培养基,发酵12 h加入25 μg/mL亚硒酸钠[13],培养48 h,测定酵母的生物量、有机硒和GSH含量。
1.3.3 发酵培养基响应面优化
釆用PB设计法对G改良发酵培养基的12个因子进行筛选,选取G改良培养基中的各因子含量为0水平,试验设计及数据分析采用Design-expert8.0软件,每组设计共3组重复试验,结果取平均值。12个考察因素及其编码水平见表1。
由PB筛选试验确定影响富硒酵母生长的关键因子,之后考虑各因素效应大小,确定下一步试验水平的中心点及各个水平参数。

表1 响应面优化试验因素与水平Table 1 Factors and levels of response surface experiments
1.3.4 亚硒酸钠添加量对酵母生长的影响
培养基中硒含量过高,会对酵母生长产生抑制[4、11、14]。为确定酵母生长的最适硒添加量,在培养基优化的基础上,进一步探究了亚硒酸钠添加量(15 μg/mL、20 μg/mL、25 μg/mL、30 μg/mL、35 μg/mL、40 μg/mL)对酵母生长的影响。
1.3.5 测定方法
菌体干质量(dry cell mass,DCM):菌液6 000 r/min离心5 min,洗涤菌体,烘干至质量恒定。
GSH测定:采用高效液相色谱法[15]。
胞内有机硒检测方法:胞内总硒和胞内无机硒的测定方法参照文献[11]。胞内有机硒=胞内总硒-胞内无机硒。
2 结果与分析
2.1 不同发酵培养基对富硒产朊假丝酵母生物量的影响
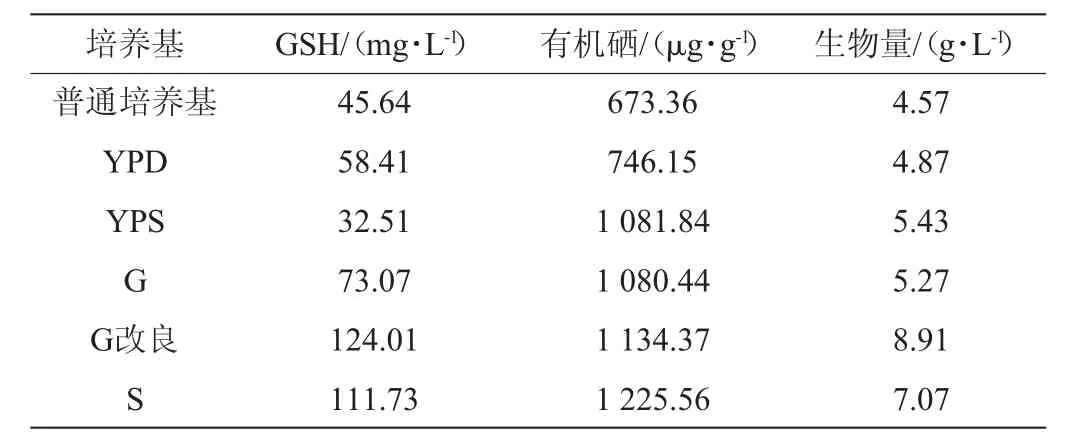
表2 不同发酵培养基对富硒产朊假丝酵母生长的影响Table 2 Effects of different fermentation mediums on the growth of selenium-enrichedC.utilis
由表2可知,酵母在G改良培养基中生长最好,硒转化率高,生物量为8.91 g/L,有机硒含量为1 134.37 μg/g,GSH含量为124.01 mg/L;在S培养基中富硒效果较好,有机硒为1 225.56 μg/g,生物量较低7.07 g/L。综合考虑选择G改良配培养基进一步试验。
2.2 高生物量富硒产朊假丝酵母发酵培养基关键因子的确定
以G改良培养基为基础培养基。采用二水平PB试验设计对培养基各组分进行优化,试验设计与结果如表3所示。

表3 Plackett-Burman试验设计方案及试验响应值Table 3 Design and response values of Plackett-Burman experiments
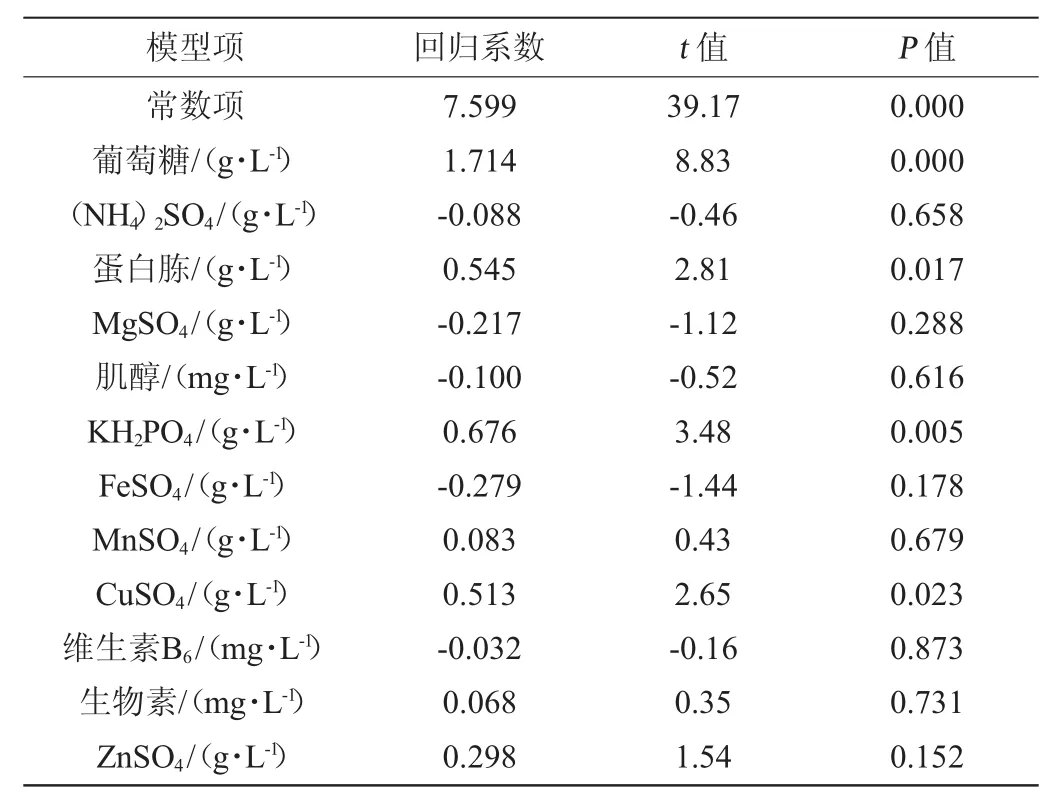
表4 富硒产朊假丝酵母生物量回归方程系数显著性检验Table 4 Regression coefficient and their significance for biomass ofselenium-enrichedC.utilis
由表3、表4可知,试验选取的12个因素中4个因素达到显著性影响水平,显著程度由高到低依次为葡萄糖(P<0.000 1),KH2PO4(P=0.005),蛋白胨(P=0.017),CuSO4(P=0.023),其余各因素不显著(P>0.05),因此选择这4个因素进行后续试验。各因素对酵母的生长影响不同,葡萄糖、蛋白胨、KH2PO4、MnSO4、CuSO4、肌醇、ZnSO4与酵母的生长呈正相关,促进酵母生长,Box-Behnken(BB)试验时应提高水平;其余与酵母生长负相关,下一步应降低水平。酵母体内存在两种硒转运方式——高硒亲和系统和低硒亲和系统;两种转运通道都离不开葡萄糖的作用,葡萄糖可以促进细胞对硒的吸收[16],但葡萄糖含量过高时,培养基渗透压太大会造成微生物会脱水、脱离正常生理状态,因此BB试验时保持葡萄糖含量水平不变。蛋白胨是含有一些维生素和糖类的有机氮化合物,对菌体生长影响较大,可以促进产朊假丝酵母的生长和对硒的富集[17]。磷、K+是构成菌体核酸、辅酶、酶的激活剂,直接或间接影响着酵母细胞的生长和代谢。磷酸根离子影响啤酒酵母对硒的积累,KH2PO4有利于酵母对硒的吸收[18]。Cu2+是多种氧化酶的活性中心,适当的Cu2+可以促进酵母细胞的生长[19]。
2.3 响应曲面法优化富硒产朊假丝酵母生长工艺
2.3.1 预测模型的建立及回归分析检验
根据PB试验结果,采用Box-Behnken试验,以富硒酵母生物量(R1)为响应值,显著影响因子的不同水平为自变量,进行优化,每个自变量低、中、高水平分别为-1、0、1,试验因素水平及编码如表5所示,试验结果响应值见表6,方差分析见表7。

表5 Box-Behnken设计试验因素与水平Table 5 Factors and levels of Box-Behnken experiments
以生物量(R1)为响应值进行二元回归拟合,获得酵母生物量预测值对编码自变量葡萄糖、蛋白胨、KH2PO4、CuSO4的二次多项回归方程:
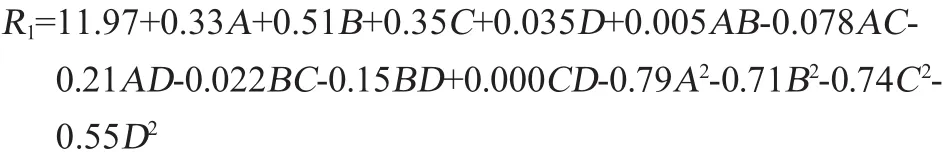
由表7模型的方差分析可知,试验所采用的二次项模型具有显著性(P<0.000 1);失拟项(P=0.148 3>0.05)不显著。其中校正决定系数R2adj=0.981 8,说明该模型拟合效果较好,该方程中的因变量与4个自变量之间线性关系显著,方程可以用来解释98.18%的变异,总变异中仅1.82%不能由该模型解释。因此可以选用该回归方程进行相应的预测。

表6 Box-Behnken试验设计及结果Table 6 Design and results of Box-Behnken experiments
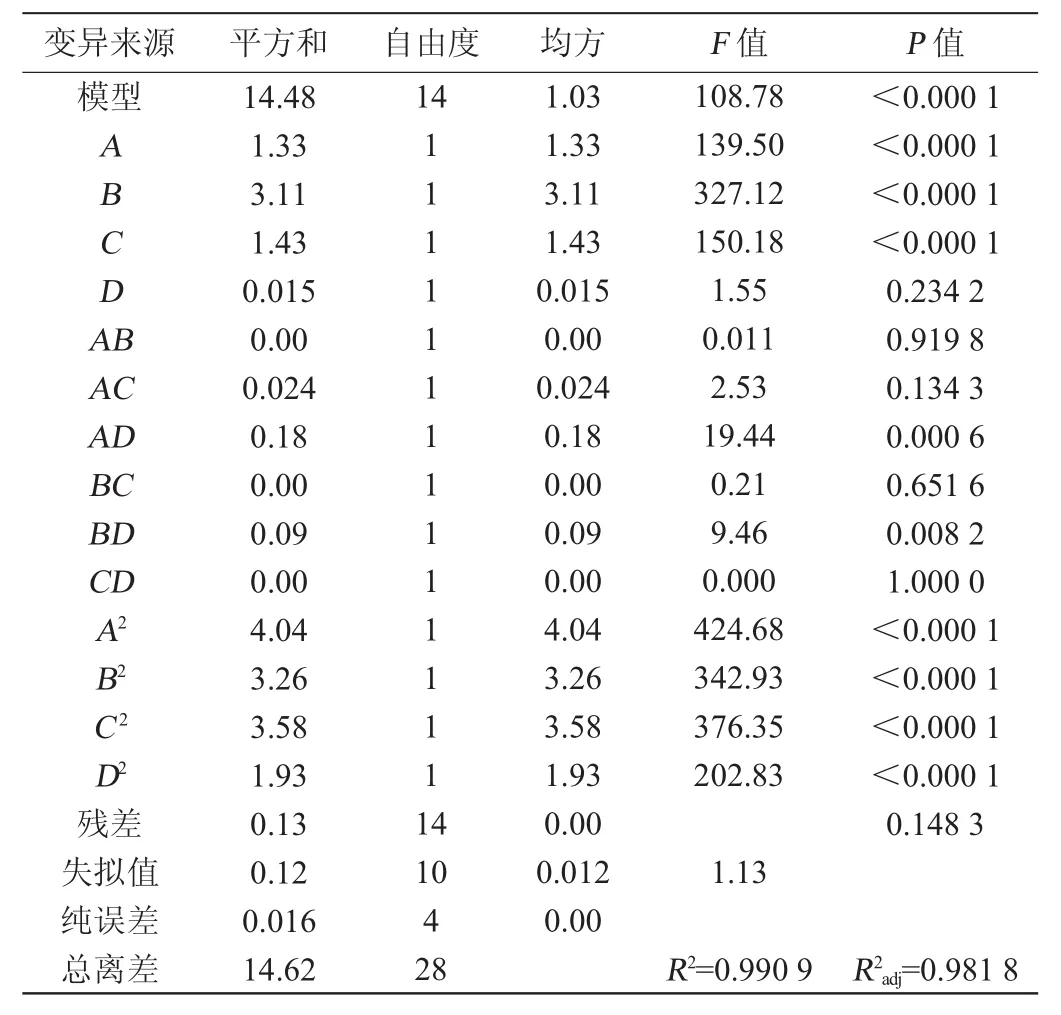
表7 回归方程方差分析及其显著性检验Table 7 Variance analysis and significance testing of regression equation
对方程的回归系数进行显著性检验(表7)表明,一次项中A、B、C(P<0.05),说明葡萄糖、蛋白胨、KH2PO4对富硒酵母生长影响显著,D项(P>0.05)影响不显著。交互项AD、BD(P<0.05),表明葡萄糖和CuSO4,蛋白胨和CuSO4的交互作用对酵母生长影响显著,其他交互项影响不显著。二次项A2、B2、C2、D2(P<0.05),说明4个因子对响应值的影响不是简单的线性关系,曲面效应显著。响应面结果见图1。

图1 葡萄糖和硫酸铜、蛋白胨和硫酸铜交互作用对富硒产朊假丝酵母生物量影响的响应曲面及等高线Fig.1 Response surface plots and contour line of effects of interaction between glucose and CuSO4,peptone and CuSO4on biomass of selenium-enrichedC.utilis
2.3.2 回归模型验证试验
根据回归模型得到富硒酵母生物量预测最大值为12.14 g/L,对应4个因子的取值分别为葡萄糖31.04 g/L、蛋白胨16.81 g/L、KH2PO46.65 g/L、CuSO40.01 g/L。为方便实际操作,修改条件为葡萄糖30 g/L、蛋白胨17 g/L、KH2PO46.5 g/L、CuSO40.01 g/L。对上述条件进行验证性试验,优化后生物量为12.01 g/L,GSH为134.27 mg/L,有机硒为1 337.46 μg/g,较优化前分别提高了36%、14%和20%。
2.4 亚硒酸钠对酵母生长的影响
由表8可知,亚硒酸钠添加量较低时对酵母生长影响较小,胞内GSH含量稳定,但有机硒富集也较少;随着添加量增加,有机硒含量增加;亚硒酸钠添加量>30μg/mL时,胞内GSH显著降低,菌体大量死亡。亚硒酸钠添加量为30μg/mL时,酵母生物量为11.21 g/L,有机硒为1 673.32 μg/g,谷胱甘肽为126.80 mg/L。

表8 亚硒酸钠添加量对朊假丝酵母性能影响Table 8 Effect of sodium selenite addition on the performances of C.utilis
3 结论
采用响应面法对酵母生长培养基优化结果为葡萄糖30 g/L、蛋白胨17 g/L、KH2PO46.5 g/L、CuSO40.01 g/L。在此条件下酵母生物量为12.01 g/L,有机硒1 337.46 μg/g,谷胱甘肽134.27 mg/L。将培养基中亚硒酸钠添加量由25 μg/mL提高至30 μg/mL,酵母生物量为11.21 g/L,有机硒为1 673.32 μg/g,谷胱甘肽为126.80mg/L。该研究为高性能富硒产朊假丝酵母深入研究奠定了基础。
[1]MAREK K,KIELISZEK M,STANISIAW B.Current knowledge on the importance of selenium in food for living organisms:a review[J].Molecules,2016,21(5):609-624.
[2]KIELISZEK M,BLAZEJAK S,GIENTKA I,et al.Accumulation and metabolism of selenium by yeast cells[J].Appl Microbiol Biot,2015,99(13):5373-5382.
[3]ZHAN X A,QIE Y Z,WANG M,et al.Selenomethionine:an effective selenium source for sow to improve Se distribution,antioxidant status,and growth performance of pig offspring[J].Biol Trace Elem Res,2011,142(3):481-491.
[4]PÉREZ-CORONA M T,SÁNCHEZ-MARTÍNEZ M,VALDERRAMA M J,et al.Selenium biotransformation bySaccharomyces cerevisiaeand Saccharomyces bayanusduring white wine manufacture:laboratory-scale experiments[J].Food Chem,2011,124(3):1050-1055.
[5]WANG Z,ZHANG L Y,TAN T W.High cell density fermentation of Saccharomyces cerevisiaeGS2 for selenium-enriched yeast production[J].Kor J Chem Eng,2010,27(6):1836-1840.
[6]WANG D H,YANG B,WEI G Y,et al.Efficient preparation of Selenium/glutathione-enrichedCandida utilisand its biological effects on rats[J].Biol Trace Elem Res,2012,150(1-3):249-257.
[7]WANG D H,ZHANG J L,DONG Y Y,et al.Glutathione is involved in physiological response ofCandida utilisto acid stress[J].Appl Microbiol Biot,2015,99(24):10669-10679.
[8]YIN H F,CHEN Z G,GU Z X,et al.Optimization of natural fermentative medium for selenium-enriched yeast by d-optimal mixture design[J].LWT-Food Sci Tech,2009,42(1):327-331.
[9]SUHAJDA A,HEGOCZKI J,JANZS B,et al.Preparation of seleniumenrichedSaccharomyces cerevisiae[J].J Trace Elem Med Biol,2000,14(1):43-47.
[10]邹 艳,李俊杰,管 斌,等.高生物量富硒产朊假丝酵母菌株的选育[J].中国酿造,2017,36(5):85-89.
[11]杨 波.富硒产朊假丝酵母的制备及性能研究[D].苏州:苏州大学,2012.
[12]CATALINO G,AKIHISA KANDA,et al.Effect of amino acids on glutathione production bySaccharomyces cerevisiae[J].Appl Microbiol Biotechnol,1992,36:538-540.
[13]吴宝强,梁海秋,杨 辉,等.高生物量富硒酵母的选育和培养条件的初步研究[J].现代食品科技,2005,21(2):35-39.
[14]KIELISZEK M,BIAZEJAK S,KUREK E.Binding and conversion of selenium inCandida utilisATCC 9950 yeast in bioreactor culture[J].Molecules,2017,22(3):1-11.
[15]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2015:512.
[16]ROSEN B R,LIU Z J.Transport pathways for arsenic and selenium:a minireview[J].Environ Int,2009,35(3):512-515.
[17]原国强,杨 辉,梁海秋,等.富硒酵母的选育及其发酵条件的优化试验[J].食品科技,2007,32(5):25-28.
[18]LAZARD M,BLANQUET S,FISICARO P,et al.Uptake of selenite by Saccharomyces cerevisiaeinvolves the high and low affinity orthophosphate transporters[J].J Biol Chem,2010,285(42):32029-32037.
[19]张 敏,王立芹.微量元素铜的营养学研究进展[J].中国饲料添加剂,2014(9):10-14.
[20]KIELISZEK M.BŁAZ˙EJAK S,BZDUCHA-WRÓBEL A,et al.Effects of selenium on morphological changes inCandida utilisATCC 9950 yeast cells[J].Biol Trace Elem Res,2016,169(2):387-393.

