葡糖醋杆菌利用黄水发酵生产细菌纤维素
李 周,贺富强,杨惠敏,文 章,胡 承
(四川大学 生命科学学院生物资源与生态环境教育部重点实验室,四川 成都 610064)
黄水是浓香型固态白酒发酵过程中营养物质在微生物作用下形成的副产物,即糟醅淋浆与窖泥浸出物积淀到发酵池底,形成的黄色或者棕黄色具有特殊气味的黏稠液体。黄水中含有大量可利用的营养物质,除含有醇、酸、醛、酯类等物质外,还含有部分糖类物质、含氮化合物和少量的单宁及色素等有机物。在以往的研究和生产中,黄水并未得到充分利用,且由于黄水的化学需氧量(chemical oxygen demand,COD)较高,通常可达25 000~40 000 mg/L,其丰富的有机质存在利用价值,若不充分利用则有造成环境污染的风险[1]。
细菌纤维素(bacterial cellulose,BC)是由木醋杆菌(Acetobacter xylinum)、葡糖醋杆菌(Gluconacetobacter)等微生物发酵而来的。BC的结构单位与植物纤维素相同,但BC具有高纯度、高结晶度、高拉伸强度和较强的生物相容性等优良特性[2]。近年来,BC已经广泛应用于食品、造纸、生物医学材料、生物吸附材料等领域,是BC生产成本高、产量低等问题成为了其工业化大规模生产的瓶颈。如何利用较为廉价的资源来发酵产生更多的BC成为了目前研究的重点。
马霞等[3]利用酒糟浸出液生产细菌纤维素,经优化后产量可提高140.6%,产量可达到14.44 g/L。陈慧慧等[4]利用杨木水解液生产BC,产量为3.14 g/L。KESHK S M[5]则发现在培养基中添加维生素C可以将BC的产量提高88%。ZENG X等[6]发现部分有机酸添加到HS培养基中可以显著提高BC的产量。已有的研究表明[7],黄水中含有乙酸、柠檬酸等有利于BC生产的营养成分。本实验为探究葡糖醋杆菌利用黄水发酵产BC的可行性,将黄水按照不同体积比添加到HS培养基中,再将葡糖醋杆菌接种至50 mL发酵液中30℃静置培养7 d后,测定BC产量和还原糖含量、总酸含量、pH值等指标,从而得到最佳的黄水体积比,再进一步检测最适黄水体积比下发酵过程中葡糖醋杆菌BC产量以及理化指标的变化趋势。以期为葡糖醋杆菌利用黄水发酵生产BC提供研究基础。
1 材料与方法
1.1 材料与试剂
葡糖醋杆菌(Gluconacetobacter)G29:由本实验室筛选和保藏;黄水:采样于水井坊公司水井街基地窖池,4℃冰箱保存沉降,取上层液体。
葡萄糖、胰蛋白胨、酵母粉、柠檬酸、Na2HPO4·12H2O、琼脂、氢氧化钠、盐酸(均为分析纯):成都市科隆化学品有限公司。
对羟基苯甲酸酰肼(4-hydroxybenzoic acid hydrazide,PAHBAH)[8]:
A:0.5 mol/L HCl溶解的5%对羟基苯甲酸酰肼溶液,配好后4℃冰箱保存。
B:0.5 mol/L NaOH溶液
使用时将A与B按1∶9体积比混合即为对羟基苯甲酸酰肼试剂。
HS培养基:葡萄糖20 g/L,蛋白胨5 g/L,酵母粉5 g/L,柠檬酸1 g/L,Na2HPO45 g/L[9],pH值调为5.8,115℃灭菌30 min[9]。
1.2 仪器与设备
SQPPRACTUM224-1CN电子天平:赛多利斯科学仪器;PHS-2C笔式pH计:上海康仪仪器有限公司;101型电热鼓风干燥箱、HWS-150恒温恒湿培养箱:北京中兴伟业仪器有限公司;UV-2450紫外可见分光光度计:日本岛津公司。
1.3 方法
1.3.1 不同黄水体积比对BC产量及发酵液理化性质的影响
将黄水添加到HS培养基中,配制50 mL黄水-HS培养基,且使最终黄水所占体积比分别为:10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,装入250 mL锥形瓶中,pH值调节为5.8,115℃灭菌30 min。以HS培养基为对照,按照10%的接种量将经过3次传代的葡糖醋杆菌G29分别接种到黄水-HS培养基,30℃静置培养7 d,测定发酵液的总酸含量、还原糖消耗量、糖转化效率、pH值和BC产量[10]。
1.3.2 发酵过程中BC产量以及理化指标的变化
选择1.3.1节中BC产量最高时的黄水体积比,配制50mL培养基,装入250 mL锥形瓶中。按照10%的接种量将葡糖醋杆菌G29接种到黄水-HS培养基中,以HS培养基作对照,30℃静置培养7 d,每隔1 d进行取样,测定其总酸含量、还原糖消耗量、糖转化效率、pH值和BC产量。
1.3.3 扩大浅圆盘发酵对BC产量以及糖转化效率的影响
选择1.3.1节中BC产量最高时的黄水体积比,配制成500mL黄水-HS培养基,置于特制浅圆盘(直径295mm)中,以HS培养基作对照,按照10%的接种量将葡糖醋杆菌G29接种到黄水-HS培养基中,30℃静置培养7 d,测定其糖转化效率和其BC产量。
1.3.4 分析方法
还原糖含量的测定[8]:采用对羟基苯甲酸酰肼(PAHBAH)试剂法。还原糖消耗量的计算公式如下:
还原糖消耗量=发酵前还原糖含量(g/L)-发酵后还原糖量(g/L)
单日还原糖消耗量N=还原糖含量N-1(g/L)-还原糖含量N(g/L)(N代表第N天,下同)
BC产量的测定[11]:将生成的BC膜用自来水多次冲洗浸泡除去其表面的杂质,至颜色较淡,再将膜置于80℃氢氧化钠(1 mol/L)溶液中浸泡90 min,然后置于80℃蒸馏水中洗涤至中性,洗涤过程重复两次,于烘箱中75℃烘干至恒质量,称质量。BC产量计算公式如下:

总酸含量(以乙酸计)的测定参考GB/T 12456—2008《食品中总酸的测定》中的方法;pH值的测定参考GB 5009.237—2016《食品安全国家标准食品pH值的测定》中的方法;乙醇含量的测定参考GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》中的方法。
1.3.5 数据处理
数据统计采用SPSS22.0单因素方差分析(P<0.05),实验结果表示为平均数±标准差,图表分析由Excel2007完成。
2 结果与分析
2.1 黄水的成分分析
将黄水静置后取上层液体,检测其总酸含量、pH值、还原糖含量、乙醇含量,结果见表1。

表1 黄水的理化指标检测结果Table 1 Detection results of physical and chemical indexes of"yellow water"
由表1可知,黄水中含有8.2 g/L的还原糖、4.73 g/L的总酸含量以及2.6%的乙醇。这些成分可以作为混合碳源被葡糖醋杆菌利用,而HS培养基组分中只有葡萄糖作为主要碳源,陈华美等[12]研究结果表明,多种混合碳源更有有利于菌株发酵。且黄水中含有的乙酸、乙醇等物质已被张丽平等[13]研究证明有利于葡糖醋杆菌产生BC。因此,黄水具有发酵生产细菌纤维素的价值。
2.2 不同黄水体积比对BC产量以及发酵液理化性质的影响
不同黄水体积比对葡糖醋杆菌的BC产量和发酵液中还原糖消耗量的影响如图1所示。由图1可知,随着黄水体积比的增加BC产量呈先增后减的趋势,当黄水体积比为40%时,BC产量最高,可达5.93 g/L,比对照组的BC产量(2.20 g/L)提高了169.5%;继续增加黄水体积比,发酵液中BC产量开始减少;当黄水体积比分别为90%和100%时,混合培养基中基本不产生BC,原因可能是黄水虽然含有乙醇、乙酸等有利于葡糖醋杆菌产生BC的物质,但同样也含有少量有毒物质如糠醛等[14],抑制葡糖醋杆菌生长,此外黄水中还原糖含量较少,也可能是当黄水体积比过高时制约BC产生的原因之一。当黄水体积比<50%时,还原糖消耗量均维持在10 g/L左右,比对照组略有提高;当黄水体积比>50%时,还原糖消耗量减少至8 g/L左右,当黄水体积比至90%及以上时,还原糖消耗量接近零。结果表明,添加适量的黄水到HS培养基中能够提高BC产量。
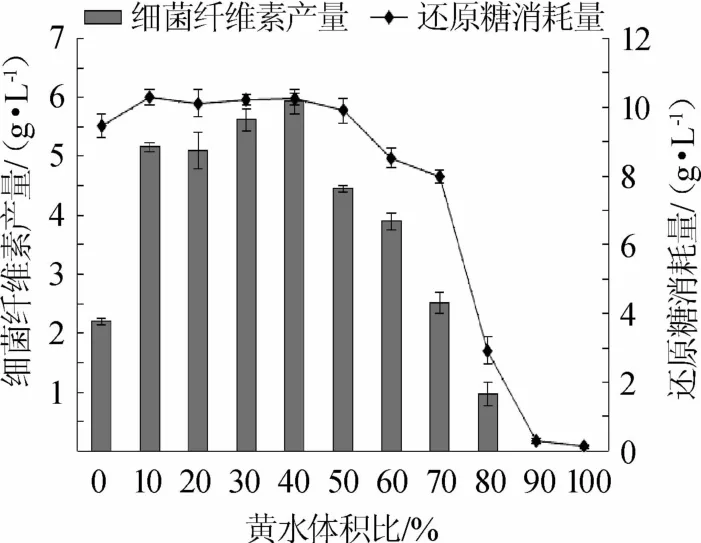
图1 黄水体积比对细菌纤维素产量和还原糖消耗量的影响Fig.1 Effect of volume ratio of"yellow water"on bacterial cellulose yield and reducing sugar consumption
检测不同黄水体积比的黄水-HS培养基发酵结束后发酵液的pH值、总酸含量以及糖转化效率,结果如表2所示。由表2可知,黄水-HS培养基发酵液的pH值在4.73~5.58之间,相比于对照组的pH值(3.38),有显著的提高(P<0.05),由于葡糖醋杆菌最适发酵pH值为4.0~6.0[5],因此黄水-HS培养基发酵液的pH更有利于BC的产生。总酸含量当黄水体积>70%时有显著提高(P<0.05);同时黄水的添加可以显著提高葡糖醋杆菌的糖转化效率(P<0.05),当黄水体积比为40%时,糖转化效率达到最大为57.86%,相比对照组(23.25%)提高了148.9%,这可能是因为葡萄糖作为碳源时会产生副产物葡萄糖酸,降低培养基的pH[15],而黄水中的还原糖、有机酸、乙醇丰富了碳源,减少了葡萄糖酸的产生,这样不仅可以维持pH的稳定,也可以促使培养基中的葡萄糖更多地转化为BC生物合成的基质,进而提高糖转化率[16],糖转化效率高表明葡糖醋杆菌可以消耗相同的还原糖产生更多的BC。结果表明,黄水的添加可以使发酵液的pH维持在4.61~5.58之间,有利于BC的产生,同时能提高糖转化效率。当黄水体积比为40%时,葡糖醋杆菌的BC产量和糖转化效率均为最高,因此选择最佳黄水体积比为40%。
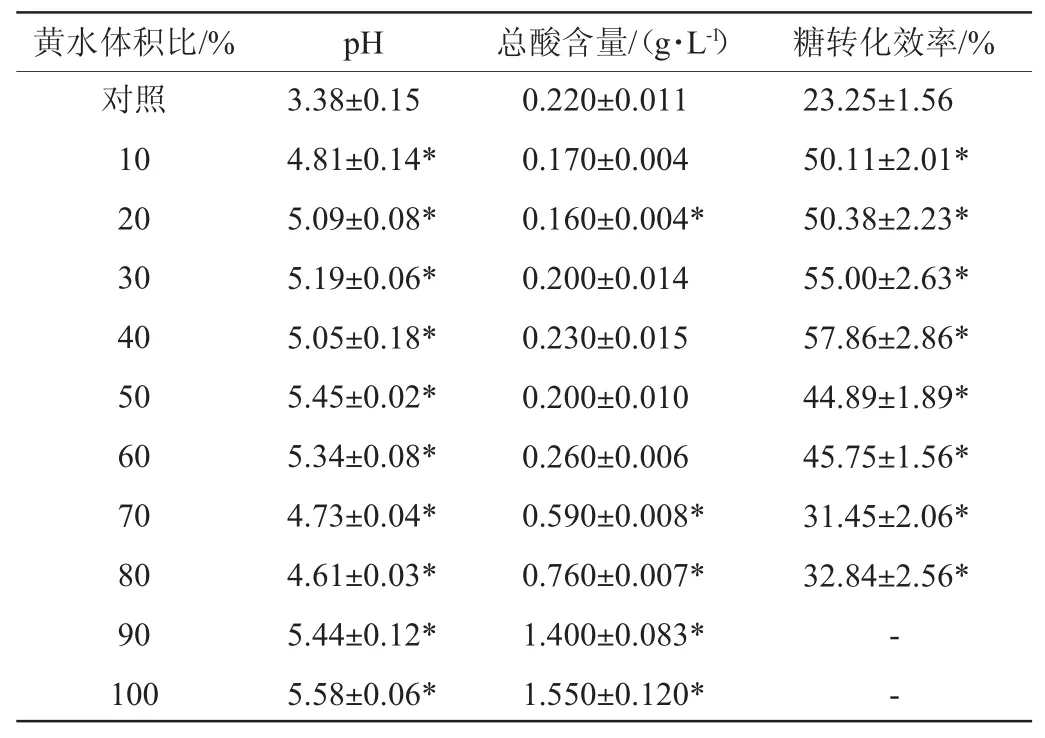
表2 不同黄水-HS培养基发酵结束后pH、总酸含量以及糖转化效率的比较Table 2 Comparison of pH,total acid content and sugar conversion rate after fermentation of different"yellow water"-HS medium
2.3 发酵过程中BC产量以及理化指标变化

图2 发酵过程中单日还原糖消耗量和细菌纤维素的产量Fig.2 Daily reducing sugar consumption and bacterial cellulose yield during fermentation
将葡糖醋杆菌分别接种于40%黄水-HS培养基和HS培养基进行培养,每天取样测定其单日还原糖消耗量和BC产量,结果如图2所示。由图2可知,40%黄水-HS培养基的单日BC产量呈先增后减的趋势,且除第1天的BC产量较低外,从第2天起均保持较高水平(>0.7 g/L),HS培养基的单日BC产量也呈先增加后减少的趋势,但前两天产细菌纤维素较少,第3天开始BC产量增加,且仅有第4天的BC产量较高(1.11 g/L),其余天数较低(<0.6 g/L),说明40%黄水-HS培养基中的葡糖醋杆菌能更快地产生次级代谢产物BC,且能长时间的保持较高的BC产量,这可能是因为黄水含有丰富的营养成分,促进葡糖醋杆菌的快速繁殖,使培养基中的BC产量快速达到一个较高的水平;同时整个发酵过程中40%黄水-HS培养基的单日还原糖消耗量均在1.4g/L左右,而HS培养基中的单日还原糖消耗量波动较大,最大值为2.96 g/L,最小值为0.4 g/L,说明40%黄水-HS培养基中的葡糖醋杆菌代谢较为稳定。

表3 40%黄水-HS培养基单日pH、总酸含量以及糖转化效率的变化Table 3 Changes of daily pH,total acid content and sugar conversion rate of 40%"yellow water"-HS medium

表4 HS培养基单日pH、总酸含量以及糖转化效率的变化Table 4 Changes of daily pH,total acid content and sugar conversion rate of HS medium
由表3和表4可知,在整个发酵过程中,40%黄水-HS培养基的pH值呈先减后增的趋势,且维持在4.60~5.50之间,仅在第2天、第4天比初始pH值有显著降低(P<0.05),HS培养基的pH值则不断降低,从第2天起均显著低于未发酵培养基(P<0.05),最后降为3.75,说明40%黄水-HS培养基的pH值更加稳定;40%黄水-HS培养基的总酸含量从第2天开始相比于初始值有显著增加(P<0.05),最高可达0.480 g/L,但发酵结束时又回到初始值,而HS培养基的总酸含量从第3天起,均为0.200 g/L左右,显著高于未发酵培养基(P<0.05);40%黄水-HS培养基和HS培养基的单日糖转化效率均呈先增后减的趋势,但40%黄水-HS培养基单日糖转化效率均比同天数HS培养基高。这可能是因为虽然在BC的合成过程中葡萄糖酸等酸性物质会不断积累,但黄水中的有机酸在培养基初始pH值的调整过程中会由于氢氧化钠的添加而产生大量的弱酸盐,能够起到一定的缓冲作用;葡萄糖合成的多聚物是合成纤维素的主要原料,而黄水中的糖类物质也可以作为葡糖醋杆菌的能源物质,这样更多的葡萄糖可以用来合成纤维素,糖转化效率也就提高了[17]。综合发酵过程中BC产量、pH和糖转化效率来看,40%黄水-HS培养基要优于HS培养基,其黄水组分起到了良好的缓冲作用。
2.4 扩大浅圆盘发酵对BC产量以及糖转化效率的影响
由表5可知,扩大浅圆盘发酵的40%黄水-HS培养基中BC产量为3.48 g/L,较对照组(1.62 g/L)提高了114.8%,较锥形瓶发酵(5.93 g/L)降低了41.4%;糖转化效率为22.70%,较对照组(8.10%)提高了180.2%,较锥形瓶发酵(22.7%)降低了60.8%。说明发酵体系的扩大后,40%黄水-HS培养基的BC产量和糖转化效率仍显著优于对照组(P<0.05),但相比于锥形瓶发酵时,葡糖醋杆菌的BC产量和糖转化效率有所降低。原因可能是与锥形瓶发酵相比,扩大浅圆盘发酵中表面积/发酵空间增大,液面上空间减少,氧气总量降低,导致葡糖醋杆菌供氧不足,BC产量下降,这与KUO C H等[18]的研究结果一致。结果表明,40%黄水-HS培养基在扩大发酵中仍优于HS培养基。

表5 扩大浅圆盘发酵细菌纤维素产量和糖转化效率Table 5 Bacterial cellulose yield and sugar conversion rate during expanded shallow disk fermentation
3 结论
将黄水以不同体积比添加到HS培养基中进行葡糖醋杆菌发酵生产BC,测定发酵7 d后发酵液中BC产量和还原糖消耗量等指标。结果表明,黄水最佳体积比为40%,在此条件下,BC产量为5.93g/L,相比对照组(HS培养基)提高了169.5%;糖转化效率为57.86%,相比对照组提高了148.9%。进一步检测发酵过程中葡糖醋杆菌BC产量以及理化指标变化,40%黄水-HS培养基单日BC产量均保持较高水平,最大值为1.14 g/L;单日糖转化效率均高于同时期的对照组;pH值维持在4.60~5.50之间。在扩大浅圆盘发酵中,40%黄水-HS培养基中BC产量为3.48 g/L,糖转化效率为22.70%,与对照组相比,也均有显著提高(P<0.05)。黄水作为HS培养基的补充不仅提高了BC产量,也为开发利用黄水这一白酒工业副产物提供了新的途径。
[1]徐传鸿,余有贵,张文武.黄水的理化分析及其应用研究进展[J].食品安全质量检测学报,2014,5(12):4011-4017.
[2]WUJM,LIURH.Thinstillagesupplementationgreatlyenhancesbacterial cellulose production byGluconacetobacter xylinus[J].Carbohyd Polym,2012,90(1):116-121.
[3]马 霞,董炎炎,于海燕.酒糟浸出液发酵产细菌纤维素工艺优化[J].农业工程学报,2015,31(8):302-307.
[4]陈慧慧,刘 玉,王慧梅.利用杨木水解液制备细菌纤维素[J].生物技术通报,2017,33(3):144-150.
[5]KESHK S M.Vitamin C enhances bacterial cellulose production in Gluconacetobacter xylinus[J].Carbohyd Polym,2014,99(1):98-100.
[6]ZENG X,SMALL D P,WAN W.Statistical optimization of culture conditions for bacterial cellulose production byAcetobacter xylinum BPR2001frommaplesyrup[J].Carbohyd Polym,2011,85(3):506-513.
[7]冯兴壵,邓 杰,谢 军,等.白酒酿造副产物黄水综合利用现状浅析[J].中国酿造,2017,36(2):6-9.
[8]LEVER M.Carbohydrate determination with 4-hydroxybenzoic acid hydrazide(PAHBAH):Effect of bismuth on the reaction[J].Anal Biochem,1977,81(1):21-27.
[9]SCHRAMM M,HESTRIN S.Factors affecting production of cellulose at the air/liquid interface of a culture ofAcetobacter xylinum[J].J Gen Microbiol,1954,11(1):123-129.
[10]王海波,关凤梅,马 霞,等.改性细菌纤维素的发酵生产及性能测定[J].食品科技,2009,34(5):28-31.
[11]张胜潮,曾祥勇,董雅舒,等.神经网络和遗传算法优化细菌纤维素培养参数[J].四川大学学报:自然科学版,2014,51(2):371-377.
[12]陈华美,刘四新,李从发.细菌纤维素的生物合成与发酵研究进展[J].热带作物学报,2016,37(8):1651-1657.
[13]张丽平,卢红梅,戴 锐,等.乙醇及有机酸对木醋杆菌合成细菌纤维素的影响[J].食品工业科技,2014,35(4):161-165.
[14]王传荣,沈洪涛.黄水在新型白酒生产中的应用[J].中国酿造,2005,24(2):26-28.
[15]KESHK S,SAMESHIMA K.Influence of lignosulfonate on crystal structure and productivity of bacterial cellulose in a static culture[J].Enzyme Microbial Technol,2006,40(1):4-8.
[16]马 霞,王瑞明,关凤梅,等.非碳水化合物对木醋杆菌合成细菌纤维素影响规律的初探[J].中国酿造,2003,22(4):15-17.
[17]TODA K,ASAKURA T,FUKAYA M,et al.Cellulose production by acetic acid-resistantAcetobacter xylinum[J].J Ferment Bioeng,1997,84(3):228-231.
[18]KUO C H,CHEN J H,LIOU B K,et al.Utilization of acetate buffer to improve bacterial cellulose production byGluconacetobacter xylinus[J].Food Hydrocolloid,2016,53(1):98-103.

