杀线虫海洋枝顶孢霉BH0531发酵条件的响应面优化
苗利华,张金源,李 娜,冯 欣,2,孟庆恒,2*,孙建华,2
(1.天津师范大学 生命科学学院,天津 300387;2.天津市动植物抗性重点实验室,天津 300387)
植物寄生线虫是重要的植物病原物之一,分布广,种类多,广泛寄生在农作物、蔬菜、果树、林木、花卉及药材上,给农林业生产带来了巨大的经济损失[1]。
目前,有关植物寄生线虫的防治主要是化学杀线虫剂,但是大部分存在高毒、高残留、高污染等诸多缺点,使得化学杀线剂的应用受到一定程度的限制[2-4]。因此,防治效果好、对环境友好的生物源杀线剂受到了人们的重视[5],并且已在病原线虫防治方面得到了广泛的研究和应用[6]。海洋枝顶孢霉(Acremoniumsp.)BH0531是一株已经证实的对松材线虫和根结线虫均有较好杀线活性的菌株[7];其发酵液对根结线虫卵囊和分散卵的孵化以及J2幼虫均具有明显抑制作用,对J2幼虫的杀线作用高于实验条件下灭线磷及阿维菌素的测定值[8],因此,对该菌株进行杀线虫活性的研究具有潜在的价值。在前期试验中得出该菌株利用不同发酵培养基杀线效果不一,其中海水培养基生物量和杀线活性最高,马铃薯培养基次之,查氏培养基产量最低[9]。但在工业化生产中,土豆和海水培养基都不适合大规模发酵,存在操作繁琐、腐蚀设备等缺点。而合成培养基不仅可以有效地避免这些问题且各营养成分明确,可以更方便准确地控制。因此,试验选用察氏培养基为基础发酵培养基,拟利用响应面分析法对其发酵培养基及工艺条件进行优化,从而提高发酵液的杀线效率,以期为菌株后续工业化放大研究提供可靠依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
海洋真菌枝顶孢霉(Acremoniumsp.)BH0531(菌种保藏号CGMCC-5445)、灰葡萄孢霉(Batrytis cinerea,BC)菌:天津师范大学生命科学学院微生物实验室。
1.1.2 供试线虫
松材线虫(Bursaphelenchus xylophilus):天津师范大学生命科学学院微生物实验室。
1.1.3 供试培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:去皮马铃薯200 g/L煮汁,葡萄糖20 g/L,琼脂15 g/L,MgSO40.05 g/L,pH自然,蒸馏水定容至1 000 mL,121℃、0.1 MPa灭菌20 min。
基础发酵培养基:NaNO32 g/L,K2HPO41 g/L,MgSO40.5 g/L,KCl 0.5 g/L,FeSO40.01 g/L,葡萄糖20 g/L,pH值自然,121℃、0.1 MPa灭菌20 min。
1.2 仪器与设备
SPX-250B-Z型生化培养箱:上海博讯实业有限公司医疗设备厂;DME/MVC2000型显微镜:德国徕卡公司;IS-RDV1立式单门双层恒温振荡器:美国精骐有限公司;TOMY SX-500高压灭菌锅:日本TOMY Digital Biology公司;UEOS-503型中空纤维膜组件:天津膜天膜工程技术有限公司。
1.3 实验方法
1.3.1 发酵滤液的制备
取新的菌株斜面,加无菌水洗下孢子,制成1×106个/mL的孢子悬液,将孢子悬液以试验设计中的接种量接入装液量为50 mL/250 mL液体发酵培养基的三角瓶中。26℃、120 r/min振荡培养。将发酵液除去菌体收集滤液,先经0.22 μm滤膜过滤,再经6 000 Da的超滤膜组件过滤,即为用于杀线虫效果分析所需发酵液。
1.3.2 杀线虫活性的测定
将收集到的线虫配制成1 000条/mL的线虫悬液。取96孔培养板,每孔板加入100 μL待测生物样品和100 μL线虫悬液(约100条),计数时向小孔内加入几滴无菌水,统计线虫死亡数,杀线率计算公式如下:

1.3.3 响应面试验
(1)Plackett-Burman试验[10]
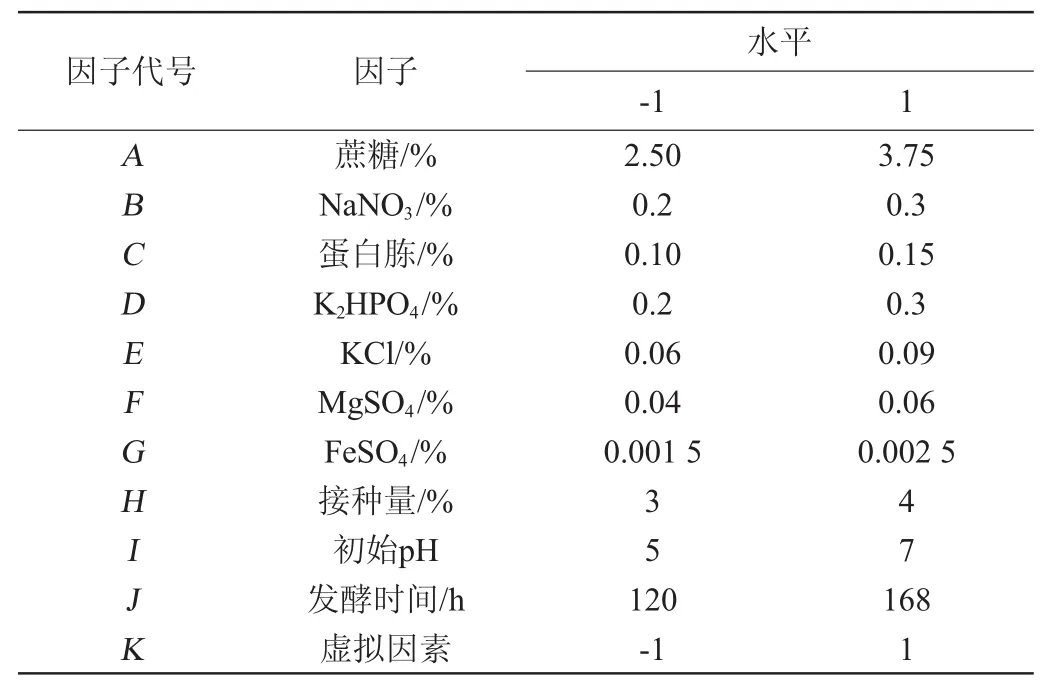
表1 Plackett-Burman试验因素与水平Table 1 Factors and levels of Plackett-Burman experiments
在单因素试验基础上,利用Plackett-Burman设计法对发酵培养基中的10个因素进行考察,每个因素取高低2个水平,高水平约为低水平的1.5倍[11]。Plackett-Burman试验设计因素与水平见表1。
(2)最陡爬坡试验
最陡爬坡试验是通过对Plackett-Burman试验设计的各因素结果进行分析,根据获得的主要因子的效应值来确定爬坡路径和步长,以快速逼近最佳区域[12]。
(3)Box-Behnten试验
根据最陡爬坡试验确定的试验因素与水平,采用Box-Behnken设计原理和软件分析,以主要影响因素为自变量,以杀线率为响应值设计响应面试验,拟合自变量与响应值之间的函数关系[13]。
1.3.4 数据处理
应用Excel软件进行试验数据处理,利用Desigin-Expert version 8.0.6设计软件进行响应面试验设计及相关数据分析。
2 结果与分析
2.1 Plackett-Burman试验筛选主要影响因子
根据单因子试验结果,本试验选用次数N=12的试验设计,对蔗糖(A)、NaNO3(B)、蛋白胨(C)、K2HPO4(D)、MgSO4(E)、KCl(F)、FeSO4(G)、接种量(H)、初始pH(I)、发酵时间(J)、空项(K)等10个因素进行考察,每组试验设计3次重复来测定发酵液的杀线率(Y)。试验设计与结果见表2。借助Desigin-Expert version 8.0.6设计软件进行数据分析,结果见表3。
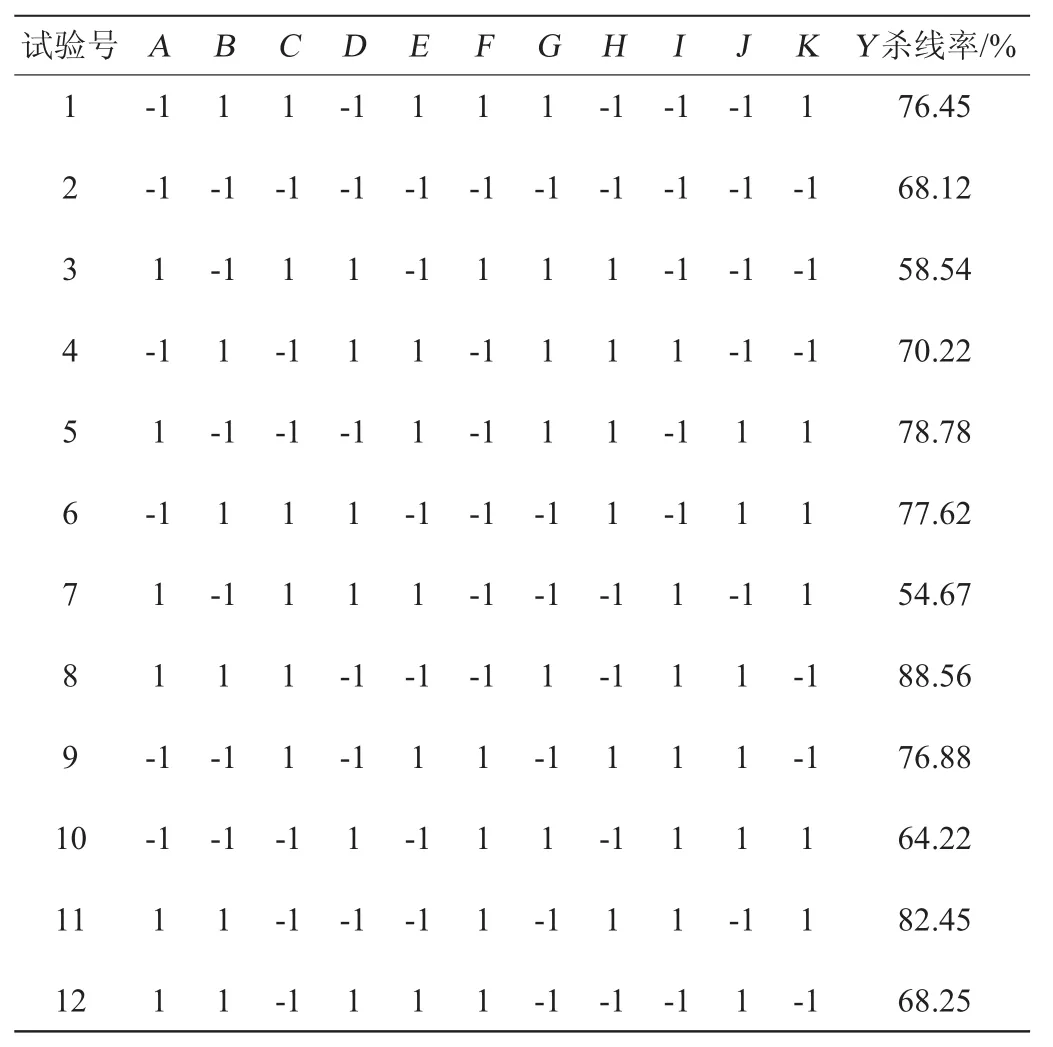
表2 Plackett-Burman试验设计与结果Table 2 Design and results of Plackett-Burman experiments
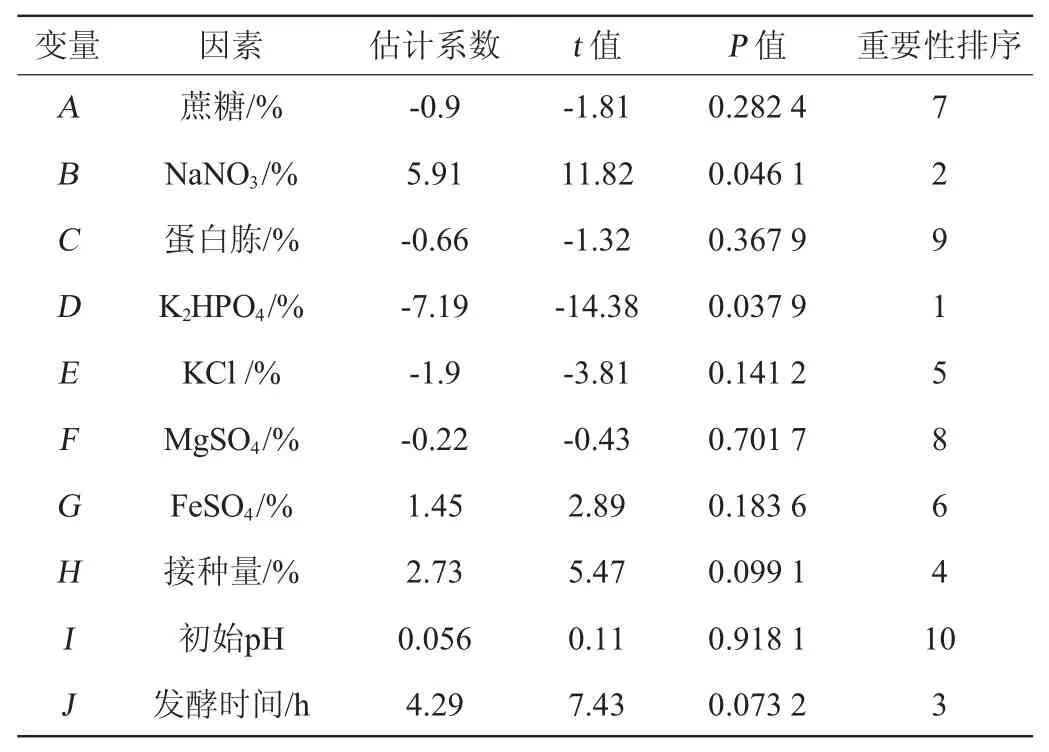
表3 Plackett-Burman试验各因素效应分析Table 3 Effect analysis of each factor of Plackett-Burman experiments
2.2 最陡爬坡试验选取中心点
由表3可知,各因素对杀线活性影响的大小顺序为K2HPO4>NaNO3>培养时间>接种量>KCl>FeSO4>蔗糖>MgSO4>蛋白胨>初始pH。其中影响最大的为K2HPO4、NaNO3、培养时间这3个因素,需进行最陡爬坡试验优化分析,结果见表4。
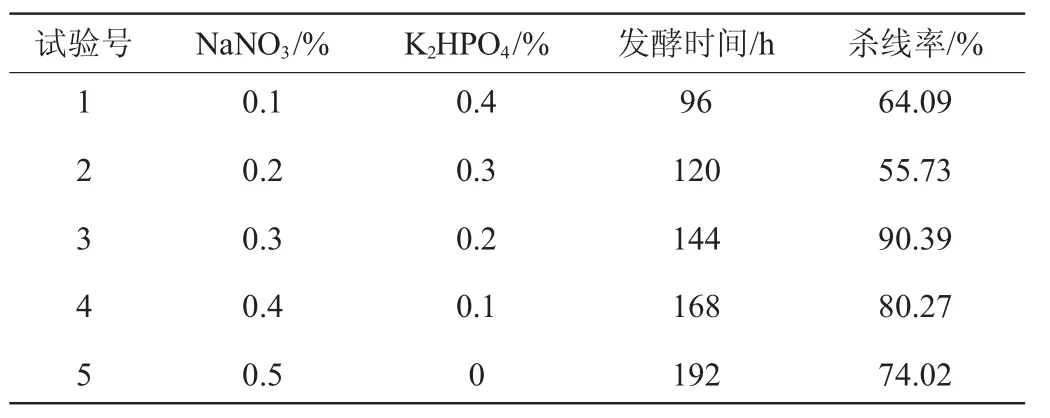
表4 最陡爬坡试验设计及结果Table 4 Design and results of steepest ascent experiments
由表4可知,各因素在第3组试验附近取值时,发酵液杀线率最高,因此选取这一组试验条件作为中心组合试验的中心点,进行中心组合试验设计。
2.3 Box-Behnken试验确定最优组合
根据最陡爬坡试验筛选出的试验中心点,采用Box-Behnken试验设计,利用Design-Expert version 8.0.6软件进行3因素3水平的响应面分析试验,其他因素取值为最陡爬坡试验结果,共进行17次试验,试验因素与水平见表5,试验设计及结果见表6,方差分析结果见表7。
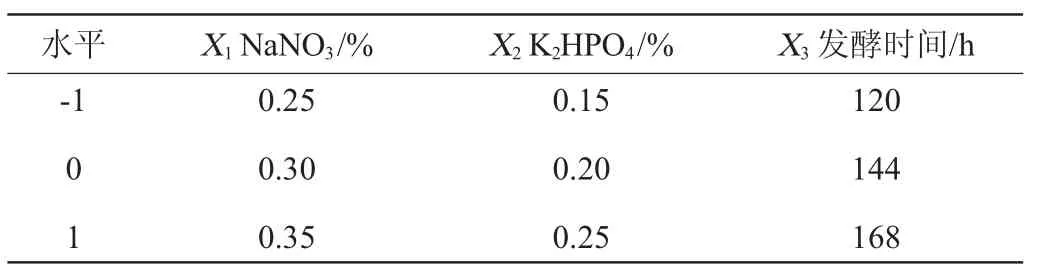
表5 Box-Behnken试验设计因素与水平Table 5 Factors and levels of Box-Behnken experiments design
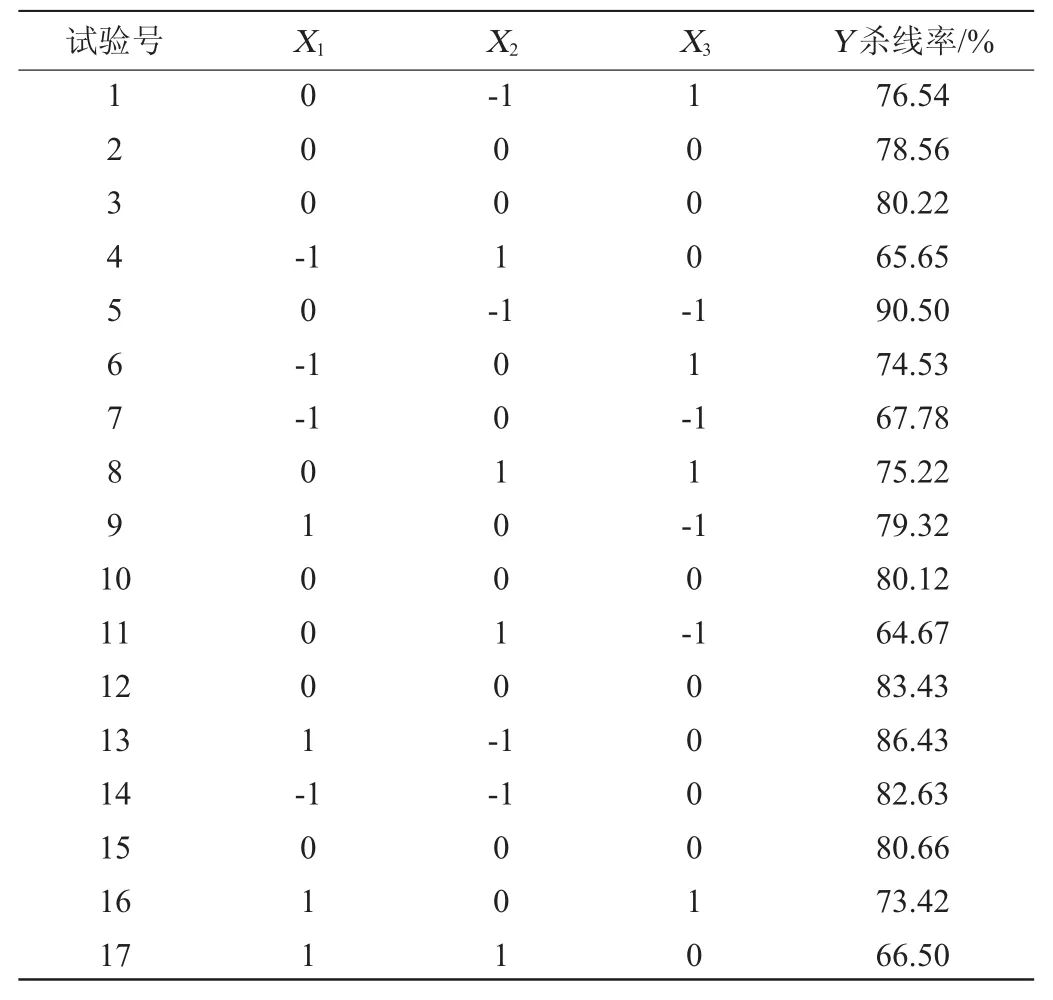
表6 Box-Behnken试验设计及结果Table 6 Design and results of Box-Behnken experiments
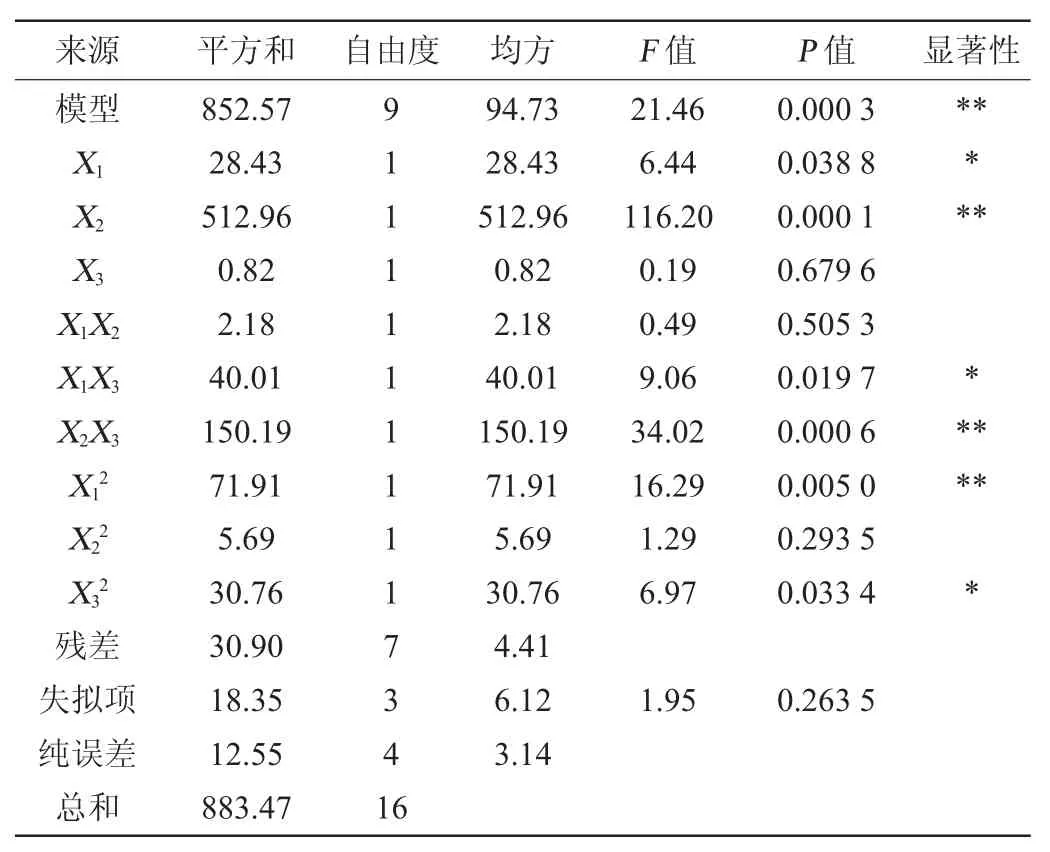
表7 回归模型方差分析Table 7 Variance analysis of regression model
根据表6试验结果,运用Desigin-Expert version 8.0.6设计软件对数据进行多项式回归拟合后得到的二次响应面的三元二次回归方程为:
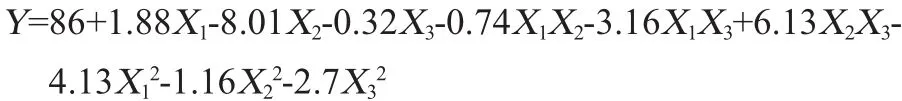
通过对模型进行显著性检验分析,由表7可知,模型极显著(P<0.01),其中因素X2、X2X3、X12对发酵液的杀线率影响极显著(P<0.01),X1、X1X3、X32对杀线率的影响显著(P<0.05),失拟项P值为0.263 5,影响不显著(P>0.05),表明多元回归方程具有显著性,模型能较好的分析和预测响应值。模型决定系数R2为0.965 0,校正决定系数R2adj为0.920 1,表明模型能解释96.50%的响应值的变化,模型可信度高。一般情况下,变异系数<10%就可以说明模型具有良好的重复性[14]。经方差分析得到的变异系数为2.73<10,表明模型准确度高,变异可能性低。信噪比(RSN)为17.543>4,说明此模型具有较好的拟合度[15]。
利用Desigin-Expert version 8.0.6软件,通过PB试验以及Box-Behnken响应面二次回归方差分析,得到可选择的最优组合为NaNO33.4 g/L,K2HPO41.5 g/L,发酵时间130 h,其他条件为PB试验得到的结果,即发酵条件为蔗糖25 g/L、蛋白胨1 g/L、MgSO40.4 g/L、KCl 0.6 g/L、FeSO40.025 g/L、接种量4%、初始pH 7、转速120 r/min,温度为26℃,装液量为50mL/250mL时发酵液杀线活性最高。在此条件下发酵液的杀线率理论预测值为90.58%,与实际测定值88.00%相比,其相对误差为2.58%,说明该模型能较好地模拟和预测试验结果。
2.4 响应面因素交互作用分析
由图1可知,对发酵液杀线活性影响比较大的因素为K2HPO4,其次为NaNO3,影响最小的为发酵时间,其中NaNO3和发酵时间、K2HPO4和发酵时间的交互作用对发酵液杀线活性影响显著,这与表7的分析结果相吻合。

图1 发酵时间、硝酸钠和磷酸氢二钾用量交互作用对杀线率影响的响应面及等高线Fig.1 Response surface plots and contour line of effects of interaction between fermentation time,NaNO3and K2HPO4addition on nematode mortality rate
3 结论
本试验以松材线虫为靶标线虫,在单因子的基础上,利用响应面法对海洋枝顶孢霉(Acremoniumsp.)BH0531产杀线活性物质的发酵条件进行了研究,结果得到优化后发酵液杀线率为88.00%,比方程预测值90.58%略低,而原始发酵条件下的杀线率为65.33%,说明优化后的发酵液杀线率活性比优化前提高了22.77%。但本研究是在实验室摇瓶条件下进行,要实现工业化大规模开发生产,还需进一步培养工艺的研究。
[1]冯志新.植物线虫学[M].北京:中国农业出版社,2001:113-121.
[2]杨 宁,段玉玺,陈立杰.植物寄生线虫生物防治中存在的问题及解决途径[J].植物保护,2006,32(4):4-9.
[3]廖金铃,彭德良,段玉玺.中国线虫学研究[M](第二卷).北京:中国农业科学技术出版社,2008:182-185.
[4]YANG L,HUANG Y,LIU J,et al.Lysinibacillus mangiferahumisp.nov,a new bacterium producing nematicidal volatiles[J].Anton Leeuw,2012,102(1):53-59.
[5]高淋淋,刘志明.植物根结线虫生物防治研究进展[J].广西植被,2015,28(1):32-35.
[6]ISMAIL A E.GrowingJatropha curcasandJatropha gossypiifoliaas a interculture with sunflower for control ofMeloidogyne javanicain Egypt[J].Int J Sust Agr Res,2014,1(2):39-44.
[7]杜海霞,蒙春蕾,王勇勇,等.海洋枝顶孢霉BH0531代谢产物对松材线虫形态和酶活的影响[J].中国酿造,2014,33(6):23-26.
[8]申佩娟,苗利华,李 娜.等.海洋枝顶孢霉BH0531发酵液对根结线虫卵及二龄幼虫的影响[J].中国酿造,2017,37(4):26-29.
[9]史晓讯.丝状海洋真菌杀线虫代谢物的性质及发酵条件研究[D].天津师范大学,2010.
[10]CHANDRA M,BARATA A,FERREIRA-DIAS S,et al.A response surface methodology study on the role of factors affecting growth and volatile phenol production byBrettanomyces bruxellensisISA 2211 in wine[J].Food Microbiol,2014,42(12):40-46.
[11]李文婧,赵祥颖,刘建军,等.γ-聚谷氨酸产生菌的发酵培养基优化[J].食品与发酵工业,2013,36(3):108-109.
[12]MONTGOMERY D C.Design and analysis of experiments[M].3rd ed.New York:John Wiley&Sons,1991:430-431.
[13]张天然,于长青.响应面法优化深黄被孢酶发酵生产花生四烯酸的培养条件[J].农产品加工学刊,2012(2):27-30.
[14]FIRATLIGIL-DURMUS E,EVRANUZ,O.Response surface methodology for protein extraction optimization of red pepper seed(Capsicum frutescens)[J].Food Sci Technol,2010,42(3):226-231.
[15]李陈陈,陈 钢,苏 伟,等.固体培养粗糙脉孢菌产番茄红素及抗氧化活性研究[J].中国酿造,2017,36(4):30-39.

