棕背鼠平性别的快速鉴定
马 芹,王元智,陆涛峰,李智昊,杨春文,陈洪岩*
(1.中国农业科学院哈尔滨兽医研究所,黑龙江省实验动物与比较医学重点实验室,哈尔滨 150009; 2.牡丹江师范学院,黑龙江 牡丹江 157011)
在野生啮齿类动物棕背鼠 平(Myodesrufocanus)的生态学研究中,对其进行性别鉴别是分析其种群动态的一项基本工作[1]。因棕背鼠 平是流行性出血热病毒、森林脑炎病毒及普马拉病毒等人兽共患病病原体的天然宿主[2-3],本实验室已开展棕背鼠 平的实验室繁育[4],拟将其培育成实验动物,以便构建人兽共患病感染动物模型,同时丰富实验动物资源。但在其实验室繁育过程中,因其性别不易判断,严重影响着分笼与繁殖。目前对棕背鼠 平的性别鉴定多依据肛门到尿生殖孔的距离及被毛、性情、乳头及外部生殖器官等指标[5-6]进行判断(图1),但棕背鼠 平活动敏捷、性情不温顺,不易抓取;幼龄时期的棕背鼠 平外部生殖器官又未显现,不能从外表准确区分雌雄;从肛门到尿生殖孔的距离及被毛进行观察,主观性较强,很难做到正确的性别分离。
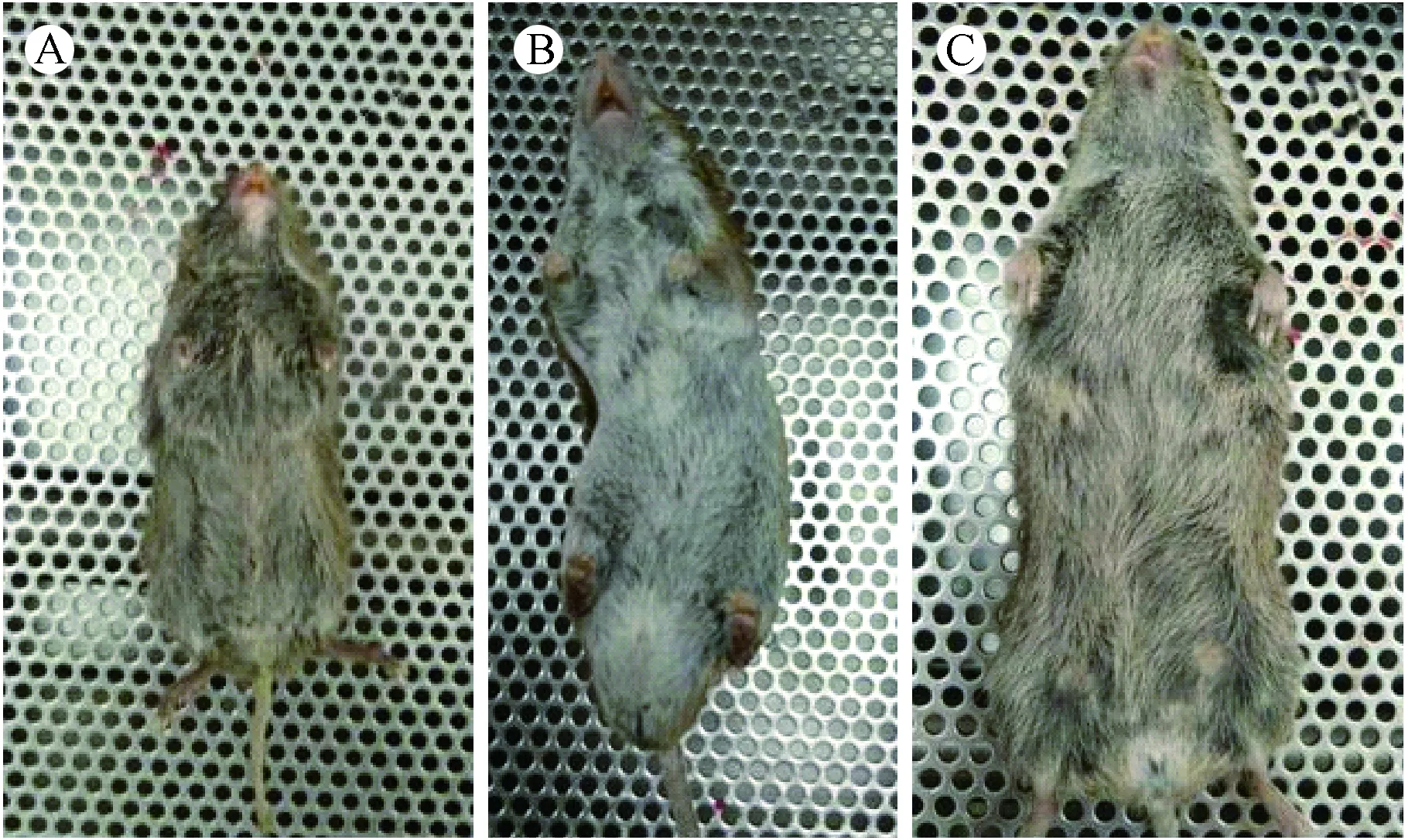
注:A:4周龄;B:成年雄性;C:成年雌性。图1 棕背鼠 平性别的表型判断Note. A: A 4-week-old grey red-backed vole; B: An adult male grey red-backed vole; C: An adult female grey red-backed vole.Fig.1 Phenotypic identification of the gender of grey red-backed voles
随着对性别决定理论的深度研究,用于动物性别鉴定的方法也在同步发展,尤其在分子生物学领域取得了较大进展。Page等[7]发现在Y染色体上存在一种可编码锌指蛋白的高度保守的基因序列,即锌指结构基因(zinc-finger Y,ZFY),该序列可能与性别决定有关;Schneider-Gädicke[8]在哺乳动物X染色体上也发现了与ZFY高度同源的基因,即ZFX基因,在无ZFY表达的小鼠上,睾丸的分化不受影响,因此,ZFY/ZFX基因不能决定性别。Sinclair等[9]发现在Y染色体短臂靠近常染色体的35 kb区域存在性别决定区(sex-determining region of the Y chromosome),即SRY基因。Koopman等[10]将SRY基因注入到雌性小鼠胚胎中,后期小鼠发育成雄性,证明了SRY基因为哺乳动物的性别决定基因。目前已在东北虎、黑熊、猫、牛等动物[1, 11-13]上用SRY基因进行了性别鉴定,正确率100%。本实验在棕背鼠 平实验室繁育研究[4]的基础上,利用PCR技术,以棕背鼠 平的新鲜毛囊为实验材料,从毛囊中提取DNA,利用SRY基因和ZFY/ZFX基因的双重PCR扩增对棕背鼠 平的性别进行鉴定,建立一种快速、准确、简便的性别鉴定方法。
1 材料和方法
1.1 实验动物
于黑龙江省牡丹江地区牡丹峰林地捕获的野生棕背鼠 平若干只,经隔离检疫后,饲养在中国农业科学院哈尔滨兽医研究所负压隔离环境感染动物实验设施内 [SYXK (黑) 2017-009],选取6只雄性成年、3只雌性成年及14只4周龄左右棕背鼠 平用于PCR方法鉴定棕背鼠 平性别;10只SPF级Wistar大鼠(5只雄性,体重310~320 g;5只雌性,体重230~240 g;9周龄)和8只SPF级BALB/c小鼠(5只雌性和3只雄性,体重21~23 g,6周龄),购自北京维通利华实验动物技术有限公司 [SCXK (京) 2016-0011],饲养在中国农业科学院哈尔滨兽医研究所负压隔离环境感染动物实验设施内。实验过程中按实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
Chelex-100 resin购于Sigma公司,蛋白酶K和2× EasyTaq SuperMix购于全式金生物技术有限公司,PCR仪购于杭州博日科技有限公司,DK-8D型电热恒温水槽购于上海精宏实验有限公司,凝胶成像分析系统购于北京赛智创业科技有限公司,其他常规试剂为分析纯。
1.3 实验方法
1.3.1 棕背鼠 平基因组DNA的提取
用镊子夹取棕背鼠 平被毛,挑选带有毛囊的5根,保留被毛根部,剪去其余部分,放入0.5 mL EP管中,加入0.3 mL ddH2O洗一次,然后加入30 μL 5%的Chelex-100和5 μL 5 mg/mL的蛋白酶K,置于56℃恒温水浴保温6 h。取出后振荡,100℃保温8 min,充分振荡,13 000 r/min离心3 min,DNA存在于上清中,-20℃保存上清备用。
1.3.2 引物合成
[14]设计并合成扩增ZFY/ZFX基因片段的引物:P1∶5’-ATAATCACATGGAGAGCCACAA GCT-3’,P2∶5’-GCACTTCTTTGGTATCTGAGAAA GT-3’;针对鼠的SRY基因设计并合成用于性别鉴定的引物:P3∶5’-TGTGGTCTCGTGGTCAGAGG-3’,P4∶5’-CGGCTTCTGTAAGGCGTTTC-3’。引物均由哈尔滨博仕生物技术有限公司合成。
1.3.3 PCR扩增
以提取的毛囊DNA为模板,分别构建ZFY/ZFX基因和SRY基因PCR扩增体系50 μL:2× EasyTaq PCR SuperMix 25 μL,DNA模板1 μg,P1(P3)引物1 μL,P2(P4)引物1 μL,ddH2O 22 μL。反应程序为94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸60 s,35个循环;72℃延伸10 min。扩增产物经琼脂糖凝胶电泳检测,扩增条带大小与目的条带一致时进行测序分析。
1.3.4 双重PCR扩增
将扩增ZFY/ZFX基因和SRY基因的引物同时加入到一个PCR反应体系内,建立双重PCR扩增方法。扩增体系为:2× EasyTaq PCR SuperMix 25 μL,DNA模板1 μg,P1引物1 μL,P2引物1 μL,P3引物0.6 μL,P4引物0.6 μL,ddH2O 20.6 μL。反应程序同PCR扩增。同时优化退火温度、引物浓度及琼脂糖凝胶浓度,确定最佳的双重PCR扩增条件。当扩增片段仅有一个(ZFY/ZFX445/447 bp)时,说明该棕背鼠 平不存在SRY基因位点,性别为雌性;当扩增片段有两个(ZFY/ZFX445/447 bp和SRY108 bp)时,说明该棕背鼠 平的性别为雄性;当没有扩增片段时,说明PCR扩增体系构建失败,不能对棕背鼠 平的性别进行鉴定。
1.3.5 性别鉴定
选取23只棕背鼠 平(表型判断为6只雄性,3只雌性,其余鼠性别经解剖结果进行判断)、10只Wistar大鼠(5只雄性,5只雌性)和8只BALB/c小鼠(3只雄性,5只雌性),获取其带有毛囊的新鲜被毛,Chelex-100提取基因组DNA。利用上述建立的双重PCR扩增方法进行性别鉴定。
2 结果
2.1 PCR扩增
选取雄性、雌性棕背鼠 平各一只,利用Chelex-100提取毛囊中DNA,分别以雄、雌DNA为模板,P1和P2为引物建立PCR反应体系,扩增ZFY/ZFX基因片段,产物经琼脂糖凝胶电泳显示,雌、雄性棕背鼠 平均有扩增条带(图2),片段大小与ZFY/ZFX目的片段一致,经测序后分析为ZFX基因。同时,以P3和P4为引物,扩增SRY基因片段,结果显示雄性有与SRY基因目的片段大小一致的条带,测序分析为鼠的SRY基因,而雌性未扩增出条带(图2)。
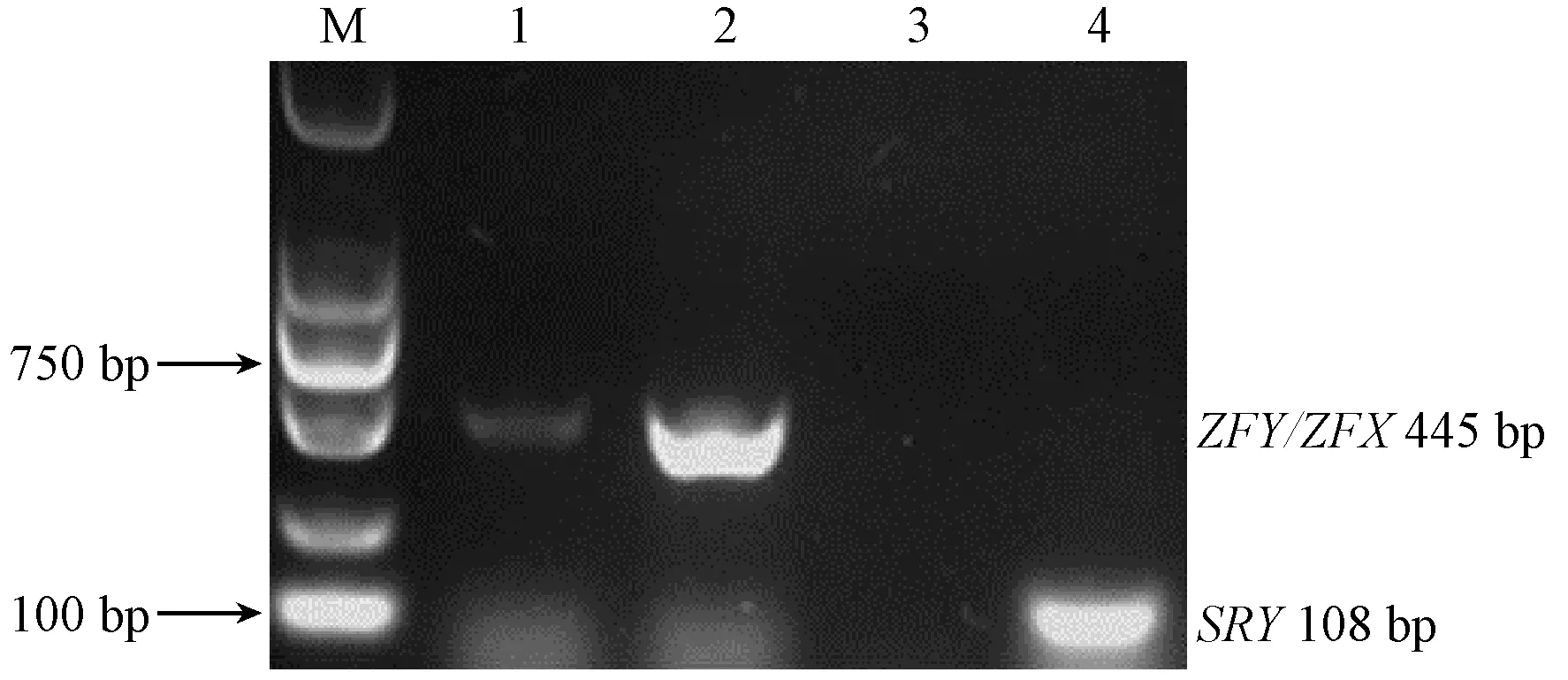
注:M:DL 2000 DNA Marker;泳道1和2:ZFY/ZFX基因扩增;泳道3和4:SRY基因扩增。泳道1和3:雌性棕背鼠 平;泳道2和4:雄性棕背鼠 平。图2 棕背鼠 平SRY基因和ZFY/ZFX基因的PCR扩增结果Note. M: DL 2000 DNA Marker; Lane 1 and 2: PCR products of the ZFY/ZFX gene; Lane 3 and 4: PCR products of the SRY gene. Lane 1 and 3: Female voles; Lane 2 and 4: Male voles.Fig.2 PCR amplification products of the SRY and ZFY/ZFX genes in grey red-backed voles
2.2 双重PCR扩增
分别以雄性、雌性棕背鼠 平毛囊DNA为模板,构建ZFY/ZFX基因和SRY基因双重PCR扩增体系,结果显示雄性可扩增出两条片段(ZFX445 bp和SRY108 bp);而雌性只扩增出一条片段(ZFX445 bp),未扩增出SRY基因片段;阴性对照无条带(图3)。实验重复操作3次,扩增结果一致,稳定性较好,双重PCR扩增体系构建成功。通过对扩增条件的优化,退火温度为55℃时扩增的PCR产物在3%琼脂糖凝胶电泳下观察效果最佳。
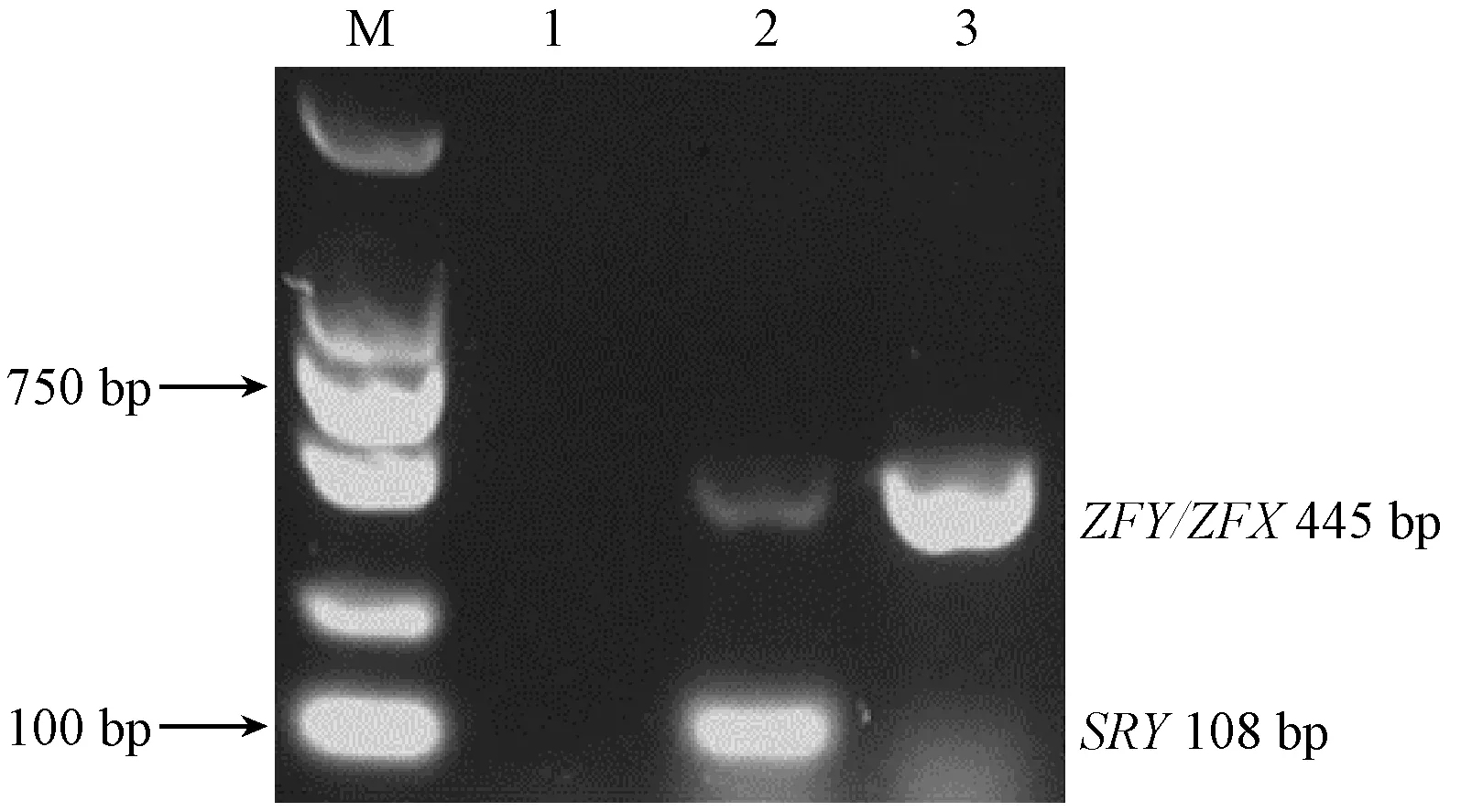
注:M:DL 2000 DNA Marker;泳道1~3:分别为阴性对照、雄性棕背鼠 平、雌性棕背鼠 平。图3 雌、雄性棕背鼠 平SRY基因和ZFY/ZFX基因的双重PCR扩增结果Note. M: DL 2000 DNA Marker; Lane 1-3: Negative control, male and female grey red-backed voles, respectively.Fig.3 Amplification products of the SRY and ZFY/ZFX genes in male and female grey red-backed voles by the double PCR assay
2.3 性别鉴定
获取23只棕背鼠 平、10只Wistar大鼠及8只BALB/c小鼠的新鲜毛囊,提取基因组DNA,利用本实验建立的ZFY/ZFX基因和SRY基因双重PCR扩增方法,对23只棕背鼠 平进行性别鉴定,结果(图4)显示前9只已知性别的棕背鼠 平检测结果与表型判断
一致,其中6只同时扩增出ZFY/ZFX基因和SRY基因片段,为雄性;3只仅扩增出ZFY/ZFX基因片段,没有扩增出SRY基因片段,为雌性;其余未知性别的14只棕背鼠 平,鉴定为结果显示7只为雄性,7只为雌性,与解剖结果一致(图5)。PCR扩增结果显示10只Wistar大鼠中5只为雄性,5只为雌性;8只BALB/c小鼠中5只为雌性,3只为雄性,与解剖结果一致,说明建立的双重PCR扩增方法同样适用于大鼠和小鼠的性别鉴定。
3 讨论
对动物进行性别鉴定时,大多数PCR方法以动物的组织为实验材料,对于一些性情凶猛、活动敏捷、不易抓取和固定的动物,获取其组织材料比较困难。另外,从动物福利的角度出发,我们应尽量减少对动物的伤害。已有文献证实以动物被毛为材料进行性别鉴定是完全可靠的,正确率100%[1]。本实验以棕背鼠 平的被毛为实验材料,利用Chelex-100提取毛囊中的DNA,并以提取的DNA作为PCR扩增的模板,该方法不仅不损害研究对象,采样和DNA的提取也更加快捷,实验结果准确可靠,还可以降低实验成本。
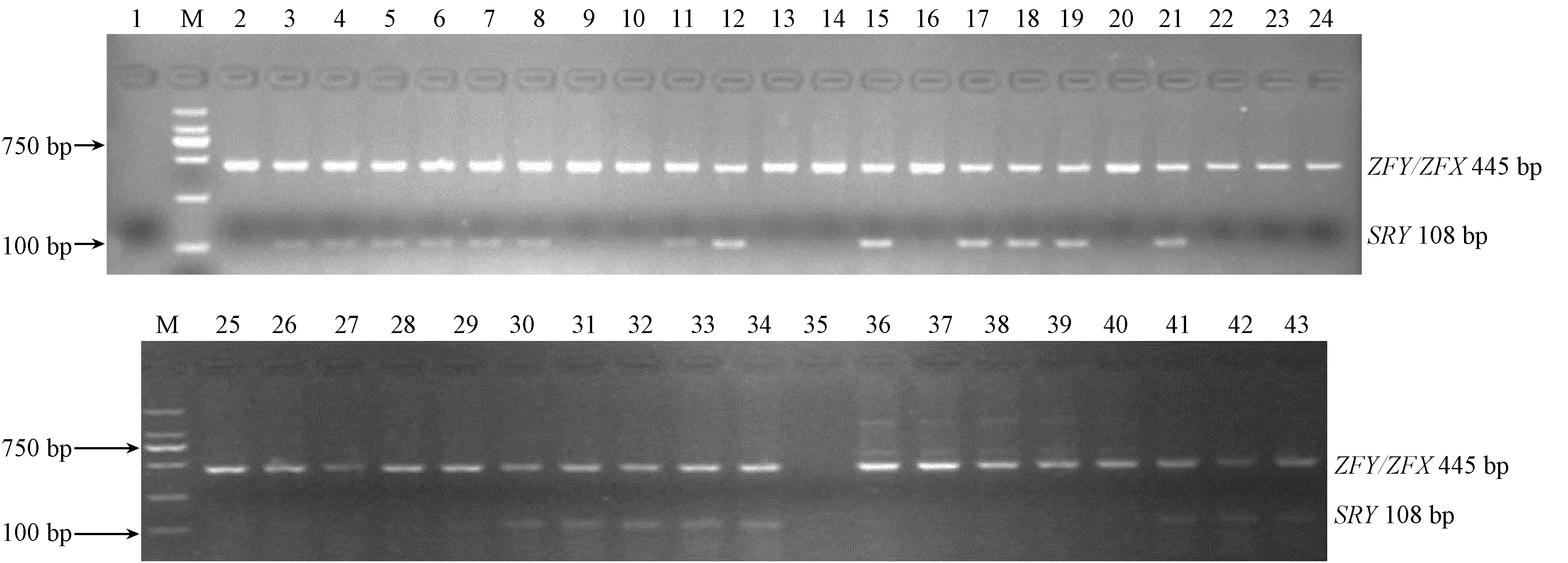
注:M:DL 2000 DNA Marker;泳道1和35:阴性对照;泳道2~24:分别为棕背鼠 平样品1~23;泳道25~34:分别为Wistar大鼠样品1~10;泳道36~43:分别为BALB/c小鼠样品1~8。图4 棕背鼠 平、Wistar大鼠和BALB/c小鼠的性别鉴定Note. M: DL 2000 DNA Marker; Lane 1 and 35: Negative control; Lane 2-24: Samples 1-23 taken from grey red-backed voles, respectively; Lane 25-34: Samples 1-10 taken from Wistar rats, respectively; Lane 36-43: Samples 1-8 taken from BALB/c mice, respectively.Fig.4 Gender identification of the grey red-backed voles, Wistar rats and BALB/c mice
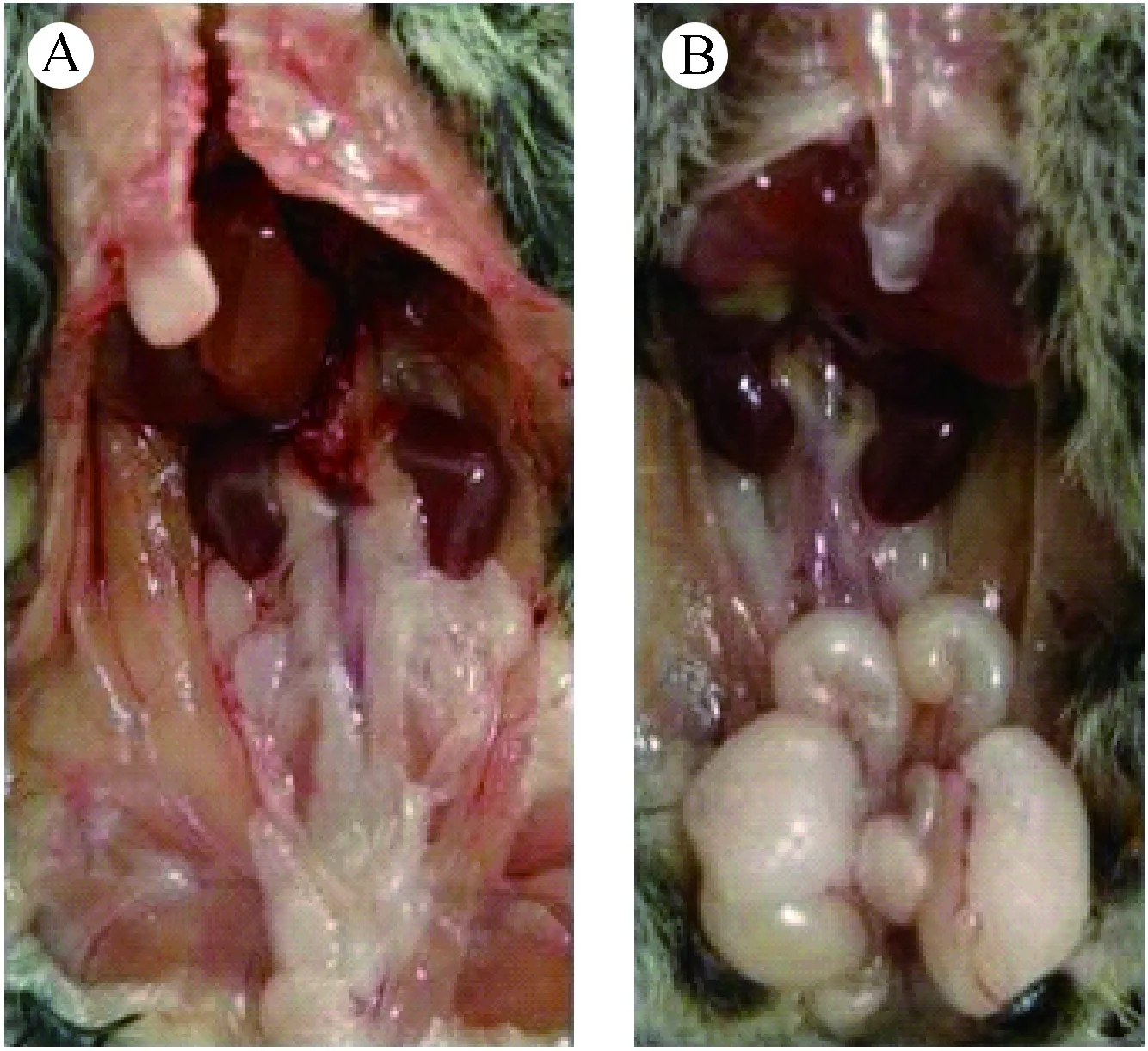
注:A:雌性;B:雄性。图5 棕背鼠 平性别的解剖结果Note. A: Female; B: Male.Fig.5 Autopsy results demonstrating the gender identification of grey red-backed voles
与常规PCR方法(只针对雄性特异性基因进行一次扩增)不同,本实验构建了ZFY/ZFX基因和SRY基因的双重PCR扩增,以ZFY/ZFX基因作为PCR扩增的内参照,防止因PCR扩增SRY基因失败造成假阴性,该方法提高了准确率,同时也增加了
模板的利用率。本实验针对ZFY/ZFX基因和SRY基因建立的双重PCR方法,能够对棕背鼠 平的性别做出正确判断,具有快速、准确、简便等优点,可广泛应用于野生动物研究领域以及实验室繁育中的性别鉴定。该方法也可能存在一些局限性,对一些性别与正常情况不同,如Y染色体SRY基因缺失个体、染色体组型为XXY、XXX等个体,该方法不能做出正确鉴定,但这种情况在自然状态下发生的几率非常小[1],可以忽略。通过利用针对ZFY/ZFX基因和SRY基因建立的双重PCR扩增方法,可以对棕背鼠 平的性别做出正确判断,合理安排分笼和繁殖,将对棕背鼠 平的实验室繁育有重要影响。
参考文献:
[1] 徐艳春, 马立新, 白素英, 等. 应用PCR方法通过毛发进行哺乳动物性别鉴定 [J]. 东北林业大学学报, 2000, 28(6): 72-77.
[2] 魏仰华, 王风臣, 何亦祥, 等. 大林姬鼠棕背鼠 平引起流行性出血热爆发流行调查报告 [J]. 人民军医, 1983, 34(11): 26-29.
[3] 姚李四. 中朝长白山毗邻口岸区域鼠类和体表寄生虫及其携带病原初步研究 [D]. 中国人民解放军军事医学科学院, 2012.
[4] 王元智, 马芹, 陆涛峰, 等. 棕背鼠 平的实验室繁育 [J]. 中国实验动物学报, 2017, 25(2): 169-173.
[5] 牛永东, 程訸, 石刚刚. 新生仔鼠早期性别的快速鉴定 [J]. 汕头大学医学院学报, 2014, 21(1): 22-23.
[6] 王淑香, 闫明伟, 王远东, 等. 麝鼠的性别鉴定 [J]. 黑龙江畜牧科技, 2000, 28(1): 40.
[7] Page DC, Mosher R, Simpson EM, et al. The sex-determining region of the human Y chromosome encodes a finger protein [J]. Cell, 1987, 51(6): 1091-1104.
[8] Schneider-Gädicke A, Beer-Romero P, Brown LG, et al. ZFX has a gene structure similar to ZFY, the putative human sex determinant, and escapes X inactivation [J]. Cell, 1989, 57(7): 1247-1258.
[9] Sinclair AH, Berta P, Palmer MS, et al. A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif [J]. Nature, 1990, 346(6281): 240-244.
[10] Koopman P, Gubbay J, Vivian N, et al. Male development of chromosomally female transgenic forSry[J]. Nature, 1991, 351(6322): 117-121.
[11] 王晗. PCR法进行小鼠和牛的性别鉴定 [D]. 西北农林科技大学, 2005.
[12] 武建中, 田青. 聚合酶链式反应在小鼠雄性胚胎性别鉴定中的优化研究 [J]. 黑龙江畜牧兽医, 2015, 58(9): 92-94.
[13] 潘求真, 冯国兴, 郑晓亮, 等. 利用多重PCR技术快速鉴定小鼠的性别 [J]. 黑龙江畜牧兽医, 2010, 53(19): 125-126.
[14] Chen Y, Dong Y, Xiang X, et al. Sex determination ofMicrotusmandarinusmandarinusis independent ofSrygene [J]. Mamm Genome, 2008, 19(1): 61-68.

