肝移植术后急性肾损伤的发生率及危险因素
岳 竹 李 昂 刘 培 白 静 庄海舟段美丽*
(1.首都医科大学附属北京友谊医院重症医学科,北京 100050;2.首都医科大学附属北京潞河医院重症医学科,北京 101149; 3.首都医科大学附属北京地坛医院重症医学科,北京 100015)
急性肾损伤(acute kidney injury,AKI)是肝移植术后常见合并症,其发生率因诊断标准的不同,从5.6%[1]到60.5%[2]不等,肝移植术后急性肾损伤的发生与患者住院时间的延长、移植肝近期及远期预后、病死率的增加均密切相关[3-4]。
目前国内外文献报道[2,5-8]有关肝移植术后发生AKI的各种危险因素包括术前终末期肝病模型(model for end-stage liver disease,MELD)评分、术中大量失血及输血[2-3,5-6,9]、肝源[10-11]、围术期低蛋白血症[5]、术中使用羟乙基淀粉[12]、病毒性肝炎、高乳酸血症[8]、体质量>100 kg[3]、体质量指数(body mass index,BMI)>27.5 kg/m2[5]、手术时间及热缺血时间[5,8],大量含氯液体的使用[13]、利尿剂的使用[14]、肾毒性免疫抑制剂的使用[9]、再灌注损伤综合征[5,15]、术前糖尿病[2]、移植物早期功能不全[1]等。
1 对象与方法
1.1 研究对象
回顾性收集2013年6月1日至2016年10月31日入住首都医科大学附属北京友谊医院重症医学科肝移植术后成年患者共124例,其中,男性90例,女性34例,年龄20~75岁,AKI患者68例,男性51例,女性17例,年龄20~75岁,非AKI患者56例,男性39例,女性17例,年龄29~75。术后28 d内发生AKI的患者68例,AKI发生率54.8%。排除标准:①肝肾联合移植的患者;②既往行肾移植的患者;③二次肝移植的患者;④终末期肾病依赖透析的患者;⑤术前诊断AKI的患者。本研究获首都医科大学附属北京友谊医院伦理委员会批准免知情同意,伦理批准文号:2017-P2-035-01。
1.2 诊断标准
AKI诊断及分期依据改善全球肾脏病预后组织(Kidney Disease: Improving Global Outcomes, KDIGO)指南[16],满足以下任意一条(未分级):血肌酐(serum creatinine,SCr)增加≥0.3 mg/dL(≥26.5 μmol/L)在48 h之内;SCr升高≥1.5倍基线值(确认或推测7 d内发生);尿量<0.5 mL·kg-1·h-1达6 h即可诊断AKI。肾功能恢复定义为AKI诊断标准不再成立。
1.3 数据收集
1)基线资料:年龄、性别、BMI、慢性病史包括高血压、糖尿病、肝病分型、是否存在门脉高压、腹水、肝肾综合征、慢性肾脏病(chronic kidney disease,CKD)、使用肾毒性药物、肝性脑病及术前感染。
2)术前临床资料:MELD评分、急性生理学和慢性健康评分Ⅱ(Acute Physiology and Chronic Health EvaluationⅡ,APACHE Ⅱ)、非肾器官功能障碍(sequential organ failure,SOFA)评分、乳酸、肌酐、尿素氮、总胆红素、丙氨酸氨基转移酶(alanine transaminase,ALT)、门冬氨酸氨基转移酶(aspartate transaminase,AST)、白蛋白、血色素、血小板。
3)术中临床资料: 肝源、手术时间、腔静脉阻断时间、热缺血时间、冷缺血时间、放腹水量、出血量、输血浆量、输晶体液量、输胶体液量、使用利尿剂或升压药。
4)术后临床资料:抗排异方案、是否使用利尿剂或升压药、是否输血、是否二次手术及手术目的、术后24 h及48 h液体平衡、非肾SOFA评分及实验室化验指标。呼吸机使用时间、ICU住院时间、总住院时间、28 d转归、肾功能恢复情况等。
1.4 统计学方法

2 结果
2.1 AKI组与非AKI组基线资料的比较
基线资料中肝性脑病在AKI与非AKI患者中差异有统计学意义(P<0.05),肝病分型两组间差异无统计学意义(P>0.05),详见表1、2。
2.2 AKI组与非AKI组术前临床资料的比较
术前临床资料MELD评分、APACHEⅡ评分、非肾SOFA评分、乳酸、肌酐、尿素氮、总胆红素、ALT、AST、白蛋白、血红蛋白、血小板,在AKI及非AKI患者中差异无统计学意义(P>0.05),详见表3。
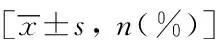
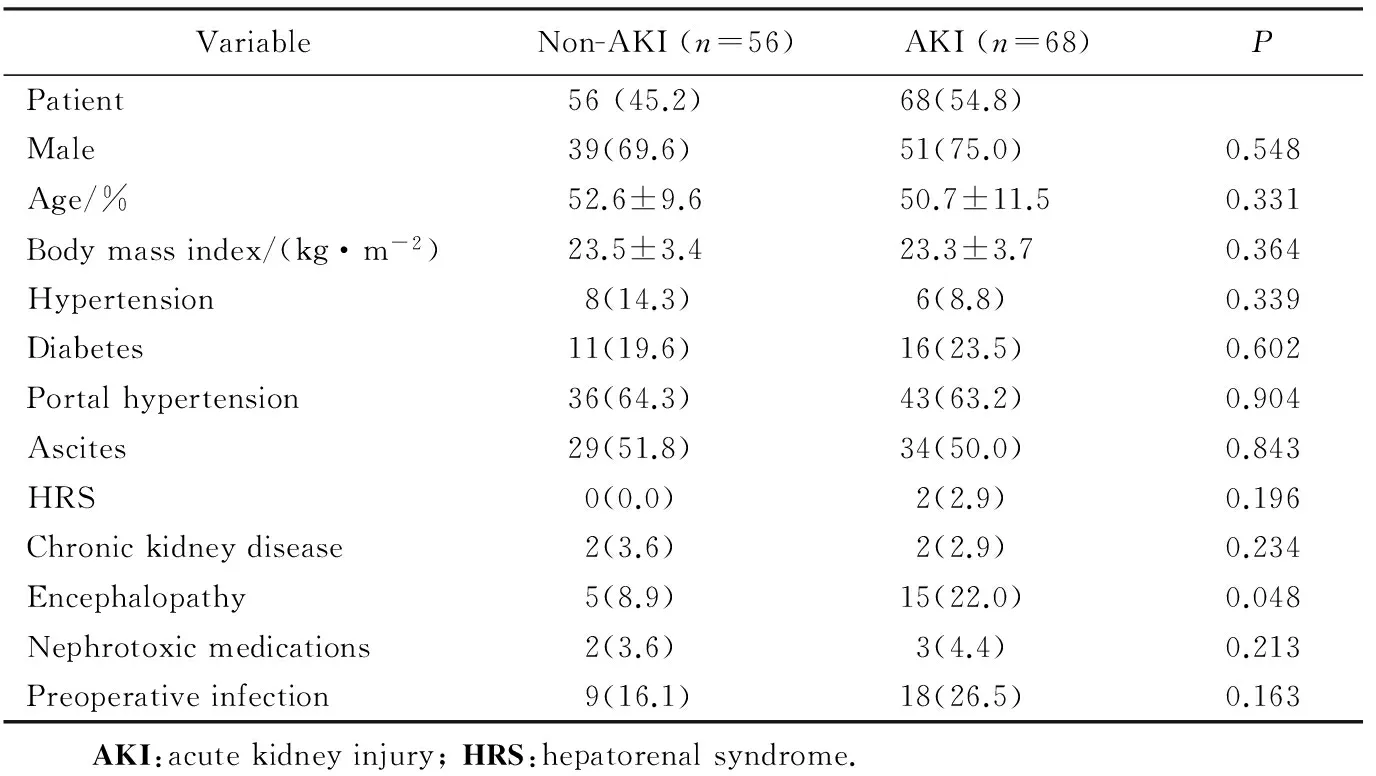
VariableNon-AKI(n=56)AKI(n=68)PPatient56(45.2)68(54.8)Male39(69.6)51(75.0)0.548Age/%52.6±9.650.7±11.50.331Bodymassindex/(kg·m-2)23.5±3.423.3±3.70.364Hypertension8(14.3)6(8.8)0.339Diabetes11(19.6)16(23.5)0.602Portalhypertension36(64.3)43(63.2)0.904Ascites29(51.8)34(50.0)0.843HRS0(0.0)2(2.9)0.196Chronickidneydisease2(3.6)2(2.9)0.234Encephalopathy5(8.9)15(22.0)0.048Nephrotoxicmedications2(3.6)3(4.4)0.213Preoperativeinfection9(16.1)18(26.5)0.163 AKI:acutekidneyinjury;HRS:hepatorenalsyndrome.

表2 肝病分型Tab.2 Types of liver disease
2.3 AKI组与非AKI组术中临床资料的比较
术中临床资料中肝源(AKI组64名患者使用尸肝,非AKI组52名患者使用尸肝)、手术时间、热缺血时间、冷缺血时间、放腹水量、输血浆量、输晶体液量、输胶体液量、使用利尿剂或升压药在AKI组和非AKI组患者中差异无统计学意义(P>0.05),失血量和输红细胞量、液体平衡、低血压(平均动脉压<65 mmHg, 1 mmHg=0.133 kPa)时间、呋塞米用量在AKI及非AKI患者间差异有统计学意义(P<0.05),详见表4。
2.4 AKI组与非AKI组术后临床资料的比较
124名患者中68名患者发生AKI,其中67名患者AKI发生在术后48 h内,仅1名患者AKI发生在术后第12天。10名行肾脏替代治疗患者均为3期患者。所有肝移植患者术后均采用甲强龙联合普乐可复联合抗排异治疗方案。术后24 h临床资料AKI组乳酸、肌酐、累计液体正平衡及非肾SOFA评分高于非AKI组,低血压时间长于非AKI组,且两组间差异有统计学意义(P<0.05)。术后48 h临床资料AKI组肌酐、非肾SOFA评分高于非AKI组,血红蛋白、血小板低于非AKI组,低血压时间长于非AKI组,且两组间差异有统计学意义(P<0.05)。AKI组使用利尿剂、升压药、输血、二次手术、行血滤治疗均较非AKI增加,两组间差异具有统计学意义(P<0.05),使用肾毒性药物两组间差异无统计学意义(P>0.05)。
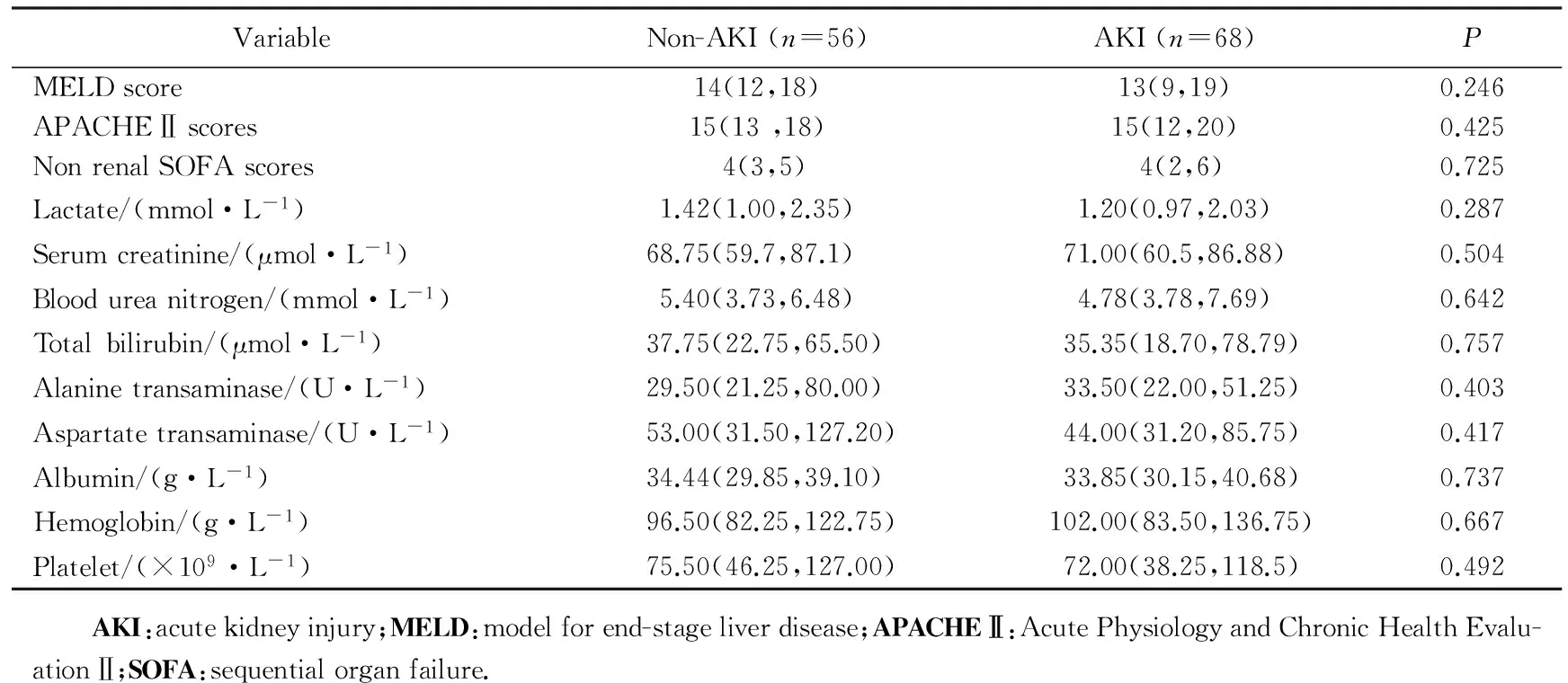
表3 AKI组与非AKI组术前临床资料比较Tab.3 Clinical data preoperation of the two groups M(P25, P75)
表4
AKI组与非AKI组术中临床资料比较
Tab
.
4
Clinical
data
intraoperation
of
the
two
groups
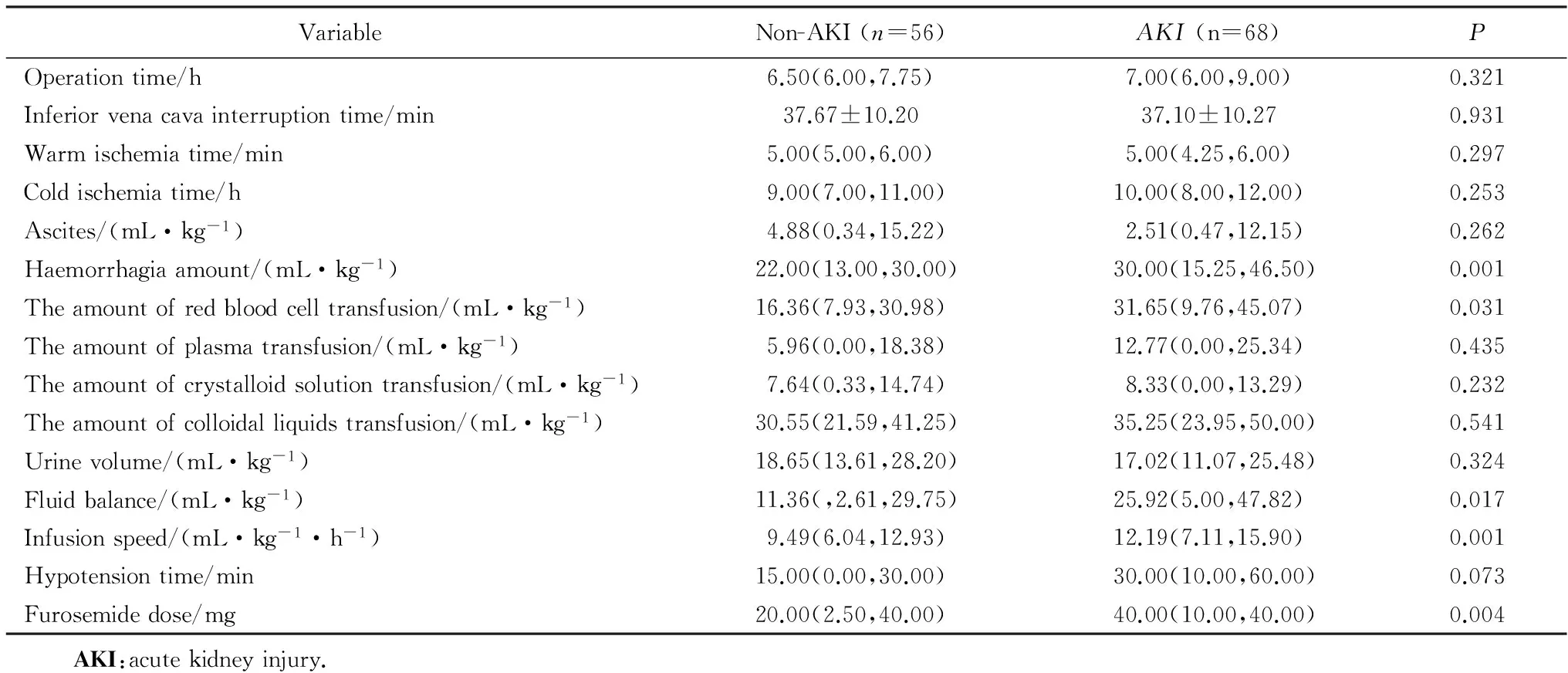
VariableNon-AKI(n=56)AKI(n=68)POperationtime/h6.50(6.00,7.75)7.00(6.00,9.00)0.321Inferiorvenacavainterruptiontime/min37.67±10.2037.10±10.270.931Warmischemiatime/min5.00(5.00,6.00)5.00(4.25,6.00)0.297Coldischemiatime/h9.00(7.00,11.00)10.00(8.00,12.00)0.253Ascites/(mL·kg-1)4.88(0.34,15.22)2.51(0.47,12.15)0.262Haemorrhagiaamount/(mL·kg-1)22.00(13.00,30.00)30.00(15.25,46.50)0.001Theamountofredbloodcelltransfusion/(mL·kg-1)16.36(7.93,30.98)31.65(9.76,45.07)0.031Theamountofplasmatransfusion/(mL·kg-1)5.96(0.00,18.38)12.77(0.00,25.34)0.435Theamountofcrystalloidsolutiontransfusion/(mL·kg-1)7.64(0.33,14.74)8.33(0.00,13.29)0.232Theamountofcolloidalliquidstransfusion/(mL·kg-1)30.55(21.59,41.25)35.25(23.95,50.00)0.541Urinevolume/(mL·kg-1)18.65(13.61,28.20)17.02(11.07,25.48)0.324Fluidbalance/(mL·kg-1)11.36(,2.61,29.75)25.92(5.00,47.82)0.017Infusionspeed/(mL·kg-1·h-1)9.49(6.04,12.93)12.19(7.11,15.90)0.001Hypotensiontime/min15.00(0.00,30.00)30.00(10.00,60.00)0.073Furosemidedose/mg20.00(2.50,40.00)40.00(10.00,40.00)0.004 AKI:acutekidneyinjury.
2.5 影响肝移植患者术后发生AKI的高危因素
在单因素回归分析中,单因素分析差别有统计学意义指标均进行Logistic回归分析,采用向后推进法筛除掉无意义指标,结果显示术中低血压时间(OR=1.020,95%CI: 1.004~7.033,P=0.021)、术中失血量(OR=1.036,95%CI: 1.021~1.057,P=0.028)和术中液体正平衡(OR=1.015,95%CI:1.002~2.972,P=0.033)是成年人患者肝移植术后发生AKI的危险因素。
2.6 预测AKI发生的ROC曲线模型
术中出血量、低血压时间和液体平衡在本研究中为肝移植术后发生AKI的危险因素,分别以上述结果为作为预测AKI发生的指标建立ROC曲线模型。ROC曲线中其界值分别为27.5 min、32.5 mL/kg、31.2 mL/kg,各危险因素的预测价值见表5。
2.7 AKI组与非AKI组预后的比较
在124例患者中,AKI 3期患者机械通气时间及ICU住院时间较非AKI患者及AKI 1期和2期患者增加,差异有统计学意义(P<0.05),总住院时间非AKI组与AKI各期之间差异有统计学意义(P<0.05),详见表6。AKI与非AKI患者病死率不高,仅3期患者中有2名患者28 d内死亡,组间差异无统计学意义(P>0.05)。大部分患者肾功能在28 d内恢复,仅3期患者中有7名患者肾功能在28 d内未恢复。
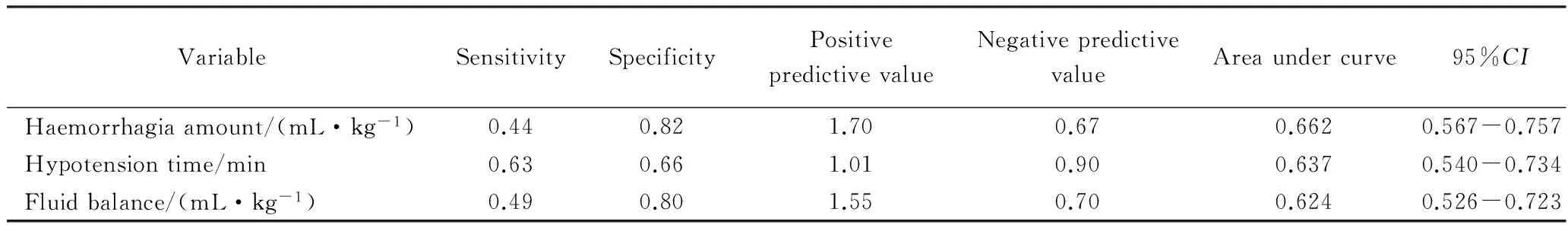
表5 危险因素的预测价值Tab.5 Predictive value of risk factors


TimeNon-AKI(n=56)AKI1stage(n=45)2stage(n=9)3stage(n=14)Ventilation/h7.50±3.8013.16±6.4917.8±2.7134.93±37.84ICU/d3.48±1.273.98±1.223.78±1.2015.93±5.11Hospital/d17.48±9.6835.22±12.4440.67±5.7444.57±16.33 AKI:acutekidneyinjury;ICU:intensivecareunit.
3 讨论
AKI是肝移植术后常见合并症,与肝移植患者机械通气时间延长、ICU住院时间及总住院时间延长密切相关,增加患者慢性肾功能不全的发生率及病死率。Hilmi等[3]在匹兹堡大学医疗中心进行的一项回顾性研究共纳入了424名肝移植患者,结果显示根据KDIGO诊断标准AKI的发生率为52%,术后发生AKI的患者病死率较未发生AKI组增加,术后发生AKI的患者住ICU时间及住院时间较未发生AKI患者延长且在术后3个月和1年发展为慢性肾功能不全和透析依赖的概率高于术后未发生AKI的患者。关于肝移植术后AKI的发生机制,目前知之甚少,荷兰的一项多中心研究[17]表明缺血再灌注损伤是肝移植术后发生AKI的重要因素,但尚无有效的预防措施, 因此,目前国内外有大量关于肝移植术后AKI危险因素的临床研究以期为减少肝移植术后AKI的发生,提高患者生存率及预后提供依据。
本研究中得出术中出血量、低血压时间及液体正平衡是成年人发生AKI的危险因素,这与既往多项研究[2-3,5-6,9]结果一致,但各危险因素的截点值因不同研究纳入人群及诊断标准不同各有差异,本研究中各项危险因素的截点值可为本单位肝移植患者围手术期管理提供理论依据。术后24 h及术后48 h临床资料显示AKI组患者非肾SOFA评分、肌酐、乳酸、累计液体正平衡高于非AKI组,低血压时间长于AKI组,血红蛋白及血小板低于非AKI组,这与AKI患者术后二次手术、使用利尿剂、使用升压药和输血的发生率明显高于非AKI患者结果一致,证明AKI组患者病情更重,这在以往研究中未曾报道过,可能与大多数研究仅纳入术前及术中相关指标而未收集术后相关指标有关。有关利尿剂增加患者AKI的发生率早在之前就有文献[18]报道过,但本研究收集患者术中使用利尿剂与AKI的发生并未得出阳性结果,术后AKI患者使用利尿剂增加是已经发生AKI的患者较非AKI患者更倾向于使用利尿剂。AKI的发生时间主要集中在术后48 h,仅有1例患者发生在术后第12天。本研究共纳入成年人患者124例,其肝移植术后AKI的发生率为54.8%,其中AKI组与非AKI组呼吸机使用时间、ICU住院时间差异无统计学意义(P>0.05),但AKI 3期患者呼吸机使用时间及ICU 住院时间较非AKI组及AKI1期及2期患者延长,差异有统计学意义(P<0.05),住院时间AKI组与AKI各级之间差异有统计学意义(P<0.05),AKI组较非AKI组总住院时间延长,而且AKI各组随AKI严重程度增加,总住院时间延长,这与文献[3]报道结果相一致。尽管AKI发生率高,但主要为1期,68名AKI患者中10名患者行肾脏替代治疗,均为3期患者,61名患者肾功能在28 d内恢复,28 d肾功能未恢复的7名患者均为3期患者,AKI患者病死率并不高,仅AKI 3期患者中有2名患者病死。从本研究结果可见,肝移植术后AKI发生率高,与患者住院时间延长、病死率增加相关,其发生受多种因素影响,其治疗除肾脏替代治疗外,尚无特殊有效治疗方法。有研究[19]显示富氢盐水对大鼠AKI的发生具有一定的保护作用,现在正在研究右旋美托咪啶(一种高选择性α2肾上腺素受体兴奋剂)在小鼠脓毒症急性肾损伤及原位自体肝移植后急性肾损伤模型中具有肾脏保护性作用,右旋美托咪啶通过抑制细胞膜表面受体4(toll like receptor 4, TLR4)/核因子-κB(nuclear factor kappa B, NF-κB)活化减少原位肝移植后小鼠AKI的发生,其作用机制与其肾上腺素α2受体激动作用有关[20],但在人类中尚缺乏相关的临床研究。另外目前也有研究证实术中使用血管加压素[21]、肝移植术后静脉应用非诺多泮(血管扩张药)[22]及丙泊酚[23-24]可改善肝移植术后急性肾损伤的预后,但均缺乏大量的临床研究证实。所以根据AKI发生的危险因素,尽量减少术中出血,合理应用血管活性药物维持血流动力学稳定,避免过度液体正平衡从而降低AKI的发生对肝移植患者改善预后具有重要意义。
[1] Wadei H M, Lee D D, Croome K P, et al. Early allograft dysfunction after liver transplantation is associated with short-and long-term kidney function impairment[J].Am J Transplant, 2016,16(3):850-859.
[2] Utsumi M, Umeda Y, Sadamori H,et al. Risk factors for acute renal injury in living donor liver transplantation: evaluation of the RIFLE criteria[J].Transplant Int,2013,26(8):842-852.
[3] Hilmi I A, Damian D, Al-Khafaji A, et al. Acute kidney Injury following orthotopic liver transplantation: incidence, risk factors, and effects on patient and graft outcomes[J].Br J Anaesth, 2015,114(6):919-926.
[4] Sang B H, Bang J Y, Song J G,et al. Hypo albuminemia within two postoperative days is an independent risk factor for acute kidney injury following living donor liver transplantation: a propensity score analysis of 998 consecutive patients[J].Crit Care Med,2015,43(12):2552-2561.
[5] Park M H, Shim H S, Kim W H,et al. Clinical risk scoring,models for prediction of acute kidney injury after living donor liver transplantation: a retrospective observational study[J].PLoS One, 2015,10(8): e0136230.
[6] Aksu Erdost H, Ozkardesler S, Ocmen E,et al. Acute renal injury evaluation after liver transplantation: with RIFLE criteria[J].Transplant Proc,2015,47(5):1482-1487.
[7] Romano T G, Schmidtbauer I, Silva F M,et al. Role of MELD score and serum creatinine as prognostic tools for the development of acute kidney injury after liver transplantation[J]. PLoS One,2013, 23,(5):e64089.
[8] Barreto A G,Daher E F, Silva Junior G B, et al. Risk factors for acute kidney injury and 30-day mortality after liver transplantation[J].Ann Hepatol, 2015,14(5):688-694.
[9] Smoter P, Nyckowski P, Grat M, et al. Risk factors of acute renal failure after orthotopic liver transplantation: single-center experience[J].Transplant Proc, 2014,46(8): 2786-2789.
[10] Leithead J A, Rajoriya N, Gunson B K,et al. The evolving use of higher risk grafts is associated with an increased incidence of acute kidney injury after liver transplantation[J].J Hepatol, 2014,60(6):1180-1186.
[11] Hilmi IA, Jiang H, Zhang X,et al. Acute kidney injury after orthotopic liver transplantation using living donor versus deceased donor grafts: A propensity score-matched analysis[J].Liver Transplant, 2015,21(9):1179-1185.
[12] Whiteley J R, Whiteley J R, Epperson T I, et al. Hydroxyethyl starch and acute kidney injury in orthotopic liver transplantation: a single-center retrospective review[J].Anesth Analg, 2015,120(3):619-626.
[13] Nadeem A, Salahuddin N, El Hazmi A,et al. Chloride-liberal fluids are associated with acute kidney injury after liver transplantation[J].Crit Care,2014,18(6):625.
[14] Klaus F,Keitel da Silva C, Meinerz G, et al. Acute kidney injury after liver transplantation:incidenceand mortality[J].Transplant Proc,2014,46(6):1819-1821.
[15] Leithead J A,Armstrong M J, Corbett C,et al. Hepatic ischemia reperfusion injury is associated with acute kidney injury following donation after brain death liver transplantation[J].Transplant Int, 2013,26(11):1116-1125.
[16] John A K, Peter A, Rashad S B, et al.KDIGO Clinical Practice Guidelines for acute kidney injury[J]. Nephron Clin Pract,2012,120(4):c179-184.
[17] Kalisvaart M,de Haan J E, Hesselink D A,et al. The postreperfusion syndrome associated with acute kidney injury following donation after brain death liver transplantation[J].Transplant Int, 2016,19(11):1116-1125.
[18] Levi T M,Rocha M S,Almeida D N, et al. Furosemide is associated with acute kidney injury in critically ill patients[J].Braz J Med Biol Res,2012,45(9):827-833.
[19] Du H,Sheng M,Wu L, et al. Hydrogen-Rich saline attenuates acute kidney injury after liver transplantation via activating p53-Mediated autophagy[J].Transplantation,2016,100(3):563-570.
[20] Yao H,Chi X, Jin Y,Krenn C G, et al. Dexmedetomidine inhibits TLR4/NF-κB activation and reduces acute kidney injury after orthotopic autologous liver transplantation in rats[J].Sci Rep,2015,20(5):16849.
[21] Mukhtar A, Mahmoud I, Obayah G,et al. Intraoperative terlipressin therapy reduces the incidence of postoperative acute kidney injury after living donor liver transplantation[J].J Cardiothorac Vasc Anesth,2015,29(3):678-683.
[22] Biancofiore G, Bindi M L, Miccoli M,et al. Intravenous fenoldopam for early acute kidney injury after liver transplantation[J].J Anesth,2015,29(3):426-432.
[23] Luo C,Yuan D, Li X,et al. Propofol attenuated acute kidney injury after orthotopic liver transplantation via inhibiting gap junction composed of connexin 32[J].Anesthesiology,2015,122(1):72-86.
[24] 李雪荣,宋亚华,李婵,等.综合护理干预在原发性肝癌肝动脉化疗栓塞术中的效果观察[J].中国煤炭工业医学杂志,2016,19(5):756-759.

