基于RAPD技术检测不同烃链长度咪唑基离子液体对日本三角涡虫的遗传毒性
张合彩,石长应,刘童祎,刘艳方,陈广文,刘德增
河南师范大学生命科学学院,新乡 453007
淡水涡虫隶属于扁形动物门(Platyhelminthes)、涡虫纲(Turbellaria)、三肠目(Tricladida)、淡水亚目(Paludicola),广泛分布于世界各地洁净的泉溪湖泊之中,是淡水生态系统的重要成员之一。由于涡虫对环境中的毒性因子非常敏感,亚致死剂量的农药、重金属等都会引起其从DNA分子到个体水平的损伤改变[1-4];此外,淡水涡虫易于大量采集且室内饲养成本相对较低,所有这些特点使得淡水涡虫成为毒理学研究的合适实验动物之一。日本三角涡虫(Dugesiajaponica)是东亚地区广泛分布的淡水涡虫物种,由于具有强大的再生能力及高度的化学敏感性,已逐渐成为再生药物、干细胞、神经疾病及毒理学研究的模式生物[5]。
离子液体(Ionic Liquids,ILs)是一类完全由离子构成,在室温或较低温度(<100 ℃)下呈液态的盐,也称为室温离子液体或低温熔融盐[6]。因其具有不挥发、不易燃、电导率高、蒸气压小、性质稳定、溶解性好、可设计性强等优良特性而在诸多工业领域广泛应用。但是随着研究的深入及应用范围的扩大,人们逐渐对离子液体的绿色性产生质疑,对其生物毒性及环境风险评价的相关研究屡见报道。由N,N -二烷基咪唑阳离子与阴离子构成的咪唑类离子液体具有易于制备、结构易于调控等优点,是目前应用和研究较多的离子液体[7]。关于离子液体对水藻[8]、浮萍[9]、大型蚤[10]、河蚌[11]以及斑马鱼[12]等水生生物的毒性测试已见诸报道,其中也有研究表明离子液体生物毒性的大小随其烃链长度的增加而增强。但是,迄今为止离子液体对淡水涡虫的毒性研究却鲜见报道。
彗星分析及染色体畸变曾被用于检测环境中有毒物质对涡虫的遗传毒性效应[1,13]。随着分子生物学的飞速发展,在遗传毒理学领域又出现了许多基于PCR技术的DNA分析方法。随机扩增多态性DNA(randomly amplified polymorphic DNA,RAPD)就是其中之一,该技术基于PCR,能从DNA 分子水平直接反映整个基因组的特征,快速、准确地检测基因组DNA因发生片段的插入、缺失或碱基的突变而产生的多态性信息[14]。RAPD技术最早用于遗传作图、分类及系统发育的多态性检测,后来又被用于遗传毒性及致癌作用分析[15]。目前,RAPD技术已成功用于污染物对动物、植物、微生物及体外培养细胞系的遗传毒性检测[16-20]。本文利用RAPD技术检测4种不同烃链长度的咪唑基离子液体对日本三角涡虫的遗传毒性,旨在考察咪唑基离子液体侧链长度与其遗传毒性大小的关系,从而为阐释离子液体的毒性机制奠定基础,同时也为离子液体环境风险评价和科学管理积累资料。
1 材料与方法(Materials and methods)
1.1 离子液体
实验用4种咪唑类离子液体溴化1-丁基-3-甲基咪唑([C4mim]Br)、溴化1-己基-3-甲基咪唑([C6mim]Br)、溴化1-辛基-3-甲基咪唑([C8mim]Br)、溴化1-癸基-3-甲基咪唑([C10mim]Br)均购自湖北恒硕化工有限公司(武汉)(图1),纯度大于99%,其中[C4mim]Br为白色晶体,其余均为淡黄色粘稠液体。实验前先用双蒸水分别配成2 000、1 500、1 000和100 mg·L-1的母液,密封保存于4 ℃冰箱内,实验时再根据需要稀释到相应浓度待用。

图1 离子液体溴化1-烷基-3-甲基咪唑结构式示意图注: R=C4H9: [C4mim]Br; R=C6H13: [C6mim]Br; R=C8H17: [C8mim]Br; R=C10H21: [C10mim]Br。Fig. 1 General structure of alkylmethylimidazolium-based ionic liquids (ILS)Note: R=C4H9: [C4mim]Br; R=C6H13: [C6mim]Br; R=C8H17: [C8mim]Br; R=C10H21: [C10mim]Br.
1.2 供试动物
实验用日本三角涡虫(D.japonica)采自河南省淇县鱼泉乡溪流中,用曝气自来水饲养于实验室内,每2周用新鲜的鱼脾脏饲喂一次,喂食后每2天换水一次。饥饿处理一周以上的涡虫方可用于毒理学实验。
1.3 毒性暴露与取样
根据石长应等[21]测定4种咪唑类离子液体对涡虫的半致死浓度(LC50)及预实验,分别设定其1/8LC50(即[C4mim]Br 260 mg·L-1、[C6mim]Br 115 mg·L-1、[C8mim]Br 39 mg·L-1、[C10mim]Br 4 mg·L-1)为本实验处理浓度。随机挑选形态正常、最大伸展体长(10±2) mm的涡虫个体25条,平均分为5组,每组5条,置于培养皿中。将其中1组设为对照组,用曝气自来水培养,另外4组设为处理组,分别用上述浓度的4种离子液体暴露处理。整个实验于恒温培养箱(20±1) ℃中进行,每24 小时更换一次处理液。在暴露处理的第3天和第5天分别从各处理组中随机挑取1条涡虫用于基因组DNA提取。
1.4 基因组DNA提取
涡虫基因组DNA的提取根据Zhang和Qiao[22]对蚜虫的提取方法稍作改动。单条涡虫加适量STE缓冲液(30 mmol·L-1Tris-HCl,200 mmol·L-1EDTA,50 mmol·L-1NaCl,pH 8.0)匀浆,然后加适量裂解液(30 mmol·L-1Tris-HCl,200 mmol·L-1EDTA,50 mmol·L-1NaCl,1% SDS,0.5 mg·mL-1proteinase K,pH 8.0)于55 ℃消化2~4 h至澄清,再用标准的酚-氯仿抽提法提取基因组DNA。所得DNA用冷乙醇沉淀,再经离心、冲洗、干燥后溶于40 μL TE缓冲液(30 mmol·L-1Tris-HCl,200 mmol·L-1EDTA,pH 8.0)中,残余RNA用RNase A于37 ℃消化除去。通过琼脂糖凝胶电泳检测所提DNA分子的质量(完整性),用NanoDrop 2000 微量分光光度计(基因公司)测定其浓度及纯度(OD260/OD280)。
1.5 RAPD-PCR扩增
根据张合彩等[23]优化的涡虫RAPD-PCR条件,对购自上海生工的20条随机引物进行筛选,筛选出的引物用于PCR扩增。PCR反应总体系为15 μL,含20 ng基因组DNA、0.2 μmol·L-1随机引物(上海生工)、2×Taq Master Mix(郑州森思科贸)。扩增反应在DNA thermocycler扩增仪(Biometra公司,德国)上进行,其反应程序为:94 ℃预变性5 min,然后94 ℃变性1 min,37 ℃退火1 min,72 ℃延伸2 min,共进行40个循环,之后终延伸5 min。扩增产物经1.5%琼脂糖凝胶电泳后,用GIS-1000凝胶自动成像系统(广州方统生物科技)拍照,用图像分析软件Genescope1.73对扩增产物大小进行自动评估。
1.6 基因组模板稳定性计算
基因组模板稳定性(GTS)依据公式GTS (%) = (1-a/n)×100计算,此处“a”为处理组的多态性条带数,“n”是对照组的总带数。RAPD图谱的多态性包括与对照组相比的新增带和消失带[24]。为便于比较,将对照组GTS设为100%,各处理组GTS以相对对照的百分数表示。
2 结果(Results)
2.1 基因组DNA及RAPD图谱的可重复性
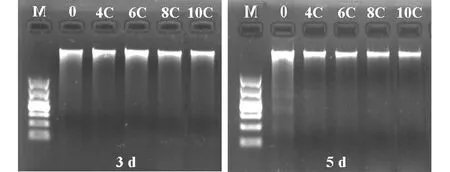
图2 经4种不同烃链长度咪唑类离子液体暴露3 d和5 d时的涡虫基因组DNA注:0, 对照组;4C, [C4mim]Br;6C, [C6mim]Br;8C, [C8mim]Br;10C, [C10mim]Br;M, DNA分子量标准(自上而下分别为10 000、7 000、4 000、2 000、1 000、500、250 bp)。Fig. 2 The quality of DNA isolated from Dugesia japonica exposed to imidazolium-based ILs with different alkyl-chain lengths for 3 and 5 daysNote: 0, Control; 4C, [C4mim]Br; 6C, [C6mim]Br; 8C, [C8mim]Br; 10C, [C10mim]Br; M, DNA molecular size marker (10 000, 7 000, 4 000, 2 000, 1 000, 500, 250 bp from top to bottom).

图3 引物S10扩增的涡虫RAPD图谱的可重复性注: M, DNA分子量标准(自上而下分别为2 000、1 000、750、500、250、100 bp)。Fig. 3 Reproducibility of RAPD profiles generated from planarian DNA by primer S10Note: M, DNA molecular size marker (2 000, 1 000, 750, 500, 250, 100 bp from top to bottom).
所提基因组DNA的OD260/OD280比值在1.7~2.2之间,说明各样品的纯度较高。电泳结果表明各DNA样品均为单条带,说明所提DNA分子完整性好,没有降解(图2)。引物S10对同一样品的扩增结果表明RAPD-PCR结果稳定,具有较强的可重复性(图3)。
2.2 4种不同烃链长度咪唑基离子液体对涡虫RAPD图谱的影响
在20条随机引物中只有11条(表1)能扩增出稳定且多态性较高的RAPD条带,其他9条无扩增或为弥散带(图4、表2)。RAPD图谱的变化主要表现在与对照相比条带亮度的增强或减弱以及新带的出现和正常带的消失。本研究中经4种不同烃链长度咪唑基离子液体暴露的涡虫RAPD 图谱与对照相比明显不同,且随着离子液体烃链长度的增加和暴露时间的延长发生明显改变,其中新增带(a)、消失带(b)、亮度增加带(c)以及亮度减弱带(d)的总数在5 d时4种离子液体组分别为63、66、74、80条(表2)。
总体而言,处理组新增带的条数不但与离子液体的碳链长度正相关而且与暴露的时间正相关(图4、表2)。暴露3 d时,离子液体处理组涡虫的新增带分别为12、16、18和20条。随着暴露时间的延长各处理组新增带的条数增加,至暴露5 d时4个处理组的新增带条数分别增至17、18、20和22条。
在11条引物的扩增图谱中,离子液体处理组均有正常条带的消失(图4、表2),并且消失带的条数也与离子液体的碳链长度及暴露时间正相关。暴露3 d时,离子液体处理组的消失带条数分别为14、16、17、19条。当暴露至5 d时,4个处理组涡虫RAPD图谱消失带的条数分别增至16、17、19和20条。此外,处理组涡虫RAPD图谱中亮度增强带和减弱带的总数一定程度上也随离子液体碳链长度的增加和暴露时间的延长而增加,即与之存在正相关关系。
2.3 基因组模板稳定性(GTS)
基因组模板稳定性(GTS)是反应处理组PCR扩增谱相对对照组改变的百分比值。对每一条引物而言,其扩增的多态性条带随离子液体碳链长度(4、6、8、10)和暴露时间(3 d、5 d)而异(表2)。我们根据筛选出来的11条引物扩增的RAPD图谱计算出了各处理组总的GTS值(图5)。4种不同烃链长度的咪唑基离子液体处理组涡虫在暴露3 d和5 d时的GTS值分别为60%、51%、46%、40%和49%、46%、40%、35%,即对于同样暴露时间随着离子液体碳链长度的增加各处理组涡虫基因组模板稳定性下降;而对于同一种离子液体,则随着暴露时间的延长其GTS值降低。
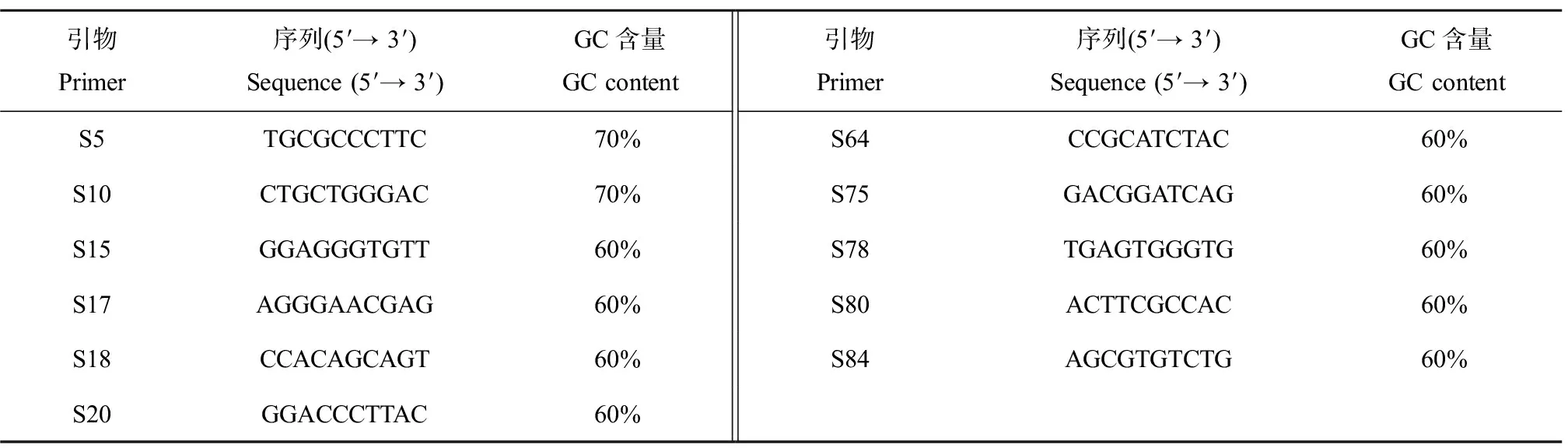
表1 本实验所用引物Table 1 Primers used in this experiment
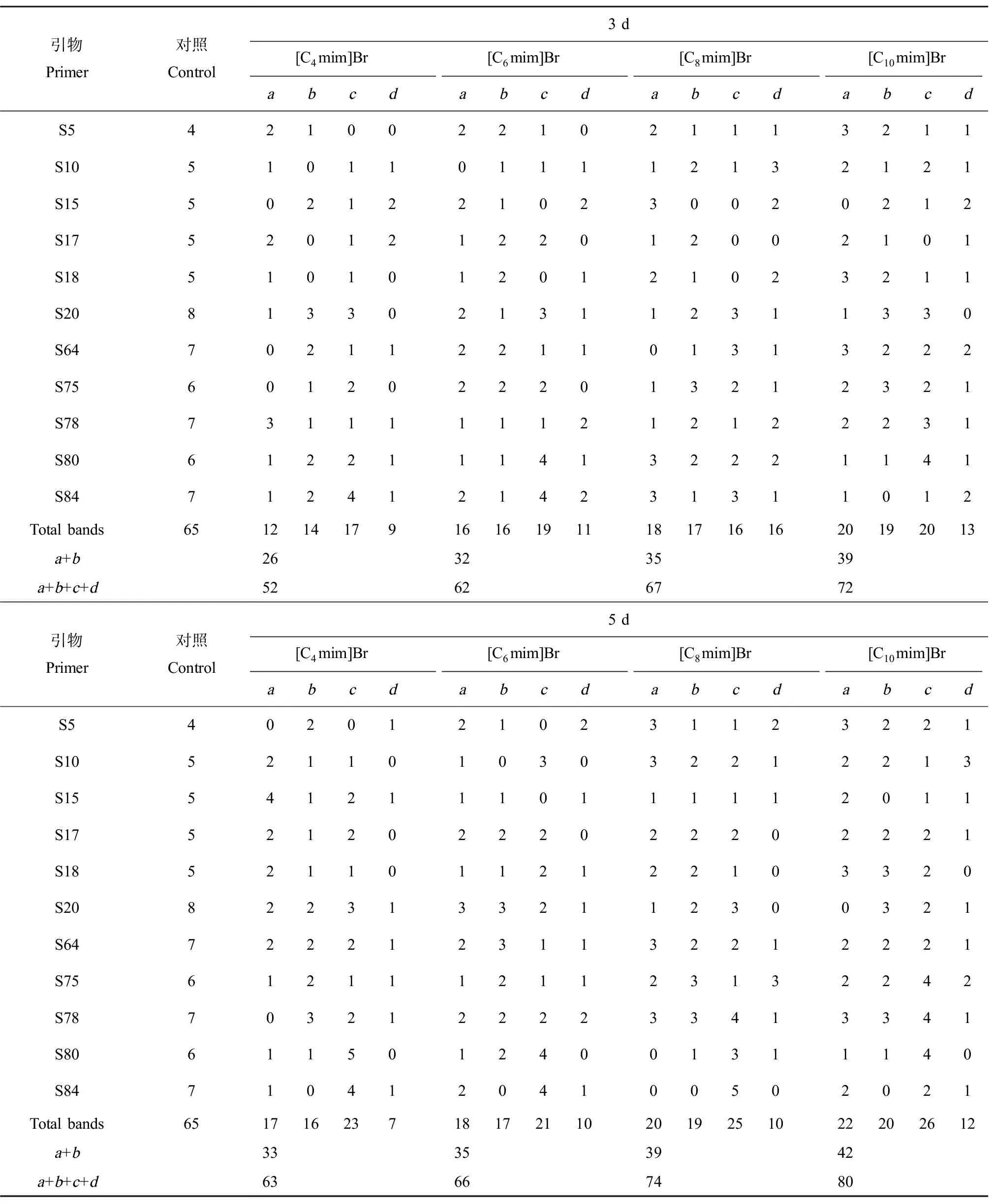
表2 4种不同烃链长度咪唑基离子液体处理3 d和5 d时涡虫的RAPD图谱多态性带及变异带Table 2 Polymorphic bands and varied bands in Dugesia japonica treated by 4 kinds of imidazolium-based ILs with different alkyl-chain length for 3 and 5 days
注:a, 新增带;b, 消失带;c, 亮度增强带;d, 亮度减弱带;a+b, 多态性带;a+b+c+d, 变异带。
Note:a, appearance of new bands;b, disappearance of normal bands;c, increase in band intensities;d, decrease in band intensities;a+b, polymorphic bands;a+b+c+d, varied bands.
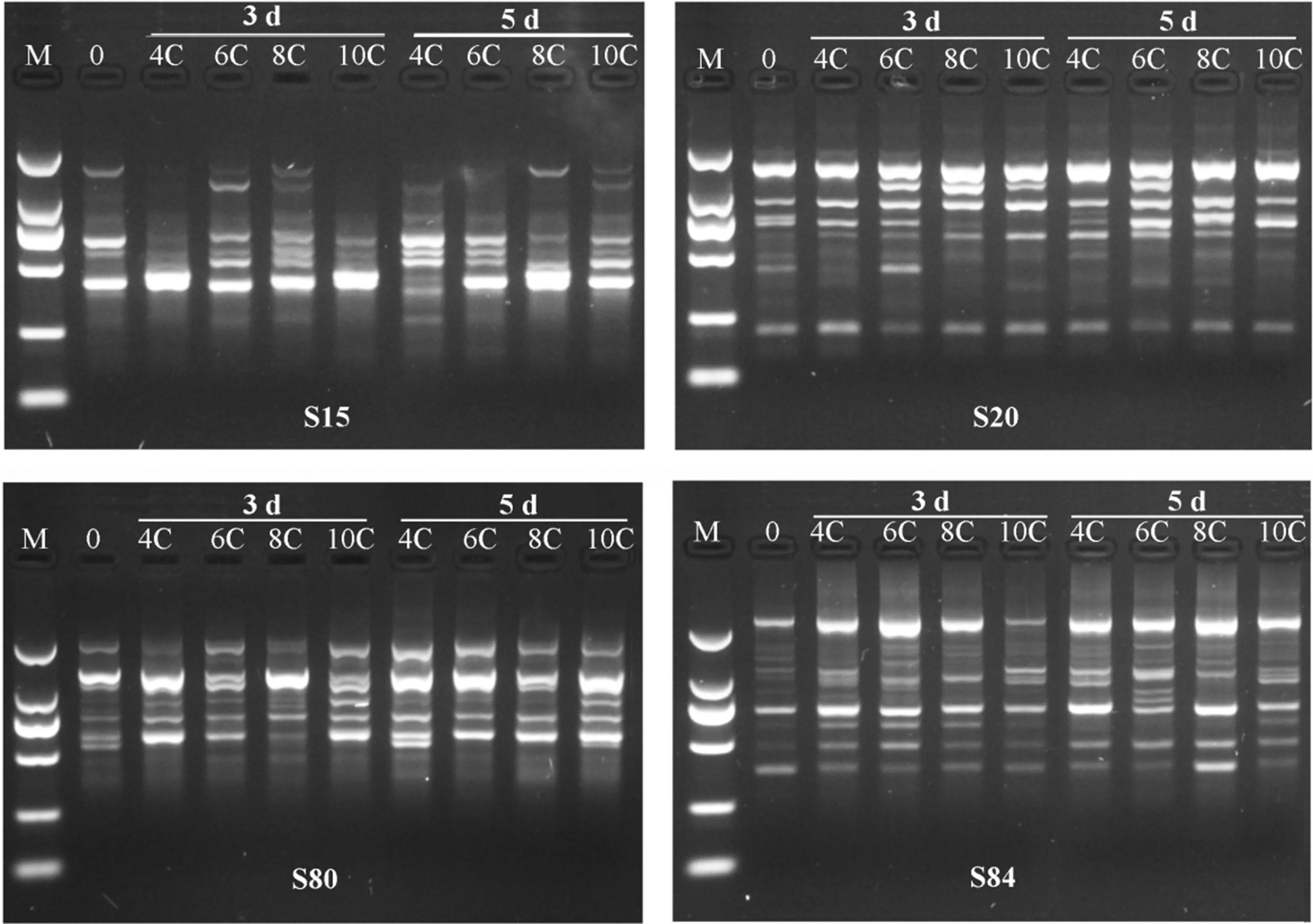
图4 引物S15、S20、S80及S84扩增的4种不同烃链长度咪唑基离子液体暴露3 d和5 d的涡虫RAPD图谱注:0, 对照;4C, [C4mim]Br;6C, [C6mim]Br;8C, [C8mim]Br;10C, [C10mim]Br;M, DNA分子量标准(自上而下分别为2 000、1 000、750、500、250、100 bp)。Fig. 4 RAPD profiles of D. japonica exposed to 4 kinds of imidazolium-based ILs with different alkyl-chain lengths for 3 and 5 days with primers S15, S20, S80 and S84Note: 0, Control; 4C, [C4mim]Br; 6C, [C6mim]Br; 8C, [C8mim]Br; 10C, [C10mim]Br; M, DNA molecular size marker (2 000, 1 000, 750, 500, 250, 100 bp from top to bottom).

图5 涡虫经4种不同烃链长度咪唑基离子液体暴露3 d和5 d的基因组模板稳定性Fig. 5 Genomic DNA template stability (GTS) of D. japonica exposed to 4 kinds of imidazolium-based ILs with different alkyl-chain lengths for 3 and 5 days
3 讨论(Discussion)
RAPD技术在出现伊始常常被用于遗传作图、分类及系统发育研究,后来该技术在检测DNA突变等方面也有应用。由于该技术具有快速、无放射性,适于检测任何生物的DNA损伤以及突变和重排等优点,目前已在多种生物中用于检测不同类型污染物的遗传毒性[16-20]。
本研究利用RAPD技术检测了4种不同烃链长度的咪唑基离子液体对日本三角涡虫的遗传毒性,结果表明离子液体处理组涡虫的RAPD图谱和对照组明显不同,主要表现在条带亮度的变化以及正常带的消失和新增带的出现。文献报道生物体在离子液体胁迫下其体内的活性氧(reactive oxygen species,ROS)会增加[25-26]。生物体内由ROS引起的DNA损伤包括链断裂、碱基改变以及无碱基位点[27]。除了ROS攻击,由于DNA加合物的不完全剪切修复,DNA链的断裂和错配也常常发生。处理组引物结合位点DNA的损伤或突变将会导致与无损伤对照相比DNA指纹的变化。本研究中RAPD图谱的变化包括条带亮度的变化以及正常带的消失和新增带的出现。正常条带的消失可能与基因毒性剂诱导的DNA损伤、点突变以及染色体重排等事件有关[28]。处理组RAPD图谱中也检测到了新PCR产物(新条带)的出现。新扩增产物的出现可能是由于突变、大的缺失以及同源重组引起的引物结合位点的改变[24]。关于条带亮度的改变,离子液体诱导的氧化性DNA损伤以及DNA—蛋白交联会阻碍Taq聚合酶的进程从而使某些特定RAPD条带亮度减弱,而由于DNA改变增加了引物与DNA模板的配对活性则会使某些条带亮度增强[29]。
本研究中,对于同一种离子液体随暴露时间的延长其RAPD图谱的多态性增加,即存在时间依赖性关系,这和利用RAPD技术检测药物8-羟基喹啉对泥鳅(Misgurnusanguillicaudatus)以及呋喃西林对游仆虫(Euplotesvannus)的遗传毒性所得结果一致[16,30]。此外,在同一暴露时间随着离子液体碳链长度的增加涡虫RAPD图谱的多态性也增加,这说明随着咪唑基离子液体碳链长度的增加,其对涡虫DNA的损伤,即遗传毒性增强。这和我们以前关于不同烃链长度咪唑基离子液体对涡虫的急性毒性及摄食、再生的影响的研究结果相一致[21,31]。Aksakal和Esim[17]的研究已经证实基因组模板稳定性(GTS)是反应污染物诱导的RAPD图谱改变的一个灵敏参数。本研究中各处理组的GTS值随不同种离子液体的碳链长度增加及同种离子液体暴露时间的延长而降低,这说明离子液体胁迫明显影响了涡虫的基因组模板稳定性。
总之,本研究表明咪唑基离子液体对淡水涡虫有明显的遗传毒性,且该遗传毒性的强弱与离子液体侧链碳原子数正相关。同时,我们的研究结果也证明RAPD分析是一种检测环境污染物对生物DNA损伤的高度灵敏的方法。
[1] Guecheva T, Henriques J A P, Erdtmann B. Genotoxic effects of coppersulphate in freshwater planarianinvivo, studied with the single-cell gel test (comet assay) [J]. Mutation Research, 2001, 497(1-2): 19-27

[4] Wu J P, Li M H. Low uptakes of Cd, Cu and Zn inDugesiajaponica, a freshwater planarian with higher tolerance to metals [J]. Chemical Ecology, 2017, 33(3): 257-269
[5] Yuan Z, Zhang J, Tu C, et al. The protective effect of blueberry anthocyanins against perfluorooctanoic acid-induced disturbance in planarian (Dugesiajaponica) [J]. Ecotoxicology and Environmental Safety, 2016, 127: 170-174
[6] Keskin S, Kayrak-Talay D, Akman U, et al. A review of ionic liquids towards supercritical fluid applications [J]. Journal of Supercritical Fluids, 2007, 43(1): 150-180
[7] 赵卫星, 姜红波, 王艳, 等. 绿色溶剂—离子液体及其毒性[J]. 山东化工, 2010, 39(8): 21-24
Zhao W X, Jiang H B, Wang Y, et al. Green solvents-ionic liquids and toxicity [J].Shandong Chemical Industry, 2010, 39(8): 21-24 (in Chinese)
[8] Das R N, Roy K. Predictive modeling studies for the ecotoxicity of ionic liquids towards the green algaeScenedesmusvacuolatus[J]. Chemosphere, 2014, 104(3): 170-176
[9] Zhang B, Li X, Chen D, et al. Effects of 1-octyl-3-methylimidazolium bromide on the antioxidant system ofLemnaminor[J]. Protoplasma, 2013, 250(1): 103-110
[10] Bernot R J, Brueseke M A, Evans-White M A, et al. Acute and chronic toxicity of imidazolium-based ionic liquids onDaphniamagna[J]. Environmental Toxicology and Chemistry, 2005, 24(1): 87-92
[11] Costello D M, Brown L M, Lamberti G A. Acute toxic effects of ionic liquids on zebra mussel (Dreissenapolymorpha) survival and feeding [J]. Green Chemistry, 2009, 11(4): 548-553
[12] Dong M, Zhu L, Zhu S, et al. Toxic effects of 1-decyl-3-methylimidazolium bromide ionic liquid on the antioxidant enzyme system and DNA in zebrafish (Daniorerio) livers [J]. Chemosphere, 2013, 91(8): 1107-1112
[13] Lau A H, Knakievica T, Prá D, et al. Freshwater planarians as novel organisms for genotoxicity testing: Analysis of chromosome aberrations [J]. Environmental and Molecular Mutagenesis, 2007, 48(6): 475-482
[14] 詹振楠, 刘宛, 孙梨宗, 等. 镉胁迫对拟南芥幼苗基因组DNA多态性的影响[J]. 生态学杂志, 2011, 30(6): 1234-1239
Zhan Z N, Liu W, Sun L Z, et al. Effects of cadmium stress on DNA polymorphism of genome inArabidopsisthalianaseedlings [J]. Chinese Journal of Ecology, 2011, 30(6): 1234-1239 (in Chinese)
[15] Atienzar F A, Jha A N. The random amplified polymorphic DNA (RAPD) assay and related techniques applied to genotoxicity and carcinogenesis studies: A critical review [J]. Mutation Research, 2006, 613: 76-102
[16] Zhou L, Li J, Lin X, et al. Use of RAPD to detect DNA damage induced by nitrofurazone in marine ciliate,Euplotesvannus(Protozoa, Ciliophora) [J]. Aquatic Toxicology, 2011, 103: 225-232
[17] Aksakal O, Esim N. Evaluation of arsenic trioxide genotoxicity in wheat seedlings using oxidative system and RAPD assays [J]. Environmental Science and Pollution Research, 2015, 22(9): 7120-7128
[18] Venkatachalam P, Jayalakshmi N, Geetha N, et al. Accumulation efficiency, genotoxicity and antioxidant defense mechanisms in medicinal plantAcalyphaindicaL. under lead stress [J]. Chemosphere, 2017, 171: 544-553
[19] Zaleska-Radziwill M, Doskocz N. DNA changes inPseudomonasputidainduced by aluminum oxide nanoparticles using RAPD analysis [J]. Desalination and Water Treatment, 2016, 57(3): 1573-1581
[20] Rocco L, Valentino I V, Scapigliati G, et al. RAPD-PCR analysis for molecular characterization and genotoxic studies of a new marine fish cell line derived fromDicentrarchuslabrax[J]. Cytotechnology, 2014, 66: 383-393
[21] 石长应, 王凡, 张合彩, 等. 不同烃链长度咪唑类离子液体对日本三角涡虫的急性毒性[J]. 河南师范大学学报: 自然科学版, 2014, 42(4): 178-182
Shi C Y, Wang F, Zhang H C, et al. Acute toxicity of imidazolium ionic liquids with different alkyl-chain lengths to planarianDugesiajaponica[J]. Journal of Henan Normal University: Natural Science Edition, 2014, 42(4): 178-182 (in Chinese)
[22] Zhang H C, Qiao G X. Phylogeny of Pemphiginae (Insecta: Hemiptera: Aphididae) inferred from nuclear gene EF-1α sequences [J]. Bulletin of Entomology Research, 2008, 98(5): 499-507
[23] 张合彩, 陈广文, 李玉昌, 等. 中国淡水涡虫RAPD分析条件的优化[J]. 实验生物学报, 2004, 37(4): 333-336
Zhang H C, Chen G W, Li Y C, et al. Optimization of reaction conditions for RAPD analysis of freshwater planarians in China [J]. Acta Biologiae Experimentalis Sinica, 2004, 37(4): 333-336 (in Chinese)
[24] Atienzar F A, Conradi M, Evenden A J, et al. Qualitative assessment of genotoxicity using random amplified polymorphic DNA: Comparison of genomic template stability with key fitness parameters inDaphniamagnaexposed to benzo[a] pyrene [J]. Environmental Toxicology and Chemistry, 1999, 18: 2275-2282
[25] Yu M, Wang S H, Luo Y R, et al. Effects of the 1-alkyl-3-methylimidazolium bromide ionic liquids on the antioxidant defense system ofDaphniamagna[J]. Ecotoxicology and Environmental Safety, 2009, 72(6): 1798-1804
[26] Zhang H C, Shi C Y, Sun L Q, et al. Toxic effects of 1-octyl-3-methylimidazolium bromide ionic liquid on the anti-oxidant defense system of freshwater planarian,Dugesiajaponica[J]. Toxicology and Industrial Health, 2016, 32(9): 1675-1683
[27] Livingstone D R. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms [J]. Marine Pollution Bulletin, 2000, 42(8): 656-666
[28] Wolf H D, Blust R, Backeljau T. The use of RAPD in ecotoxicology [J]. Mutation Research, 2004, 566: 249-262
[29] Lee Y C, Yang V C, Wang T S. Use of RAPD to detect sodium arsenite-induced DNA damage in human lymphoblastoid cells [J]. Toxicology, 2007, 239(1-2): 108-115
[30] Nan P, Xia X, Du Q, et al. Genotoxic effects of 8-hydroxylquinoline in loach (Misgurnusanguillicaudatus) assessed by the micronucleus test, comet assay and RAPD analysis [J]. Environmental Toxicology and Pharmacology, 2013, 35(3): 434-443
[31] Zhang H C, Shi C Y, Wang F, et al. Imidazolium-based ionic liquids: Effects of different alkyl-chain lengths on freshwater planarianDugesiajaponicabased on ingestion, regeneration and antioxidant response [J]. Fresenius Environmental Bulletin, 2016, 25(8): 3205-3212

