DEHP对小鼠精原细胞Bax和Bcl-2表达水平的影响
董瑞娜,刘殊,张敏,戴红, *,徐肖倩, #
1. 内蒙古医科大学,呼和浩特 010110 2. 同煤集团职业病防治院,大同 037003 3. 包头医学院,包头 014040
现今,塑料制品已广泛深入人类生产和生活。为使其满足人们不同需求,塑料生产过程中使用和消耗了大量的增塑剂,据报道估计,增塑剂年均全球总产量580万t,其中75%为邻苯二甲酸酯(phthalatic-acid esters, PAE)类化合物[1]。邻苯二甲酸二(2-乙基己基)酯(di (2-ethylhexyl)phthalate, DEHP)是PAE的重要组成之一,因它含有与聚合物相容的极性部分和能够破坏聚氯乙烯(polyvinyl chloride, PVC)聚合物链之间极性相互作用的非极性部分且不与PVC形成共价键,所以,其很容易释放到环境中,并通过直接接触和使用进入人体,或通过其他PAEs产品以及一般环境间接暴露[2]。
近年来,大量研究证实DEHP对啮齿类动物具有生殖和睾丸毒性及抗雄激素效应。根据暴露剂量及作用对象年龄的不同,均表现出不同程度的组织及细胞损伤,即出现睾丸、附睾萎缩,精细管畸形,生殖细胞、支持细胞及间质细胞凋亡。DEHP暴露也可改变生殖激素水平,导致血清中睾丸睾酮减少,精子死亡率和畸形率明显增高。流行病学研究报道PAEs暴露可能导致男性生殖毒性[3-4],子宫内暴露DEHP可缩短雄性肛门生殖器距离[5],并且在啮齿类动物模型中的实验也证实了这些发现[6]。
我们前期研究发现,DEHP暴露致青春期Wistar大鼠睾丸生精小管严重萎缩,各级生精细胞减少;黄体生成素(luteinizing hormone, LH)、睾酮(testosterone,T)、促卵泡成熟激素(follicle stimulating hormone,FSH)水平显著上升[7]。本实验通过检测DEHP对小鼠精原细胞Bax和Bcl-2 mRNA和蛋白表达水平的影响,进一步探讨DEHP对雄性生殖系统功能影响的毒作用机制。
1 材料与方法(Materials and methods)
1.1 细胞株
小鼠精原细胞(GC-1spd),由北京协和基础研究所分子生物学实验室惠赠。
1.2 仪器与试剂
酶标仪(MK3, Thermo公司,USA),流式细胞仪(FACSCalibur, BD公司,USA),PCR扩增仪(BIO-RAD, USA),电泳仪(DYY-8C,北京六一医学仪器厂),红外激光成像系统(Odyssey CLx, USA)。
DEHP(化学纯,纯度>99%,国药集团化学试剂有限公司),DMEM高糖培养基(gibco公司),胎牛血清(gibco公司),胰蛋白酶(gibco公司),MTT(Amresco公司),凋亡试剂盒(BD公司),PCR试剂盒(上海生物工程有限公司),Anti-Bax抗体(艾博抗上海贸易有限公司),Anti-Bcl-2抗体(艾博抗上海贸易有限公司),其余试剂均为市售分析纯。
1.3 细胞培养及DEHP溶液配制
将小鼠精原细胞接种于含10%胎牛血清的DMEM高糖培养基中,于37 ℃、5%CO2培养箱中培养。当细胞密度达70%~80%,用0.25%胰酶消化,1 000 r·min-1离心5 min后传代。
DEHP溶液配制:取原浓度为106mg·L-1的DEHP溶液100 μL,加入900 μL完全培养基,制成浓度为105mg·L-1的DEHP溶液,根据浓度梯度计算原则,依次配制1 000、100、10 mg·L-1的DEHP溶液。对照组为完全培养基。
1.4 MTT法检测细胞相对活力
将对数生长期小鼠精原细胞经胰蛋白酶消化后配制成密度为2×104cells·mL-1的细胞悬液,以每孔200 μL细胞悬液接种于96 孔培养板中培养24 h。换成DEHP终浓度为0、10、100、1 000 mg·L-1的培养液培养24 h后。细胞处理并每孔加入20 μL的5 mg·mL-1MTT溶液,继续孵育4 h,吸掉培养基,再加入150 μL DMSO,振荡10 min,用酶联仪于490 nm处检测各孔吸光度值(OD),实验重复3 次,计算其平均值,并按公式计算细胞相对活力。每个浓度设3个复孔。细胞相对活力=(OD染毒组/OD对照组)×100%。
1.5 流式细胞仪检测细胞凋亡
小鼠精原细胞经DEHP染毒24 h后,用0.25%胰酶消化并收集细胞,离心弃上清,加入1×binding buffer 1 mL,再离心弃上清液,用1×binding buffer 100 μL反复吹打细胞至单细胞悬液,调整浓度为1×106cells·mL-1。取细胞悬液100 μL至新的1.5 mL离心管,加入Annexin V-FITC和PI的混合液10 μL,轻弹混匀,室温避光孵育15 min。转移至新的流式玻璃管中,加入1×binding buffer 400 μL,轻弹混匀。在流式细胞仪上进行检测。
1.6 实时荧光定量PCR法检测Bax和Bcl-2 mRNA表达
细胞总RNA提取与cDNA合成按试剂盒说明书进行。cDNA产物置-20 ℃保存。采用BIO-RAD型PCR仪,以GAPDH为内参照进行PCR。Bax基因引物序列,上游:5'-CAGGATGCGTCCACCAAGAA-3',下游:5'-CGTGTCCACGTCAGCAATCA-3';Bcl-2引物序列,上游:5'-TGAAGCGGTCCGGTGGATA-3',下游:5'-CAGCATTTGCAGAAGTCCTGTGA-3';Gapdh引物序列,上游:5'-AAATGGTGAAGGTCGGTGTGAAC-3',下游:5'-CAACAATCTCCACTTTGCCACTG-3'。反应条件,95 ℃、 30 s,95 ℃、 3 s,60 ℃、 30 s,共40个循环。计算目的基因Bax和Bcl-2的相对表达量(relative quantification,RQ)。
1.7 蛋白免疫印迹法(Western Blot)检测Bax和Bcl-2蛋白表达
收集细胞,用裂解液提取细胞总蛋白,依据BCA法进行蛋白定量,蛋白上样量为50 μg,将电泳后分离的蛋白电转至NC膜上,5%的脱脂奶粉封闭,分别加Bax或Bcl-2兔抗鼠抗体,4 ℃过夜,TBST洗3次,每次15 min。再加入鼠抗兔IgG抗体。室温反应1 h,TBST洗2次,TBS洗1次,每次10 min,以Tubulin作为内参照,以红外激光成像系统扫描并分析图像,再计算相对表达量。
1.8 统计学方法
2 结果(Results)
2.1 DEHP对细胞相对活力的影响
采用MTT比色法检测不同浓度(0、10、100和1 000 mg·L-1)DEHP作用于小鼠精原细胞24 h后的细胞相对活力(图1)。结果显示(F=1 346.806,P=0.000)随着DEHP暴露浓度增加,细胞相对活力呈下降趋势,分别为100%、97.3%、77.9%和62.8%。其中1 000 mg·L-1剂量组明显低于其他各剂量组,100 mg·L-1剂量组低于对照组和10 mg·L-1剂量组(P<0.05)。
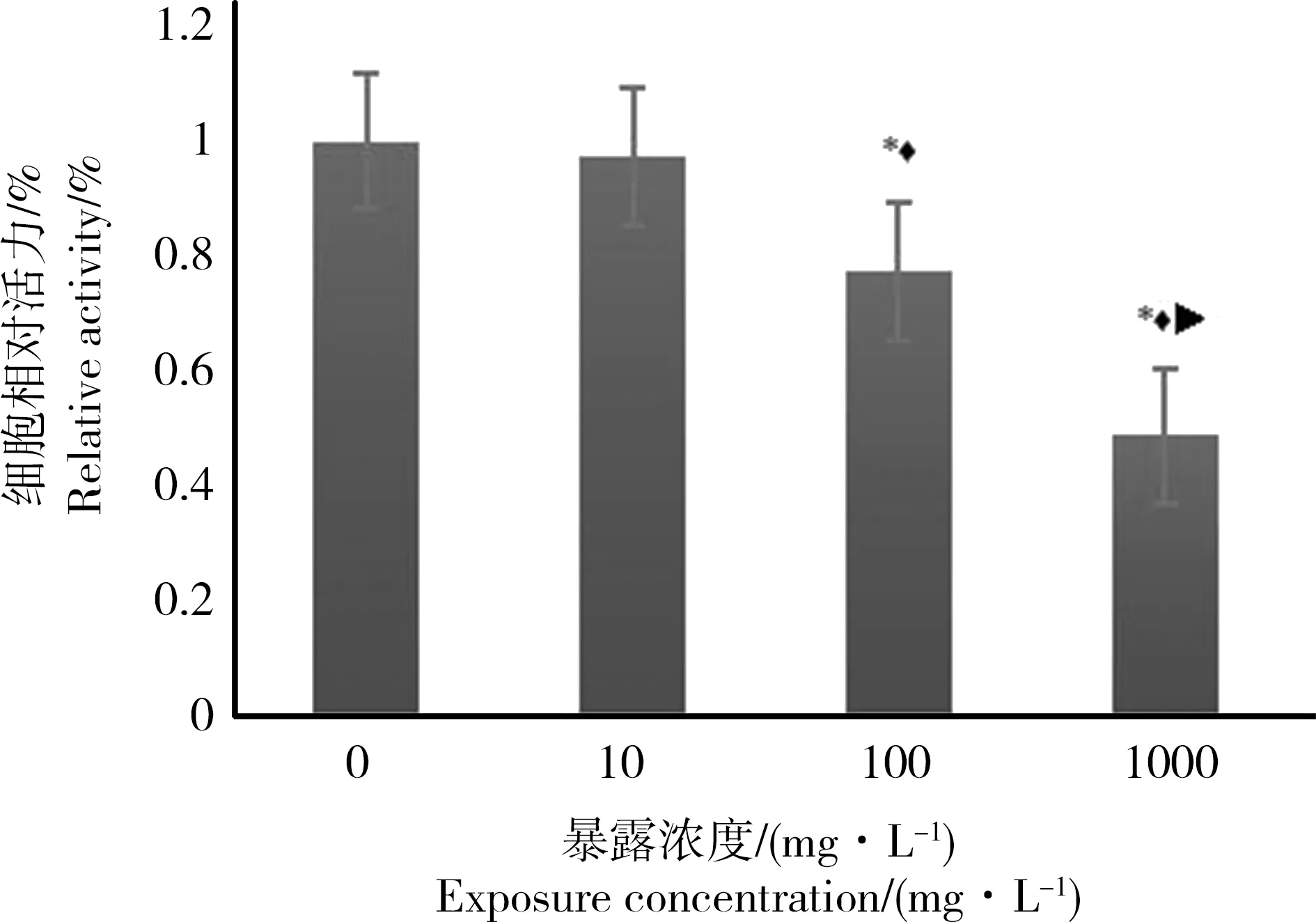
图1 DEHP对小鼠精原细胞相对活力变化注:*与对照组比较,P <0.05;◆与10 mg·L-1比较,P <0.05;▶与100 mg·L-1比较,P <0.05。Fig. 1 Effect of DEHP on the relative activity of mouse spermatogoniaNote: *P <0.05 vs control group; ◆P <0.05 vs 10 mg·L-1; P<0.05 vs 100 mg·L-1.
2.2 DEHP对小鼠精原细胞的凋亡作用
如图2、表1所示,小鼠精原细胞经DEHP染毒24 h后,早期凋亡率1 000 mg·L-1剂量组高于对照组(P<0.05);晚期凋亡率1 000 mg·L-1和100 mg·L-1剂量组均明显高于对照组,1 000 mg·L-1剂量组高于10 mg·L-1剂量组(P<0.05);总凋亡率呈现明显上升趋势,其中1 000 mg·L-1和100 mg·L-1剂量组明显高于对照组,1 000 mg·L-1剂量组还明显高于10 mg·L-1剂量组(P<0.05)。
2.3 DEHP对小鼠精原细胞Bax和Bcl-2 mRNA表达水平的影响
小鼠精原细胞Bax和Bcl-2 mRNA实时荧光定量PCR检测结果见表2。Bax mRNA表达水平1 000 mg·L-1和100 mg·L-1剂量组明显高于对照组,1 000 mg·L-1剂量组与10 mg·L-1剂量组比较差异具有统计学意义(P<0.05);Bcl-2 mRNA表达水平1 000 mg·L-1剂量组低于10 mg·L-1剂量组和对照组(P<0.05);此外,Bax和Bcl-2 mRNA比值1 000 mg·L-1和100 mg·L-1剂量组均明显高于对照组,1 000 mg·L-1剂量组高于10 mg·L-1剂量组(P<0.05)。
2.4 DEHP对小鼠精原细胞凋亡相关蛋白Bax和Bcl-2表达水平的影响
表3、图3所示,在内参表达一致的情况下,小鼠精原细胞经不同浓度DEHP作用24 h后,Bax蛋白表达水平1 000 mg·L-1剂量组高于对照组(P<0.05);Bcl-2蛋白表达水平各剂量组与对照组比较差异均具有统计学意义,且1 000 mg·L-1和100 mg·L-1剂量组明显低于10 mg·L-1剂量组和对照组(P<0.05);此外,Bax/Bcl-2两蛋白间的比值关系是决定细胞凋亡的关键因素,1 000 mg·L-1和100 mg·L-1剂量组明显高于对照组,而1 000 mg·L-1剂量组高于10 mg·L-1剂量组(P<0.05),随着DEHP染毒剂量的增加,Bax/Bcl-2比值呈现上升趋势。
表1 小鼠精原细胞凋亡率检测结果Table 1 The apoptosis of mouse spermatogonia (±s)
注:*与对照组比较,P<0.05;◆与10 mg·L-1比较,P<0.05。
Note:*P<0.05 vs control group;◆P<0.05 vs 10 mg·L-1.

表2 小鼠精原细胞Bax和Bcl-2 mRNA表达检测结果Table 2 The Bax and Bcl-2 mRNA expression of the mouse spermatogonia (%) (±s)
注:*与对照组比较,P<0.05;◆与10 mg·L-1比较,P<0.05。
Note:*P<0.05 vs control group;◆P<0.05 vs 10 mg·L-1.

图2 流式细胞仪检测小鼠精原细胞凋亡注:O, 对照组;A, DEHP低剂量组;B, DEHP中剂量组;C, DEHP高剂量组。Fig. 2 The apoptosis of the mouse spermatogonia detected by flow cytometryNote: A, control; B, low-dose DEHP; C, medium-dose DEHP; D, high-dose DEHP.
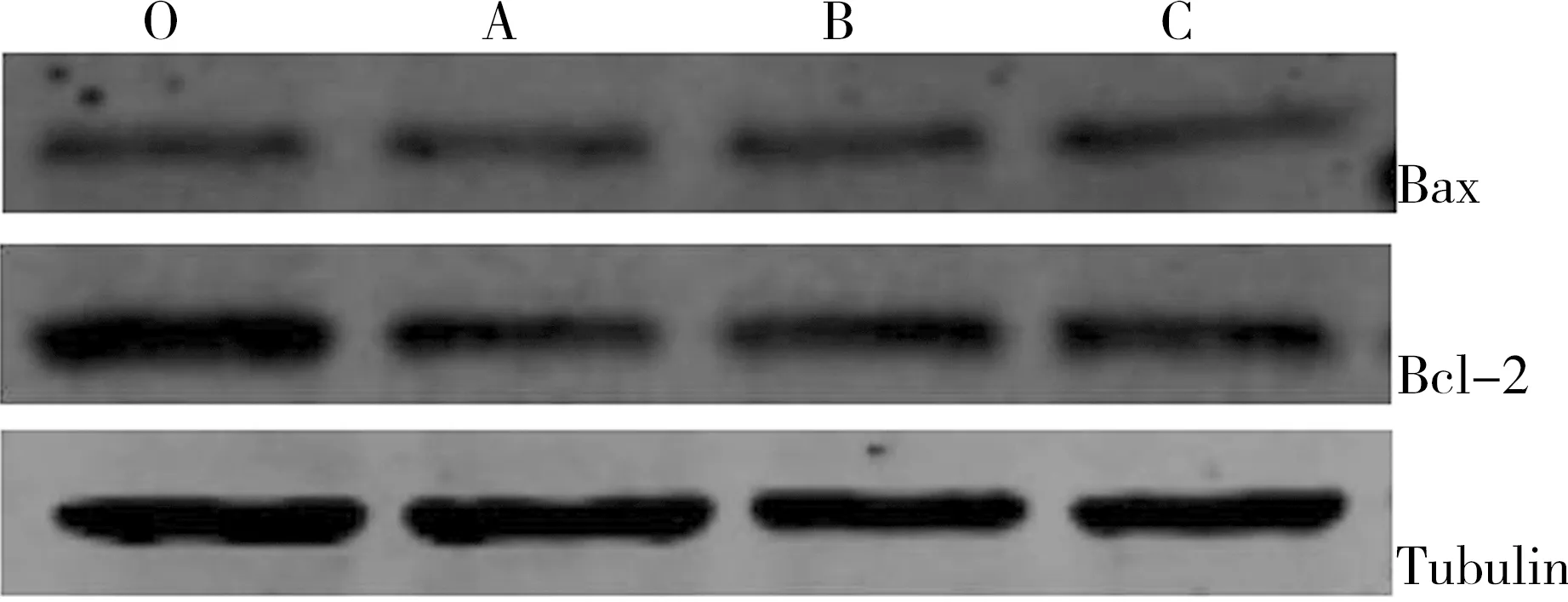
图3 小鼠精原细胞Bax和Bcl-2蛋白Western印记检测注: O, 对照组;A, DEHP低剂量组;B, DEHP中剂量组;C, DEHP高剂量组。Fig. 3 Analysis of Bax and Bcl-2 protein expressions in the mouse spermatogonia detected by Western blotNote: O, control; A, low-dose DEHP; B, medium-dose DEHP; C, high-dose DEHP.

表3 DEHP染毒小鼠精原细胞24 h时Bax和Bcl-2 蛋白表达检测结果(x±s)Table 3 The Bax and Bcl-2 protein expression of the mouse spermatogonia after 24 h exposure (x±s)
注:*与对照组比较,P<0.05;◆与10 mg·L-1比较,P<0.05。
Note:*P<0.05 vs control group;◆P<0.05 vs 10 mg·L-1.
3 讨论(Discussion)
DEHP对人类和动物体的多种器官造成损伤作用,如影响肝脏、肾脏以及神经系统,还可以降低机体的免疫功能,损害生殖腺,导致生殖器官畸形甚至癌变[8]。现阶段人们对DEHP的研究主要集中在生殖系统的体内研究上,而对DEHP在生殖细胞上的研究较少,尤其对精原细胞的研究。为此本文探究了DEHP对小鼠精原细胞培养过程中的影响及毒性作用机制。
精原细胞在雄性生殖细胞早期发育阶段具有无限分裂的能力,能在分裂过程中保持原有的基因性状。再者,精子发生作为维持男性生育力高度复杂和关键的过程,又需要精原干细胞的连续自我更新和分化以及许多分子及途径的参与才能进行[9],因此对精原细胞的研究是十分重要的。有研究认为DEHP可直接损害精原细胞,减少细胞数量,抑制细胞增殖,促进细胞死亡,发生性激素分泌紊乱,进而降低雄激素水平,诱导细胞凋亡[10]。
有关DEHP的浓度选择,经过充分的预实验证明,本实验所选择的暴露浓度具有实际意义。由于精原细胞对DEHP的接受程度和人体不一样,且DEHP对精原细胞的染毒剂量目前在研究领域没有明确规定,所以本实验所选择的实验浓度对精原细胞是可行的。
本研究发现,DEHP对小鼠精原细胞有明显的生长抑制作用,随着DEHP暴露剂量的增加,小鼠精原细胞的细胞相对活力1 000 mg·L-1和100 mg·L-1剂量组与对照组比较有显著差异,主要表现在增殖现象明显减少,小鼠精原细胞形成不明显或形成后有明显的细胞死亡和退化现象。特别是在1 000 mg·L-1剂量组的作用下,细胞数明显减少。相比而言10 mg·L-1剂量组对小鼠精原细胞的影响较小,可继续增殖,但出现不同程度的细胞退化和死亡现象。总的来说,1 000 mg·L-1剂量组对细胞的影响较大,并随着暴露时间的延长细胞损伤程度越明显。杨电明[11]在对神经干细胞和骨髓干细胞的研究中也得出了和本文相一致的结论。Piche等[12]通过研究小鼠间质肿瘤细胞系MA-10细胞的抗雄激素潜能时也发现,DEHP可降低细胞活力,抑制细胞增殖。还有研究发现:DEHP及其代谢产物MEHP可通过抑制PI3K/AKT细胞通路和阻碍信号传导途径影响精原细胞的增殖[13]。
诱导细胞凋亡可能是导致精原细胞数量减少的重要因素,精原细胞数量减少,势必会阻碍精子的发生。有研究发现,高剂量(1 500 mg·kg-1)组DEHP可使青春期SD雄性大鼠睾丸生精小管严重萎缩,各级生精细胞大量丧失,支持细胞呈空泡状,间质细胞发生异常增生的现象,说明DEHP也可通过睾丸内支持细胞、间质细胞及各级生精细胞产生雄性生殖毒性作用[14]。本研究流式细胞仪分析结果表明,随着DEHP染毒剂量的增加,各剂量组小鼠精原细胞早期、晚期及总凋亡率呈逐渐上升趋势,尤其是1 000 mg·L-1剂量组与对照组相比,凋亡率明显升高(P<0.05),说明1 000 mg·L-1剂量组对小鼠精原细胞的损伤最明显。同时也说明DEHP能够诱导小鼠精原细胞凋亡的发生。宋晓峰等[15]发现,DEHP能诱导小鼠胚胎睾丸间质细胞凋亡,DEHP暴露组凋亡指数及凋亡细胞比例与对照组相比均有显著差异(P<0.05)。还有研究发现,DEHP作用于青春期小鼠,可诱导其精子数量减少及生精上皮的组织学异常和减数分裂后生殖细胞的凋亡[16]。
细胞凋亡是由各种生理和病理刺激所引发的一种细胞死亡的独特形式,且在机体生长发育和生殖衰老过程中发挥着重要的作用。导致细胞凋亡的2个主要途径之一是线粒体途径,在该途径活化期间特征性的生化变化是细胞色素C渗漏到细胞质中[17],这种从线粒体释放的细胞色素C是由Bcl-2蛋白家族的成员调节,其中Bax和Bcl-2作为Bcl-2家族中的重要成员在细胞凋亡调控过程中发挥着重要的作用[18]。
从实时荧光定量PCR结果可以看出,Bax mRNA的表达水平在DEHP染毒24 h后,1 000 mg·L-1和100 mg·L-1剂量组明显高于对照组,说明DEHP暴露能促使Bax mRNA 表达水平升高。相反Bcl-2 mRNA的表达水平在DEHP暴露24 h后,1 000 mg·L-1剂量组明显低于对照组和10 mg·L-1剂量组(P<0.05);同时,Bax和Bcl-2 mRNA比值显示,1 000 mg·L-1剂量组与对照组比较明显上升(P<0.05),表明DEHP对小鼠精原细胞的损伤具有一定的剂量依赖性,并随着染毒剂量的增加Bax基因表达增强,Bcl-2基因表达减弱,从而诱导生殖细胞凋亡。吴维光等[19-20]得出DEHP对大鼠睾丸间质细胞和支持细胞都具有毒性作用,且诱导凋亡机制与本文相同。有研究证明:低浓度的MEHP诱导Bax表达升高和促进细胞色素C从线粒体释放到细胞质,同时在转录和蛋白质翻译水平降低Bcl-2的表达[21]。
细胞内Bax和Bcl-2蛋白表达的增加与减少是调控细胞凋亡的重要途径。本研究显示:DEHP暴露24 h后,随着染毒剂量的增加,1 000 mg·L-1剂量组较对照组Bax蛋白表达有大幅升高趋势,而1 000 mg·L-1和100 mg·L-1剂量组与对照组和10 mg·L-1剂量组比较Bcl-2蛋白表达水平均有降低的趋势(P<0.05),与Bax/Bcl-2蛋白比值中得出的结论一致,说明随着DEHP染毒剂量的增加,Bax蛋白表达逐渐增强,Bcl-2蛋白表达逐渐减弱。可见细胞凋亡确实受Bcl-2蛋白的调节,而且Bax/Bcl-2蛋白比值在细胞凋亡过程中也发挥着至关重要的作用。Furuchi等[22]研究了转基因小鼠精原细胞中Bcl-2蛋白的异常表达,证实小鼠精原细胞的凋亡是受Bcl-2蛋白的调节,与本文研究结论一致。
本实验研究显示,DEHP各剂量暴露组普遍引起小鼠精原细胞的损伤,且以高剂量组变化最为显著,主要表现为细胞存活率显著下降,细胞凋亡率显著增加,进而引起精子形成障碍等一系列生殖异常表现。而DEHP暴露后致使小鼠精原细胞内Bax mRNA基因和促凋亡蛋白Bax蛋白表达上升,而Bcl-2 mRNA基因和抗凋亡Bcl-2蛋白表达下降,改变了Bax/Bcl-2两蛋白之间的比值与平衡,是决定细胞凋亡的关键因素和主要机制。
[1] Markarian J. PVC additives- What lies ahead [J]. Plastics Additives and Compounding, 2007, 9(6): 22-25
[2] Chen L, Zhao Y, Li L, et al. Exposure assessment of phthalates in non-occupational populations in China [J]. Science of the Total Environment, 2012, 427-428(12): 60-69
[3] Wang Y X, Zeng Q, Sun Y, et al. Semen phthalate metabolites, semen quality parameters and serum reproductive hormones: A cross-sectional study in China [J]. Environmental Pollution, 2016, 211: 173-182
[4] Wang Y X, Zeng Q, Sun Y, et al. Phthalate exposure in association with serum hormone levels, sperm DNA damage and spermatozoa apoptosis: A cross-sectional study in China [J]. Environmental Research, 2016, 150: 557-565
[5] Swan S H, Main K M, Liu F, et al. Decrease in anogenital distance among male infants with prenatal phthalate exposure [J]. Environmental Health Perspectives, 2005, 113(8): 1056-1061
[6] Jr G L, Ostby J, Furr J, et al. Perinatal exposure to the phthalates DEHP, BBP, and DINP, but not DEP, DMP, or DOTP, alters sexual differentiation of the male rat [J]. Toxicological Sciences, 2000, 58(2): 350-365
[7] 刘殊, 张敏, 徐肖倩, 等. DEHP染毒致青春期雄性大鼠的生殖毒性及维生素C、E的保护作用[J]. 环境与职业医学, 2016, 33(8): 780-784
Liu S, Zhang M, Xu X Q, et al. Reproductive toxicity induced by di(2-ethylhexy)phthalate in adolescent male rats and protective effects of vitamin C and vitamin E [J]. Environmental and Occupational Medicine, 2016, 33(8): 780-784 (in Chinese)
[8] 李剑, 徐飞, 李少旦, 等. 环境雌激素研究进展[J]. 现代预防医学, 2006, 33(8): 1355-1359
Li J, Xu F, Li S D, et al. Advances in research on environmental estrogens [J]. Modern Preventive Medicine, 2006, 33(8): 1355-1359 (in Chinese)
[9] Sun J, Wang J, He L, et al. Knockdown of polycomb-group RING finger 6 modulates mouse male germ cell differentiationinvitro[J]. Cellular Physiology and Biochemistry, 2015, 35: 339-352
[10] 杨俊杰. 邻苯二甲酸二乙基己酯(DEHP)及代谢产物邻苯二酸-单-2-乙基己酯(MEHP)对幼鼠精原细胞影响的实验研究[D]. 遵义: 遵义医学院, 2011: 1-40
Yang J J. Experiment study of ethylhexyl phthalate (DEHP) and its metabolites (single-ethylhexyl phthalate, MEHP) influencing on spermatogonia in young male Wistar rats [D]. Zunyi: Zunyi Medical College, 2011: 1-40 (in Chinese)
[11] 杨电明. 邻苯二甲酸酯对小鼠神经干细胞和骨髓干细胞的毒性研究[D]. 西安: 陕西师范大学, 2013: 1-40
Yang D M. Toxicity of phthalates to mouse neural stem cells and bone marrow stem cells [D]. Xi’an: Shaanxi Normal University, 2013: 1-40 (in Chinese)
[12] Piche C D, Sauvageau D, Vanlian M, et al. Effects of di(2-ethylhexyl)phthalate and four of its metabolites on steroidogenesis in MA-10 cells [J]. Ecotoxicology and Environmental Safety, 2012, 79: 108-115
[13] Rothschild G, Sottas C M, Kissel H, et al. A role for kit receptor signaling in Leydig cell steroidogenesis [J]. Biology of Reproduction, 2003, 69(3): 925-932
[14] 秦逍云. 塑化剂DEHP对雄性动物的生殖毒性研究[D]. 深圳: 深圳大学, 2015: 1-61
Qin X Y. The studying of effects of DEHP on male reproductive system [D]. Shenzhen:Shenzhen University, 2015: 1-61 (in Chinese)
[15] 宋晓峰, 张德迎, 邓永继, 等. 邻苯二甲酸二(2-乙基)己酯诱导小鼠胚胎Leydig细胞凋亡的体外实验研究[J]. 中华小儿外科杂志, 2007, 28(2): 69-72
Song X F, Zhang D Y, Deng Y J, et al. Apoptosis of Leydig cell induced by di(2-ethylhexyl)phthalateinvitro[J]. Chinese Journal of Pediatric Surgery, 2007, 28(2): 69-72 (in Chinese)
[16] Liu C, Qian P, Yang L, et al. Pubertal exposure to di(2-ethylhexyl)phthalate inhibits G9a-mediated histone methylation during spermatogenesis in mice [J]. Archives of Toxicology, 2016, 90(4): 1-15
[17] Liu X, Kim C N, Yang J, et al. Induction of apoptotic program in cell-free extracts: Requirement for dATP and cytochrome c [J]. Cell, 1996, 86(1): 147-157
[18] 付永锋, 樊廷俊. Bcl-2家族蛋白与细胞凋亡[J]. 生物化学与生物物理学报(英文), 2002(4): 389-394
Fu Y F, Fan Y J. Bcl-2 family proteins and apoptosis [J]. Acta Biochimica et Biophysica Sinica, 2002(4): 389-394 (in Chinese)
[19] 吴维光, 葛红雨, 韩建秋. DEHP体外影响大鼠睾丸间质细胞Bax和Bcl-2基因表达的实验研究[J]. 河北医科大学学报, 2013, 34(2): 160-163
Wu W G, Ge H Y, Han J Q. Effect of DEHP on Bax and Bcl-2 expressions in rat Leydig cellsinvitro[J]. Journal of Hebei Medical University, 2013, 34(2): 160-163 (in Chinese)
[20] 吴维光, 史海霞, 韩建秋, 等. DEHP体外对大鼠睾丸支持细胞Bax和Bcl-2基因表达的影响[J]. 贵阳中医学院学报, 2013, 35(1): 261-264
Wu W G, Shi H X, Han J Q, et al. Effect of DEHP on Bax and Bcl-2 expressions in rat Sertoli cellsinvitro[J]. Journal of Guiyang College of Traditional Chinese Medicine, 2013, 35(1): 261-264 (in Chinese)
[21] Ban J B, Fan X W, Huang Q, et al. Mono-(2-ethylhexyl)phthalate induces injury in human umbilical vein endothelial cells [J]. Plos One, 2014, 9(5): 1-9
[22] Furuchi T, Masuko K, Nishimune Y, et al. Inhibition of testicular germ cell apoptosis and differentiation in mice misexpressing Bcl-2 in spermatogonia [J]. Development, 1996, 122(6): 1703-1709

