PM2.5对人肺癌细胞A549迁移、侵袭能力的增强作用
杨丹,周伟强,杨彪,肖纯凌,*
1. 沈阳医学院 药理学教研室,沈阳 110034 2. 沈阳医学院 辽宁省环境污染与微生态重点实验室,沈阳 110034
PM2.5是指空气动力学直径≤2.5 μm的颗粒物,是构成可吸入颗粒物的主要部分[1]。众多流行病学调查均显示PM2.5与包括肺癌在内的呼吸系统疾病关系密切[2]。长期的PM2.5暴露能明显增加肺癌患者的死亡率,同时可致确诊后的肺癌患者的生存期缩短,说明PM2.5能够促进肺癌的进展[3-4]。肺癌的进展与其转移密切相关,有研究表明:PM2.5可能通过促进肿瘤新生血管形成、诱发炎症反应等促进肺癌转移,但其促进肺癌转移的具体机制仍不清楚[5-7]。以往对于PM2.5致呼吸系统损伤的分子机制的研究多集中于以较高浓度PM2.5所致的细胞损伤作用,而关于PM2.5对肿瘤细胞迁移及侵袭能力影响的实验研究仍较少,因此有必要进行更多及更深入的研究[8-11]。
本研究采用细胞划痕实验和transwell小室法检测PM2.5对人肺癌细胞A549迁移、侵袭能力的影响,以期进一步证实PM2.5具有促肺癌转移的作用。同时本研究采用Western Blotting法检测同细胞迁移、侵袭能力密切相关的Wnt/βcatenin通路活性及其下游cyclin D1、MMP-2、MMP-9和转录因子snail、slug蛋白表达水平的变化,分析该信号通路在PM2.5影响肺癌细胞A549迁移、侵袭能力中的作用,为今后深入研究PM2.5促肺癌转移的机制提供实验依据。
1 材料与方法(Materials and methods)
1.1 细胞株和主要试剂
人肺癌细胞A549购自中国科学院上海细胞生物学研究所细胞库。胰酶及RPMI 1640培养基(Gibco公司); Matrigel基质胶(BD公司);transwell小室(Costar公司);snail和slug抗体(CST公司);MMP-2、MMP-9、β-catenin及cyclin D1抗体(Santa Cruz公司);细胞核蛋白抽提试剂盒(碧云天公司)。
1.2 PM2. 5 采集和处理
选择辽宁省沈阳市为采样地区,采样地点为城市中心。雾霾天气时运用高流量样品颗粒采集器采集PM2.5样品于滤膜上,采样高度为距离地面约1.5 m。连续自动采样6个月,以1.13 m3·min-1流速每48 小时采集1份。采样后的滤膜用铝箔纸包裹后于-20 ℃冰箱中保存。制备PM2.5悬液时将采样后的滤膜剪成约1 cm ×1 cm大小,浸泡在50 mL去离子水中。超声震荡收集PM2.5颗粒物,用多层纱布过滤震荡液后制成PM2.5悬液。收集PM2.5悬液在13 000×g、4 ℃ 的条件下离心10 min后的底层颗粒物,高压灭菌后真空冷冻干燥,-80 ℃保存。染毒前用无菌生理盐水配制成所需的PM2.5混悬液并超声处理[12-13]。
1.3 细胞培养及处理
人肺癌A549细胞株用RPMI 1640培养基(含10%新生牛血清、1% L-谷氨酰胺及1%青链霉素)培养于37 ℃、5 %CO2细胞培养箱中,细胞长满约90%时传代。取对数生长期的A549细胞,接种于培养皿或培养板内,于37 ℃、5%CO2条件下培养24 h后更换不含血清及抗生素的RPMI 1640培养基。次日向培养基中加入不同浓度PM2.5或TGF-β1(10 ng·mL-1)后持续培养72 h。
1.4 MTT 比色法检测细胞增殖
设立实验组(PM2.5终浓度为2.5、10、40和160 μg·mL-1)、对照组(只加细胞,不加PM2.5)和空白组(不加细胞,只加RPMI 1 640培养基及PM2.5)。体外培养72 h后,每孔加入20 μL MTT (终浓度5 g·L-1),37 ℃继续孵育4 h,弃上清,每孔加入150 μL DMSO 振荡10 min,用酶标仪在490 nm处测定吸光度(A)值,实验重复3次。按公式计算:
细胞生长抑制率=(A处理组-A空白组)/(A对照组-A空白组)×100%
1.5 细胞划痕实验

1.6 Transwell小室侵袭、迁移实验
细胞分组同划痕实验。侵袭实验取200 μL细胞悬液种于铺好Matrigel胶的Transwell上室中,下室加入600 μL含10%血清的培养基,于37 ℃、5% CO2细胞培养箱中孵育24 h,移出transwell小室,棉签擦去上室的非迁移细胞,4%甲醛固定30 min后用0.1%结晶紫染色15 min,冲洗干净后倒置风干。在倒置显微镜下观察并拍照,每个小室随机取6个视野拍照,计数穿膜细胞个数。细胞迁移试验不需要铺Matrigel胶,其余操作同侵袭实验。
1.7 胞核蛋白的抽提
按照细胞核蛋白与细胞浆蛋白抽提试剂盒说明进行。用PBS洗一遍,刮下细胞,每20 μL细胞沉淀加入200 μL细胞浆蛋白抽提试剂A。最高速剧烈涡旋5 s,冰浴10~15 min。加入细胞浆蛋白抽提试剂B 10 μL,最高速剧烈涡旋5 s,冰浴1 min,4 ℃、13 000×g离心5 min。收集沉淀,加入50 μL细胞核蛋白抽提试剂。最高速剧烈涡旋30 s,把细胞沉淀完全悬浮并分散开。然后放回冰浴中,每隔1~2 min再高速剧烈涡旋30 s,共30 min。4 ℃、13 000×g离心10 min,立即吸取上清,即为抽提得到的细胞核蛋白。
1.8 Western Blotting
收集细胞总蛋白,SDS - PAGE电泳后转印到PVDF膜上,用含5%脱脂奶粉的封闭液常温封闭1 h,加入一抗,4 ℃反应过夜,再用辣根过氧化物酶标记的二抗室温下反应0.5 h,化学发光法显影;利用Image J 软件对目的条带进行灰度值检测,以β-actin为内参照分析蛋白相对表达量。
1.9 统计学处理
2 结果(Results)
2.1 PM2.5对A549细胞增殖抑制作用
PM2.5处理A549细胞72 h后采用MTT 法检测各组吸光度,计算PM2.5对A549细胞的增殖抑制率。如图1和表1所示,与对照组比较,2.5、10、40和160 μg·mL-1PM2.5组对A549细胞的增殖抑制率随浓度升高而增加,分别为(3.08% ± 3.73%)、(10.37% ± 5.97%)、(34.00% ± 6.39%) 和(51.01% ± 8.37%)。 选取对A549细胞增殖抑制作用较弱的2个浓度(2.5 μg·mL-1和10 μg·mL-1)进行后续实验。
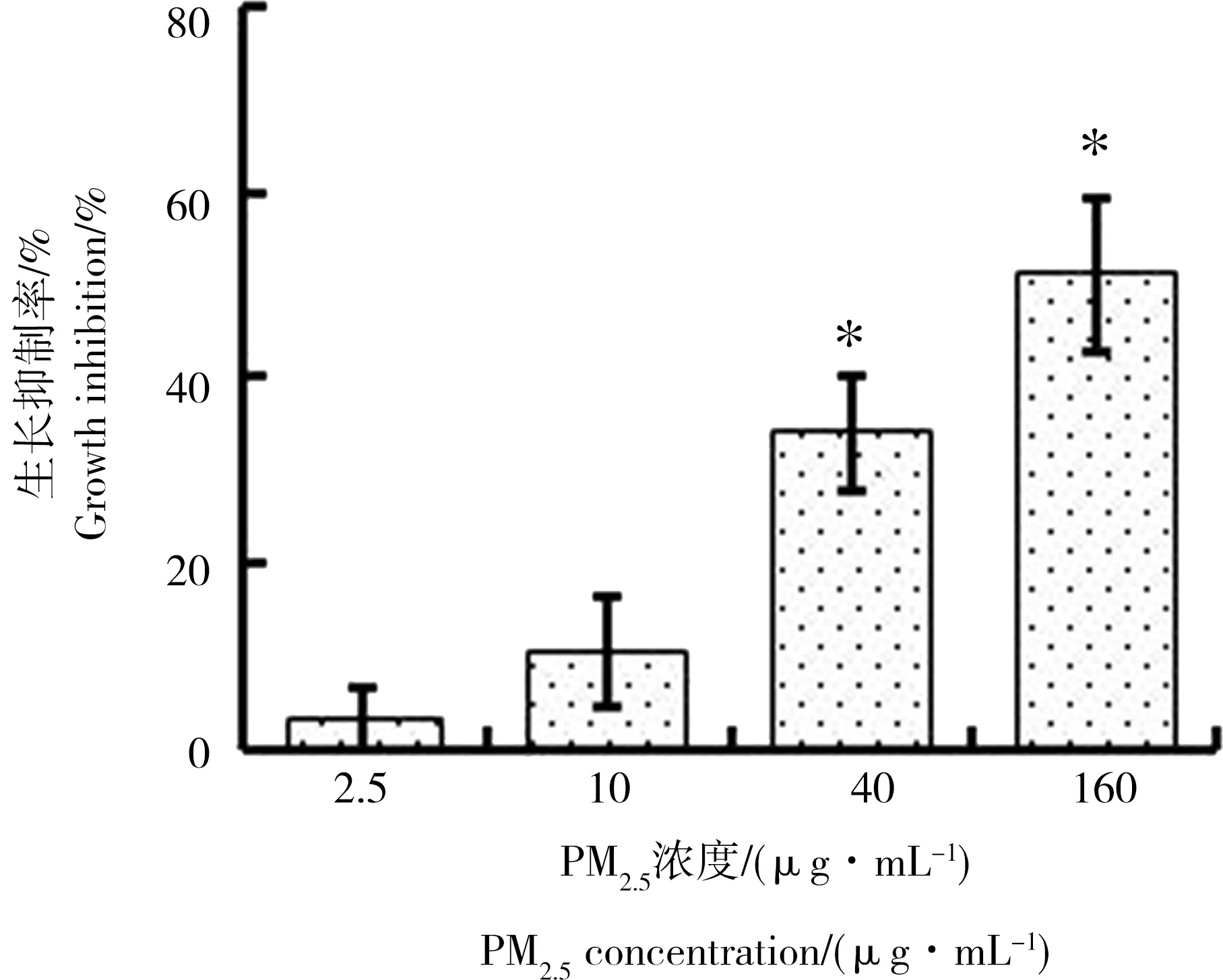
图1 PM2.5对A549细胞的生长抑制作用Fig. 1 Inhibition of PM2.5 on growth of A549
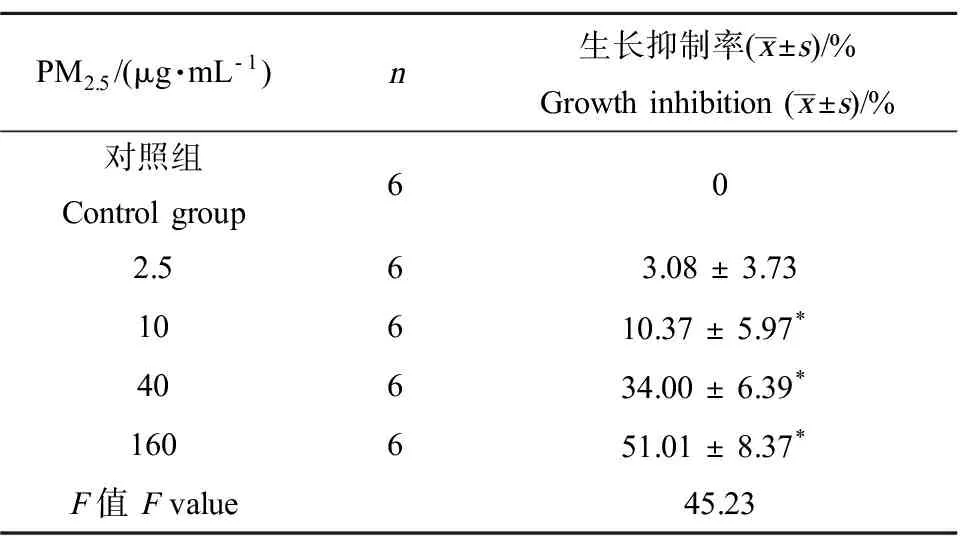
表1 PM2.5对A549细胞的生长抑制作用Table 1 Inhibition of PM2.5 on growth of A549
注:与对照组比较,*为P<0.05。
Note: compared with control group,*P<0.05.

图2 PM2.5促进A549细胞的迁移和侵袭注: A为细胞划痕实验检测A549细胞迁移能力(×50);2B为Transwell法检测A549细胞迁移能力(a~d)和侵袭能力(e~h)(×200) 。Fig. 2 PM2.5 promotes migration and invasion of A549 cellsNote: A showed the migration ability of A549 cells detected by wound healing assay (×50); B showed the migration ability (a-d) and invasion ability (e-h) of A549 cells detected by transwell assay (×200).

图3 Western Blotting 法检测PM2.5 处理72 h后细胞核内β-catenin蛋白表达的变化注:与对照组比较,*为 P<0.05。Fig. 3 The expression levels of β-catenin proteins after exposure to PM2.5 for 72 h were analyzed by Western BlottingNote: compared with control group, *P<0.05.
2.2 PM2.5可增强A549细胞的迁移、侵袭能力
划痕实验结果如图2A和表2所示:划痕后24 h,对照组创面愈合率为(31.97%±1.80%)、2.5 μg·mL-1和10 μg·mL-1PM2.5组创面愈合率分别为(37.59%±3.08%)和(46.34%±5.19%)。与对照组相比,10 μg·mL-1PM2.5组A549细胞的创面愈合率明显增加(P<0.05)。Transwell小室法迁移和侵袭实验结果如图2B和表2 所示:对照组、2.5 μg·mL-1和10 μg·mL-1PM2.5组中穿过基膜的细胞数分别为(118.67 ± 4.5) 个和(32.33 ±2.73) 个,(122.50 ± 6.53) 个和(35.5 ± 5.17) 个,(165.67 ± 6.62) 个和(47.83 ± 2.04) 个。与对照组相比,10 μg·mL-1PM2.5组小室滤膜下表面的细胞个数明显增多(P<0.05)。上述结果表明10 μg·mL-1PM2.5可使A549细胞的迁移、侵袭能力增高。
2.3 PM2.5增强A549细胞Wnt/β-catenin信号通路活性

表2 PM2.5促进A549细胞的迁移和侵袭Table 2 PM2.5 promotes migration and invasion of A549 cells
注:与对照组比较,*为P<0.05。
Note: compared with control group,*P<0.05.
PM2.5处理A549细胞后,Western Blotting 法检测细胞核内β-catenin蛋白表达的变化。结果如图3和表3所示:给予A549细胞2.5 μg·mL-1和10 μg·mL-1的PM2.5处理72 h后,与对照组相比,10 μg·mL-1PM2.5组细胞核内β-catenin蛋白表达水平明显增高(P<0.05)。
2.4 PM2.5上调A549细胞中cyclin D1、snail、slug、MMP-2 和MMP-9的蛋白表达
PM2.5处理A549细胞后,Western Blotting 法检测细胞内cyclin D1、snail、slug、MMP-2 和MMP-9蛋白表达的变化。结果如图4和表4所示:给予A549细胞2.5 μg·mL-1和10 μg·mL-1的PM2.5处理72 h后,与对照组相比,10 μg·mL-1PM2.5组细胞内cyclin D1、snail、slug、MMP-2 和MMP-9的蛋白表达明显增高(P<0.05)。
3 讨论(Discussion)

表3 PM2.5对肺癌A549细胞核内β-catenin蛋白相对表达的影响Table 3 The effect of PM2.5 on the expression of β-catenin protein in A549 cells nucleus (±s,n=6)
注:与对照组比较,*为P<0.05。
Note: compared with control group,*P<0.05.
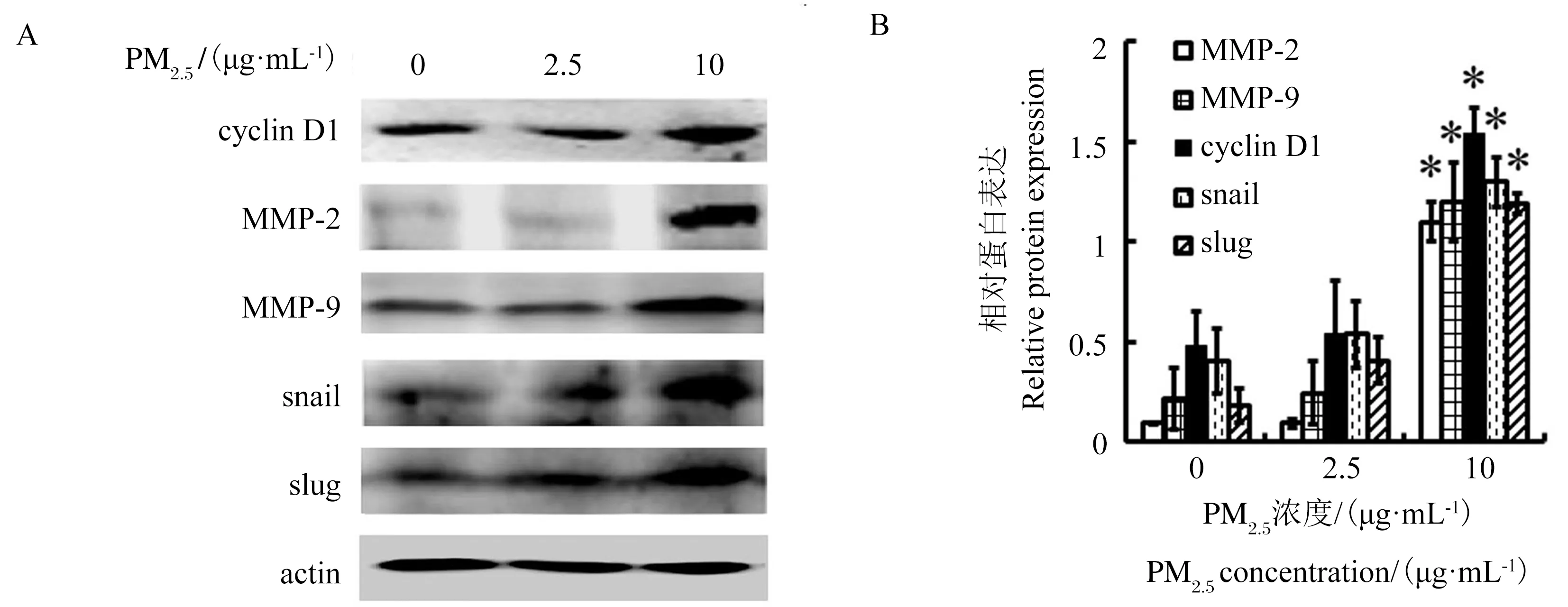
图4 Western Blotting 法检测加入PM2.5 72 h后细胞内cyclin D1、snail、slug、MMP-2 和MMP-9蛋白表达的变化注:与对照组比较,*为 P<0.05。Fig. 4 The expression levels of cyclin D1, snail, slug, MMP-2 and MMP-9 proteins after treated with PM2.5 for 72 h were analyzed by Western BlottingNote: compared with control group, *P<0.05.
注:与对照组比较,*为P<0.05。
Note: compared with control group,*P<0.05.
肿瘤细胞的转移是肺癌患者复发以及治疗失败的重要原因。以往关于PM2.5对肺癌影响的研究多集中其致癌细胞损伤或者死亡的作用方面[10, 14-16],而关于PM2.5是否可促进肺癌的早期转移的研究尚少见报道。本研究通过transwell迁移、侵袭实验和细胞划痕实验检测PM2.5对肺癌A549细胞迁移、侵袭能力的影响,结果显示在无血清条件下较低浓度(10 μg·mL-1)的PM2.5作用72 h即可明显增强肺癌细胞迁移、侵袭能力,说明PM2.5可能具有促进肺癌的早期转移的作用。
肿瘤细胞的转移过程非常复杂,涉及多条信号通路、转录因子及酶的活化。Wnt/β-catenin信号传导通路在肿瘤细胞转移过程中起着重要作用,该通路激活时,过量的β-catenin从胞质中转移入细胞核,在核内与转录因子T细胞因子/淋巴增强因子(T cell factor, TCF/lymphoid enhancer factor, LEF)相互作用,激活下游大量具有促进肿瘤细胞转移功能的基因转录,如基质金属蛋白酶、cyclin D1、slug、snail等,进而增强肿瘤细胞转移能力[17-20]。本研究通过检测细胞核内β-catenin的表达水平证明在无血清条件下较低浓度的PM2.5(10 μg·mL-1)作用72 h即可明显激活肺癌A549细胞Wnt/β-catenin信号通路。
基质金属蛋白酶家族是降解细胞外基质的重要酶类。肿瘤细胞周围细胞外基质的降解是肿瘤侵袭和转移的必要条件,因此金属蛋白酶家族在肿瘤细胞迁移和侵袭过程中发挥重要作用。多种肿瘤(包括非小细胞肺癌)中均可见金属蛋白酶家族过表达。基质金属蛋白酶-2和基质金属蛋白酶-9是基质金属蛋白酶家族内的重要成员,同属于IV型明胶酶,主要降解细胞间基质及基底膜主要成分IV型胶原,促进肿瘤细胞侵袭和扩散,因此其在肿瘤转移过程中具有重要作用[20-21]。研究表明:Wnt/β-catenin信号通路的激活能够使MMP-2和MMP-9的表达水平增高[18]。如Dong等[22]的研究表明:电离辐射可通过激活Wnt/β-catenin信号通路使其下游包括MMP-2和MMP-9在内的多种基因表达上调,增强胶质瘤细胞U87侵袭能力。本研究中Western Blotting实验结果表明:在无血清条件下较低浓度(10 μg·mL-1)的PM2.5作用72 h即可使MMP-2和MMP-9蛋白表达水平的上调,说明PM2.5增强肺癌A549细胞迁移、侵袭能力作用与其激活Wnt/β-catenin信号通路并通过上调其下游MMP-2和MMP-9蛋白表达相关。
cyclin D1是细胞周期蛋白家族的一个成员,在调控细胞周期进展过程中发挥重要作用,此外cyclin D1还是一个癌基因,在多种肿瘤包括肺癌中呈高表达[23-24]。越来越多的研究表明,cyclin D1与肿瘤的转移关系密切[25]。如Li等[26]的报道称,cyclin D1通过抑制ROCK信号和转移抑制因子TSP-1而增强细胞的运动能力。此外,细胞周期蛋白D1提高MMPs的表达和活性,从而提高侵袭性。如Arato-Ohshima等[27]的研究表明cyclin D1蛋白的过度表达可增加MMP-2和MMP-9的活性并增强脑胶质瘤细胞的侵袭性。
锌指蛋白转录因子snail超家族包括snail(snail 1)和slug (snail 2)2个成员,二者作为转录因子,调控某些基因的表达,如下调细胞间的紧密连接成分如ZO-1及上调肿瘤细胞的金属蛋白酶类的表达,这些均有助于增加细胞的迁徙转移力,尤其常见于各种肿瘤的癌性细胞向远处转移机制中[28-32]。如Wang等[33]的研究表明:snail促进MMP-9表达,并且二者均与甲状腺乳头状癌的淋巴结转移有关。Li等[34]报道snail介导的MMP-2上调与细胞侵袭性增强有关。Qiao等[35]关于口腔鳞状细胞癌的研究证明:snail通过上调MMP-2和MMP-9促进细胞发生上皮间质转化,转移能力增强。Bolos等[36]和Chandler[37]研究发现,slug通过调控靶基因MMP-2影响细胞Ⅳ型胶原和明胶的降解,进而参与肿瘤细胞的侵袭与转移。Qiao等[35]和Yue等[38]报道slug能够上调MMP-9的表达。Wnt/β-catenin信号转导途径可调控snail和slug表达水平,当Wnt信号被激活,稳定的β-catenin进入细胞核内与TCF/LEF相互作用,形成的复合物可使snail和slug转录,核内水平增加[39]。
本研究中较低浓度的PM2.5(10 μg·mL-1)作用72 h即可明显上调cyclin D1、snail和slug的蛋白表达水平,说明Wnt/β-catenin信号通路激活同时上调了某些其下游蛋白的表达,而这些蛋白的高表达又可进一步上调MMP-2和MMP-9的表达,促进肿瘤细胞的转移和侵袭。
综上所述,本研究发现将人肺癌A549细胞在无血清条件下暴露于较低浓度的PM2.5(10 μg·mL-1)72 h,能够使细胞的侵袭、转移能力增强,此作用与PM2.5活化Wnt/β-catenin信号传导通路,上调细胞cyclin D1、MMP-2、MMP-9及转录因子snail和slug的蛋白表达水平有关。
[1] 李娟, 杨维超, 洪丽娟, 等. PM2.5对BEAS-2B细胞脂质过氧化损伤作用[J]. 中国公共卫生, 2014, 30(11): 1389-1391
Li J, Yang W C, Hong L J, et al. Lipid peroxidation induced by PM2.5in human bronchial epithelial cells[J]. Chinese Journal of Public Health, 2014, 30(11): 1389-1391 (in Chinese)
[2] Kim J Y, Lee E Y, Choi I, et al. Effects of the particulate matter 2.5 (PM2.5) on lipoprotein metabolism, uptake and degradation, and embryo toxicity [J]. Molecules and Cells, 2015, 38(12): 1096-1104
[3] Eckel S P, Cockburn M, Shu Y H, et al. Air pollution affects lung cancer survival [J]. Thorax, 2016, 71(10): 891-898
[4] Xu X, Ha S, Kan H, et al. Health effects of air pollution on length of respiratory cancer survival [J]. BMC Public Health, 2013, 13: 800
[5] Yue H, Yun Y, Gao R, et al. Winter polycyclic aromatic hydrocarbon-bound particulate matter from peri-urban north China promotes lung cancer cell metastasis [J]. Environmental Science and Technology, 2015, 49(24): 14484-14493
[6] Li X, Lv Y, Gao N, et al. microRNA-802/Rnd3 pathway imposes on carcinogenesis and metastasis of fine particulate matter exposure [J]. Oncotarget, 2016, 7(23): 35026-35043
[7] 孟梅, 周泉生. PM2.5引起的肿瘤新生血管形成和转移的研究进展[J]. 科技导报, 2014, 32(26): 52-57
Meng M, Zhou Q S. Progress in PM2.5-caused tumor neovascularization and metastasis [J]. Science Technology Review, 2014, 32(26): 52-57 (in Chinese)
[8] Xing Y F, Xu Y H, Shi M H, et al. The impact of PM2.5on the human respiratory system [J]. Journal of Thoracic Disease, 2016, 8(1): E69-E74
[9] Zhou W, Tian D, He J, et al. Repeated PM2.5exposure inhibits BEAS-2B cell P53 expression through ROS-Akt-DNMT3B pathway-mediated promoter hypermethylation[J]. Oncotarget, 2016, 7(15): 20691-20703
[10] Deng X, Zhang F, Rui W, et al. PM2.5-induced oxidative stress triggers autophagy in human lung epithelial A549 cells [J]. ToxicologyInVitro, 2013, 27(6): 1762-1770
[11] Vattanasit U, Navasumrit P, Khadka M B, et al. Oxidative DNA damage and inflammatory responses in cultured human cells and in humans exposed to traffic-related particles [J]. International Journal of Hygiene and Environmental Health, 2014, 217(1): 23-33
[12] 牛佳玉, 肖纯凌, 陈冬梅, 等. PM2.5对高血压(SHR/NCrl)大鼠呼吸道菌群的影响[J]. 卫生研究, 2016, 45(4): 648-652
Niu J Y, Xiao C L, Chen D M, et al. Effect of PM2.5on respiratory tract flora in SHR/NCrl rats [J]. Journal of Hygiene Research, 2016, 45(4): 648-652 (in Chinese)
[13] 杨彪, 李新鸣, 严思远, 等. PM2.5暴露对鸦胆子油乳治疗荷瘤肺癌小鼠腹腔巨噬细胞的作用[J]. 中国当代医药, 2016, 23(6): 15-21
Yang B, Li X M, Yan S Y, et al. Effect of PM2.5exposure for peritoneal macrophages of tumor-bearing mice with lung cancer treated by bruceolic oil emulsion[J]. China Modern Medicine, 2016, 23(6): 15-21 (in Chinese)
[14] Zou Y, Jin C, Su Y, et al. Water soluble and insoluble components of urban PM2.5and their cytotoxic effects on epithelial cells (A549)invitro[J]. Environmental Pollution, 2016, 212: 627-635
[15] Wang H, Guo Y, Liu L, et al. DDAH1 plays dual roles in PM2.5induced cell death in A549 cells[J]. Biochimica Biophysica Acta, 2016, 1860(12): 2793-2801
[16] Li X, Ding Z, Zhang C, et al. MicroRNA-1228(*) inhibit apoptosis in A549 cells exposed to fine particulate matter[J]. Environmental Science and Pollution Research, 2016 , 23(10): 10103-10113
[17] Ben-Josef E, George A, Regine W F, et al. Glycogen synthase kinase 3 beta predicts survival in resected adenocarcinoma of the pancreas[J]. Clinical Cancer Research, 2015, 21(24): 5612-5618
[18] Park B B, Yoon J, Kim E, et al. Inhibitory effects of eupatilin on tumor invasion of human gastric cancer MKN-1 cells [J]. Tumor Biology, 2013, 34(2): 875-885
[19] 杨丹, 王丽, 李珠, 等. 棉酚通过Akt/β-catenin通路抑制胃癌细胞迁移[J].中国药理学通报, 2015, 31(6): 860-864
Yang D, Wang L, Li Z, et al. Inhibitory effect of gossypol on migration of gastric carcinoma cell lines through Akt /β-catenin passway[J]. Chinese Pharmacological Bulletin, 2015, 31(6): 860-864 (in Chinese)
[20] Pei S, Yang X, Wang H, et al. Plantamajoside, a potential anti-tumor herbal medicine inhibits breast cancer growth and pulmonary metastasis by decreasing the activity of matrix metalloproteinase-9 and -2 [J]. BMC Cancer, 2015, 15: 965
[21] Lu X, Duan L, Xie H, et al. Evaluation of MMP-9 and MMP-2 and their suppressor TIMP-1 and TIMP-2 in adenocarcinoma of esophagogastric junction[J]. Journal of Oncotargets and Therapy, 2016, 9: 4343-4349
[22] Dong Z, Zhou L, Han N, et al. Wnt/β-catenin pathway involvement in ionizing radiation-induced invasion of U87 glioblastoma cells[J]. Strahlentherapie und Onkologie, 2015, 191(8): 672-680
[23] Hwang S J, Lee H W, Kim H R, et al. Overexpression of microRNA-95-3p suppresses brain metastasis of lung adenocarcinoma through downregulation of cyclin D1 [J]. Oncotarget, 2015, 6(24): 20434-20448
[24] Gautschi O, Ratschiller D, Gugger M, et al. Cyclin D1 in non-small cell lung cancer: A key driver of malignant transformation [J]. Lung Cancer, 2007, 55: 1-14
[25] DrobnJak M, Osman I, Scher H I, et al. Overexpression of cyclin D1 is associated with metastatic prostate cancer to bone [J]. Clinical Cancer Research, 2000, 6: 1891-1895
[26] Li Z, Wang C, Jiao X, et al. Cyclin D1 regulates cellular migration through the inhibition of thrombospondin 1 and ROCK signaling [J]. Molecular and Cellular Biology, 2006, 26: 4240-4256
[27] Arato-Ohshima T, Sawa H. Over-expression of cyclin D1 induces glioma invasion by increasing matrix metalloproteinase activity and cell motility[J]. International Journal of Cancer, 1999, 83: 387-392
[28] Miyoshi A. Snail accelerates cancer invasion by upregulating MMP expression and is associated with poor prognosis of hepatocelllar carcinoma [J]. British Journal of Cancer, 2005, 92(2): 252-258
[29] Li D, Sun H, Sun W J, et al. Role of RbBP5 and H3K4me3 in the vicinity of snail transcription start site during epithelial- mesenchymal- transition in prostate cancer cell [J]. Oncotarget, 2016, 7(40): 65553-65567
[30] Ito K, Park S H, Nayak A, et al. PTK6 inhibition suppresses metastases of triple-negative breast cancer via Snail-dependent E-cadherin regulation [J]. Cancer Research, 2016, 76(15): 4406-4417
[31] Yin S, Wang P, Yang L, et al. Wip1 suppresses ovarian cancer metastasis through the ATM/AKT/Snail mediated signaling [J]. Oncotarget, 2016, 7(20): 29359-29370
[32] Zhang J, Liu Y, Zhang J, et al. FOXQ1 promotes gastric cancer metastasis through upregulation of snail [J]. Oncology Reports, 2016, 35(6): 3607-3613
[33] Wang N, Jiang R, Yang J Y, et al. Expression of TGF-β1, SNAI1 and MMP-9 is associated with lymph node metastasis in papillary thyroid carcinoma [J]. Journal of Molecular Histology, 2014, 45(4): 391-399
[34] Li Y, Klausen C, Zhu H, et al. Activin A increases human trophoblast invasion by inducing Snail-mediated MMP2 up-regulation through ALK4 [J]. The Journal of Clinical Endocrinology and Metabolism, 2015, 100(11): E1415-E1427
[35] Qiao B, Johnson NW, Gao J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions[J]. International Journal of Oncology, 2010, 37(3): 663-668
[36] Bolos V, Peinado H, Pérez-Moreno M A, et al. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: A comparison with Snail and E47 repressors [J]. Journal of Cell Science, 2003, 116 (Pt3): 499-511
[37] Chandler H L, Kusewitt D F, Colitz C M. Modulation of matrix metalloproteinases by ultraviolet radiation in the canine cornea [J]. Veterinary Ophthalmology, 2008, 11(3): 135-144
[38] Yue B, Ren Q X, Su T, et al. ERK5 silencing inhibits invasion of human osteosarcoma cell via modulating the Slug/MMP-9 pathway [J]. European Review for Medical Pharmacological Sciences, 2014, 18(18): 2640-2647
[39] 刘锦华, 唐旭东. Slug的分子调控机制[J]. 生命的化学, 2013, 33(5): 554-562
Liu J H, Tang X D. Molecular mechanisms of regulation of Slug [J]. Chemistry of Life, 2013, 33(5): 554-562 (in Chinese)

