羧基化多壁碳纳米管对蛋白核小球藻的生物学效应研究
罗潇宇,任垠安,高浩杰,高恩光,王应军
四川农业大学环境学院,成都 611130
碳纳米管(Carbon Nanotubes, CNTs)最先由日本NEC公司基础实验室的Iijima教授发现[1]。它是由石墨碳原子层卷曲而成的无缝、中空管体;多层石墨片卷成的称为多壁碳纳米管(Multi-walled Carbon Nanotubes, MWCNTs);其直径为几纳米到几十纳米,具有优良的力学、光学、化学和电学等特性,应用广泛[2]。纳米材料因具有较大的比表面积和独特的催化性能而具有比相同组成的较大颗粒更大的毒性[5]。不容忽视的是,CNTs在生产、使用和废弃过程中都难免会进入环境之中,并造成一定的生态效应和人群暴露。而进入大气、水和土壤的CNTs量在接下来的时间里会持续增加且在环境中难以测定其浓度[6]。CNTs释放到水体环境中与其他污染物相互作用可以改变污染物的生物有效性和生物毒性。研究发现,低浓度(5 μg·g-1)MWCNTs不影响Cd对铜锈环棱螺的毒性,中、高浓度Cd(25、100 μg·g-1)条件下MWCNTs显著增加Cd的毒性[7],意味着MWCNTs释放到水体环境中与其他污染物相互作用可以改变污染物的生物有效性和生物毒性。功能化MWCNTs能穿过细胞膜进入细胞,定位于胞浆中的空泡内,造成细胞内活性氧(reactive oxygen species,ROS)含量升高,导致细胞毒性[8-9]。此外,还有研究发现:不同剂量(2.5、5、10 mg·kg-1)羧基化多壁碳纳米管(MWCNT-COOH)引起大鼠睾丸组织不同程度的损伤[9];通过基因结果发现,MWCNT-COOH可能主要通过影响睾丸组织MAPKs通路中的P38和JNK信号通路而对生殖产生影响[10]。也有研究表明MWCNTs-COOH与原始MWCNTs相比,在低浓度(12.5 mg·L-1、25 mg·L-1)时具有更好的生物相容性[11]。但至今有关其生物学效应的机制还尚未明确,还有待进一步研究。
藻类作为水环境中的生产者,在整个水生态系统中占重要的地位,它们的数量和种类的多样性,直接影响整个水生态系统的结构和功能,对保持生态系统的平衡和稳定起着十分重要的作用[12]。本研究选取蛋白核小球藻(Chlorellapyrenoidosa)为受试生物,它是一种普生性单细胞绿藻,直径3~8 μm,常作为水生态毒性研究指示生物[13]。
本文通过研究MWCNTs-COOH对蛋白核小球藻叶绿素a含量、可溶性蛋白含量、总抗氧化能力(Total Antioxidant Capacity, T-AOC)及丙二醛(Malondialdehyde,MDA)含量等的影响,探究了MWCNTs-COOH对蛋白核小球藻的生物学效应机制,为评估MWCNTs-COOH对微藻的生物学效应及其环境风险提供一定的数据资料和科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
蛋白核小球藻(C.pyrenoidosa, FACHB-5)购自中国科学院野生生物种质库——淡水藻种库。在超净台中,将藻种转接到灭菌之后的BG11培养基中,在25 ℃、光照度3 000~4 000 lux、光周期12 h Light/ 12 h Dark的光照培养箱(RXZ型智能人工气候箱,宁波,江南仪器厂)中,每天定时摇瓶3次。BG11培养基配方如Wu等[14]在其文献中所述。
MWCNTs-COOH(OD:10~20 nm, Length: 10~30 μm, 纯度>98 wt%)购自中科时代纳米成都有机化学有限公司,将定量的MWCNTs-COOH分散到BG11培养基中,配成4 mg·L-1的母液,再灭菌待用,实验使用前置于超声波清洗机(KQ5200DE型数控超声波清洗机,200 W、40 kHz,昆山超声仪器有限公司)超声30 min,使得MWCNTs-COOH分散液更为均匀。可溶性蛋白、T-AOC和MDA试剂盒购自南京建成生物科技有限公司;其他试剂均为分析纯。
1.2 实验方法
1.2.1 MWCNTs-COOH表征
MWCNTs-COOH结构表征前在105 ℃烘箱中干燥24 h。热重分析(TGA)研究材料的热稳定性;扫描电镜(SEM)表征碳纳米管的微观形貌结构。
1.2.2 藻种的活化培养
选取处于对数增长期的蛋白核小球藻(Chlorellapyrenoidosa),在无菌条件下转接到BG11培养基中,于上述藻培养条件下活化1周,再进一步扩大培养以满足实验需求。
1.2.3 暴露实验
本文参照OECD 201藻类生长抑制实验方法[14],将蛋白核小球藻接种在灭菌后的三角锥形瓶中,其初始藻接种藻密度为10×105cells·mL-1, 再加入定量MWCNTs-COOH母液,使其最终实验浓度为0、5、10、20、40、80 mg·L-1,暴露96 h。每组实验设3个重复。
1.2.4 叶绿素a的测定
由于培养基中MWCNTs-COOH与藻细胞不易分离,本文采用叶绿素a表征藻细胞生物量,在实验室条件下,叶绿素a与生物量呈显著正相关关系[15]。从0 h到96 h每天定时取5 mL藻液, 8 000 r·min-1离心10 min,弃上清液,加入5 mL 90%丙酮(V/V),摇匀,放入冰箱,4 ℃避光萃取24 h以提取蛋白核小球藻细胞中的叶绿素a[16];把萃取过后的叶绿素a提取液置于高速离心机中,10 000 r·min-1离心10 min取上清液,以90%丙酮作为参比,置于分光光度计中分别测定上清液在波长分别为630 nm、645 nm、663 nm和750 nm时的吸光度。采用文献[17]的方法计算:
C(μg·mL-1)=11.64×(A663-A750)-2.16×(A645-A750)+0.10×(A630-A750)
1.2.5 可溶性蛋白含量、T-AOC和MDA含量的测定
在实验96 h时分别取每个锥形瓶中藻液40 mL,4 500 r·min-1离心10 min,弃上清液,用5 mL生理盐水悬浮洗涤2~3次以除去附着在蛋白核小球藻表面的培养基,再离心,之后就可得到藻细胞。然后把藻细胞转移至研钵中,加入2 mL预冷的生理盐水和少量的石英砂进行冰浴研磨,直到镜检无完整藻细胞为止,定容到10 mL,4 ℃下5 000 r·min-1离心10 min,上清液即为样本提取粗酶液。可溶性蛋白含量测定采用考马斯亮蓝法[18],MDA含量测定采用硫代巴比妥酸法(TBA法)[18]。
1.3 数据分析
采用SPSS 22.0对数据进行方差分析及t检验,P<0.05表示有显著性差异,用*表示。采用Origin进行图表绘制。
2 结果(Results)
2.1 MWCNTs-COOH表征

图1 多壁碳纳米管(MWCNTs)表征谱图Fig. 1 The characterization spectra of multi-walled carbon nanotubes (MWCNTs)
厂家提供的原始多壁碳纳米管TGA、SEM表征图分别如图1-a和图1-b所示,MWCNTs-COOH 的TGA、SEM图分别如图1-c和图1-d所示。对比可知,MWCNTs-COOH碳管被截短,管身发生断裂,端口被打开,表面变得光滑平整,分散性提高,部分碳管管径明显变粗。
2.2 MWCNTs-COOH对C. pyrenoidosa叶绿素a含量的影响
图2显示了在不同MWCNTs-COOH浓度条件下,C.pyrenoidosa叶绿素a含量的变化情况,选取浓度为0 mg·L-1的实验组为对照组。在低浓度条件下(5 mg·L-1),C.pyrenoidosa的叶绿素a含量呈逐日上升趋势,与空白组差异不显著(P>0.05)。在中、高浓度(10, 20 mg·L-1)条件下,24 h叶绿素a含量低于中高浓度组初始含量,之后又恢复逐日增长的趋势,尤其是20 mg·L-1实验组在暴露72 h时取得最大值1.024 μg·mL-1,与其他组相比差异显著(P<0.05)。而在高浓度(40, 80 mg·L-1)暴露下,每个实验组叶绿素a含量均呈先降低后升高再降低的趋势,且24 h后与对照组叶绿素a含量差异显著(P<0.05)。以上现象表明,5 mg·L-1实验组C.pyrenoidosa生长未受到明显影响(P>0.05);10、20 mg·L-1实验组C.pyrenoidosa在初期受到实验材料一定影响,但很快就恢复良好的生长状态;而40、80 mg·L-1实验组的C.pyrenoidosa随着实验时间的延长,生长受到明显抑制(P<0.05)。
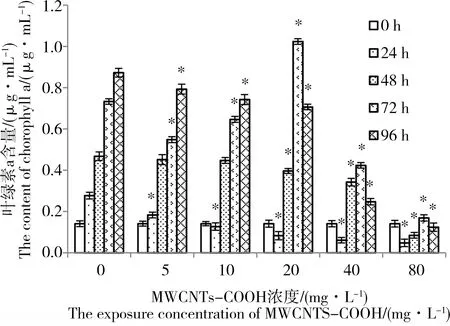
图2 不同浓度MWCNTs-COOH对蛋白核小球藻(C. pyrenoidosa)叶绿素a含量的影响注:*表示与对照组有显著差异,P<0.05。Fig. 2 Effect of MWCNTs-COOH on the chlorophylla content in C. pyrenoidosaNote: * indicates a significant difference from the control group, P <0.05.
2.3 MWCNTs-COOH对C. pyrenoidosa可溶性蛋白含量的影响
图3揭示了不同浓度MWCNTs-COOH对C.pyrenoidosa暴露96 h后,C.pyrenoidosa的可溶性蛋白含量变化。由图3可知C.pyrenoidosa中的可溶性蛋白含量随MWCNTs-COOH暴露浓度的增加呈先上升后下降的趋势。20 mg·L-1实验组取得最大可溶性蛋白含量为0.051 g ·L-1, 与对照组比较,40、80 mg·L-1实验组可溶性蛋白含量明显下降(P<0.05)。
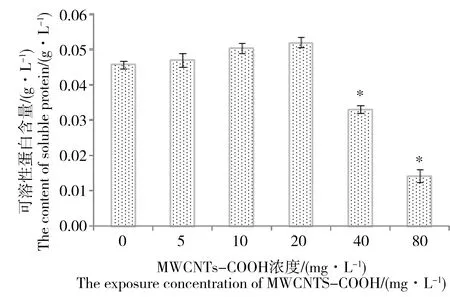
图3 不同浓度MWCNTs-COOH对蛋白核小球藻(C. pyrenoidosa)可溶性蛋白含量的影响注:*表示与对照组有显著差异,P<0.05。Fig. 3 Effect of MWCNTs-COOH on the soluble protein content in C. pyrenoidosaNote: * indicates a significant difference from the control group, P <0.05.
2.4 总抗氧化能力(T-AOC)对MWCNTs-COOH胁迫的响应
图4显示了C.pyrenoidosa在不同浓度MWCNTs-COOH暴露96 h后,机体抗氧化能力的高低。C.pyrenoidosa的T-AOC值随着MWCNTs-COOH胁迫浓度的增加,呈降低趋势。在低浓度条件下(5 mg·L-1),C.pyrenoidosa的T-AOC值变化不明显(P>0.05),表明C.pyrenoidosa对低浓度的MWCNTs-COOH表现出一定的耐性;在中、高浓度(10, 20 mg·L-1)条件下实验组的T-AOC值低于对照组(P>0.05),表明C.pyrenoidosa的抗氧化能力受到一定程度破坏,机体健康状态可能进一步恶化;40、80 mg·L-1实验组T-AOC值明显降低(P<0.05),表明C.pyrenoidosa的抗氧化能力已经遭到破坏,40、80 mg·L-1的MWCNTs-COOH处理对C.pyrenoidosa造成了氧化损伤。

图4 不同浓度MWCNTs-COOH对蛋白核小球藻(C. pyrenoidosa)T-AOC的影响注:*表示与对照组有显著差异,P<0.05。Fig. 4 Effect of MWCNTs-COOH on the T-AOC in C. pyrenoidosaNote: * indicates a significant difference from the control group, P <0.05.
2.5 MWCNTs-COOH胁迫下C. pyrenoidosa中MDA含量的变化
图5显示了在不同浓度MWCNTs-COOH胁迫下C.pyrenoidosa中MDA含量变化情况。与对照组相比,低浓度(5 mg·L-1)实验组MDA含量变化不明显(P>0.05),中高浓度(10, 20 mg·L-1)及更高浓度实验组藻细胞MDA含量明显升高(P<0.05)。总体上,C.pyrenoidosa中MDA含量随着MWCNTs-COOH浓度的升高而增加,其中藻细胞MDA含量最大值12.84 nmol·mg-1prot在80 mg·L-1实验组取得,表明随着MWCNTs-COOH浓度的升高,C.pyrenoidosa受到的氧化胁迫变大,膜脂质过氧化作用加剧,藻细胞损伤愈加严重。
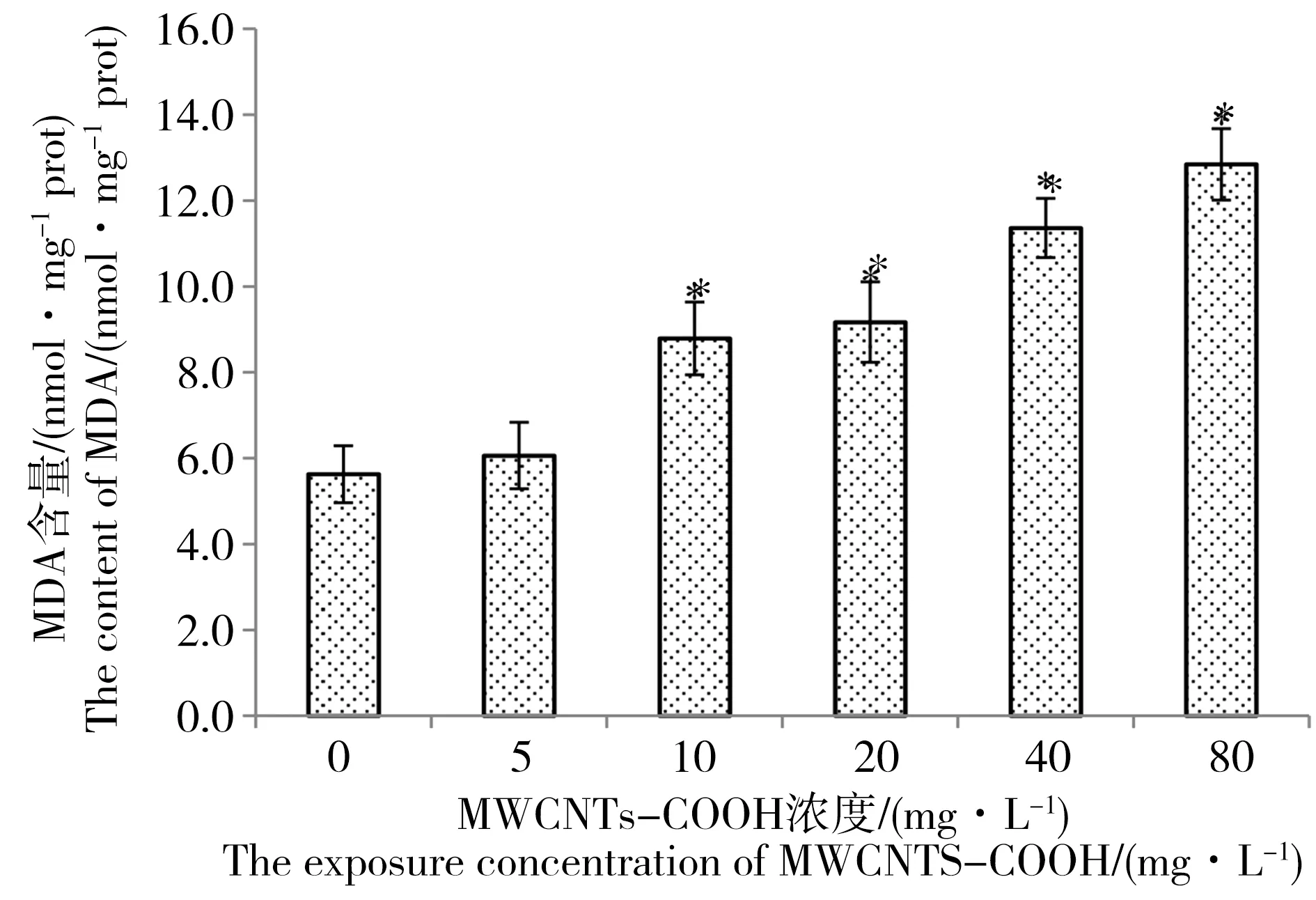
图5 不同浓度MWCNTs-COOH对蛋白核小球藻(C. pyrenoidosa)MDA含量的影响注:*表示与对照组有显著差异,P<0.05。Fig. 5 Effect of MWCNTs-COOH on the content of MDA in C. pyrenoidosaNote: * indicates a significant difference from the control group, P<0.05.
3 讨论(Discussion)
目前,碳纳米管的实际环境浓度还不清楚,但这并不影响研究者们对其环境毒性效应研究的关注[19-20]。叶绿素a存在于所有绿色植物中,是叶绿素的重要组成成分,能够吸收和转换光能;同时,实验条件下的藻类叶绿素a与生物量呈显著正相关关系。在本实验中,叶绿素a含量既代表了C.pyrenoidosa生物量的高低,又能在一定程度上反映藻细胞在受到胁迫时进行光合作用能力的强弱;在高浓度(≥40 mg·L-1)条件下,实验组叶绿素a含量均呈先降低后升高再降低的趋势,可能是由于在实验开始,由高浓度MWCNTs-COOH引起的遮蔽效应大于剂量效应。随着时间的延长,当MWCNTs-COOH在实验组藻液中分散趋于稳定后,剂量效应占主要地位,C.pyrenoidosa生长受到抑制,藻细胞内的叶绿素酸酯还原酶合成受到抑制,影响了氨基-r-酮戊酸的合成,从而使叶绿素a含量降低[21]。这与龙志峰[22]的研究结果类似。蛋白质是生物体和酶蛋白的物质基础,对生物体的代谢活性有很大影响[23]。暴露96 h后,中、高浓度(10、20 mg·L-1)反而刺激C.pyrenoidosa细胞可溶性蛋白的合成,可能是由于随着MWCNTs-COOH浓度的升高,胞内开始积累ROS,C.pyrenoidosa细胞为应对这种环境胁迫和维持胞内ROS平衡,抗氧化系统介入,通过合成更多抗氧化酶来抵御胁迫,使细胞免受或减缓环境胁迫对其的破坏,而胞内抗氧化酶均属于可溶性蛋白[23]。暴露在高浓度(≥40 mg·L-1),MWCNTs-COOH对C.pyrenoidosa表现出毒性效应;细胞自身的抗氧化系统已不足以抵御由于MWCNTs-COOH浓度上升导致的环境胁迫,细胞活性降低;同时,进入藻细胞内的MWCNTs-COOH会增强蛋白质水解酶的活性,加快蛋白质水解,表现为可溶性蛋白含量减少[24]。机体防御体系的抗氧化能力的强弱与健康程度存在着密切的联系,该防御体系有酶促与非酶促2个体系,体系各成分之间相互起到协同作用,以及代偿作用与依赖作用。T-AOC越强说明机体受胁迫能力越强,机体健康状态良好;反之,机体受胁迫能力越弱,健康状态不佳。在中高浓度以下(≤20 mg·L-1),由于C.pyrenoidosa细胞未受胁迫或通过自身抗氧化系统抵御环境胁迫,其健康状态良好,故其T-AOC值维持在一个较高水平;而高浓度(≥40 mg·L-1)条件下,细胞抗氧化系统不足以抵御环境胁迫或遭到破坏,细胞健康状态恶化,MWCNTs-COOH浓度越高,C.pyrenoidosa细胞T-AOC值越小,细胞活性降低,出现凋亡现象。机体受到环境胁迫时会通过酶系统与非酶系统产生氧自由基(ROS),后者能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物。丙二醛(MDA)作为脂质过氧化物之一,其含量的高低间接反映了机体受自由基攻击的严重程度[25]。当细胞T-AOC降低,藻细胞的抗氧化系统会发生紊乱,ROS的生产和清除平衡被打破,使得ROS在藻细胞中累积加剧,导致藻细胞受到膜脂过氧化的伤害,MDA含量迅速增加;同时,MDA也会反过来抑制和降低抗氧化酶的活性和含量。
[1] Iijima S. Helical microtubules of graphitic carbon [J]. Nature, 1991, 354(6348): 56-58
[2] 袁刚强, 龚继来, 曾光明. 单壁碳纳米管材料对水稻幼苗的毒性效应[J]. 环境科学学报, 2015, 35(12): 4143-4149
Yuan G Q, Gong J L, Zeng G M. Phytotoxicity of single-walled carbon nanotubes to rice seedling (OryzasativaL) [J]. Acta Scientiae Circumstantiae, 2015, 35(12): 4143-4149 (in Chinese)
[3] 孙晓刚, 曾效舒, 程国安. 碳纳米管的特性及应用[J]. 中国粉体技术, 2001, 12(6): 231-235
Sun X G, Zeng X S, Cheng G A. The properties and applications of carbon nanotubes [J]. China Powder Science and Technology, 2001, 12(6): 231-235 (in Chinese)
[4] Lee J, Mahendra S, Alvarez P. Nanomaterials in the construction industy: A review of their applications and environmental health and safety considerations [J]. ACS Nano, 2010, 4(7): 3580-3590
[5] Lawrence J R, Waiser M J, Swerhone G D W, et al. Effects of fullerene (C60), multi-wall carbon nanotubes (MWCNT), single wall carbon nanotubes (SWCNT) and hydroxyl and carboxyl modified single wall carbon nanotubes on riverine microbial communities [J]. Environmental Science and Pollution Research, 2016, 23: 10090-10102
[6] Herrero-Latorre C,lvarez-Méndez J, Barciela-García J, et al. Characterization of carbon nanotubes and analytical methods for their determination in environmental and biological samples: A review [J]. Analytica Chimica Acta, 2015, 853: 77-94
[7] Liu S S, Long Y, Wang M, et al. Effects of multi-walled carbon nanotubes on ecotoxity of Cd in sediment-zoobenthos system [J]. Journal of Ecology and Rural Environment, 2015, 31(3): 414-419
[8] Monteiro-Rivere N A, Nemanichb R J, Inman A O, et al. Multi-walled carbon nanotubes interactins with human epidermal Keratinocytes [J]. Toxicology Letters, 2005, 155(3): 377-384
[9] 高素莲. 功能化多壁碳纳米管的细胞毒性研究[D]. 济南: 山东大学, 2008: 54-55
Gao S L. Study on cytotoxicity of functionalized multi-walled carbon nanotubes (f-MWCNTs) [D]. Ji'nan: Shangdong University, 2008: 54-55 (in Chinese)
[10] 郄明丽. 羧基化多壁碳纳米管对大鼠睾丸MAPKs通路的影响[D]. 晋中: 山西农业大学, 2015: 28
Qie M L. Effects of MWCNTs-COOH exposure on MAPKs pathway in rat testis [D]. Jinzhong: Shanxi Agricultural University, 2015: 28 (in Chinese)
[11] 刘珍宝, 周波, 王海燕, 等. 功能化多壁碳纳米管对L02细胞的作用[J]. 中国医学科学学报, 2010, 4(32): 449-455
Liu Z B, Zhou B, Wang H Y, et al. Effect of functionalized multi-walled carbon nanotubes onL02 cells [J]. Acta Academiae Medicinae Sinicae, 2010, 4(32): 449-455 (in Chinese)
[12] 谢艳, 李宗芸, 冯琳, 等. 藻类毒物检测方法及其应用研究进展[J]. 环境科学与技术, 2008, 31(5): 77-83
Xie Y, Li Z Y, Feng L, et al. Detection method and its application for toxicant using algae [J]. Environmental Science and Technology, 2008, 31(5): 77-83 (in Chinese)
[13] Anthony G D, David B, Scott F, et al. Safety evaluation of a high-lipid algal biomass fromChorellaprotothecoides[J]. Regulatory Toxicology and Pharmacology, 2009, 55(2): 166-180
[14] Wu Y, Wang Y J, Du J G, et al. Effects of yttrium under lead stress on growth and physiological characteristics ofMicrocystisaeruginosa[J]. Journal of Rare Earths, 2016, 7(3): 747-756
[15] 杜胜蓝, 黄岁梁, 臧常娟, 等. 浮游植物现存量表征指标之间相关性研究Ⅱ:叶绿素a与藻密度[J]. 水资源与水工程学报, 2011, 22(2): 44-49
Du S L, Huang S L, Zang C J, et al. Correlation research between the indicators of phytoplankton standing stockⅡ: Chlorophyll a and algal density [J]. Journal of Water Resources and Water Engineering, 2011, 22(2): 44-49 (in Chinese)
[16] 王振祥, 纪岚. 测定叶绿素a方法探讨[J]. 安徽化工, 2004, 30(5): 48-50
Wang Z X, Ji L. Discussion on the determination of chlorophyll a [J]. Anhui Chemical Industry, 2004, 30(5): 48-50 (in Chinese)
[17] 周永欣, 章宗涉. 水生生物毒性试验方法[M]. 北京: 农业出版社, 1989: 43-45
Zhou Y X, Zhang Z S. Aquatic Toxicity Test Method [M]. Beijing: Agriculture Press, 1989: 43-45 (in Chinese)
[18] Wang Y J, Li J, Lu Y, et al. Effects of cerium on growth and physiological characteristics ofAnabaenaflosaquae[J]. Journal of Rare Earths, 2012, 12(30): 1287-1292
[19] Handy R D, Owen R, Valsami-Jones E. The ecotoxicology of nanoparticles and nanomaterials: Current status, knowledge gaps, challenges and future needs [J]. Ecotoxicology, 2008, 17: 315-325
[20] Petersen E J, Zhang L, Mattison N T, et al. Potential release pathways, environmental fate, and ecological risks of carbon nanotubes [J]. Environmental Science and Technology, 2011, 45: 9837-9856
[21] Deng X Y, Cheng J, Gao K, et al. Effect of 1-octyl-3-methylimidazolium bromide on the growth, photosynthetic activity and antioxidant enzymes ofChlorellapyrenoidosa[J]. International Journal of Ecological Science and Environmental Engineering, 2015, 1(1): 1-10
[22] 龙志峰. 纳米碳管对小球藻的毒性效应与制度机理[D]. 杭州: 浙江大学, 2012: 25-26
Long Z F. Toxicity and its mechanisms of carbon nanotubes toChlorellasp. [D]. Hangzhou: Zhejiang University, 2012: 25-26 (in Chinese)
[23] Liu C G, Sun H W, Sun N. Toxic effects of copper(II) on submerged plantRuppiamaritime[J]. Journal of Environmental Science, 2006, 26(11): 1870-1874
[24] 牟凤伟. 不同类型的碳纳米管对斜生栅藻的毒性效应研究[D]. 长沙: 中南林业科技大学, 2013: 35-36
Mou F W. The toxicity effects of different types of CNTs onScenedesmusobliquus[D]. Changsha: Central South University of Forestry and Technology, 2013: 35-36 (in Chinese)
[25] Deng X Y, Cheng J, Hu X L, et al. Physiological and biochemical responses of a marine diatomPhaeodactylumtricornutumexposed to 1-octyl-3-methylimidazolium bromide [J]. Aquatic Biology, 2015, 24(2): 109-115

