水体和沉积物加标法评估BPAP对摇蚊的毒性
徐静,刘济宁,汪贞,石利利,张圣新,王蕾,*
1. 南京信息工程大学环境科学与工程学院,南京 210044 2. 环境保护部南京环境科学研究所,南京 210042
随着国内外对双酚A(BPA)在婴儿奶瓶以及与食品有关的包装、容器中的禁用,双酚AP([4,4'-(1-phenylethylidene)bisphenol],BPAP)作为塑化剂的替代物被越来越多地使用在食品包装材料、医疗设备等塑料制品中[1-2]。研究证实,环境内分泌干扰物能够干扰生物体内分泌系统,对生物个体及其后代造成危害[3]。作为内分泌干扰物双酚A的类似物BPAP在内分泌干扰性方面的潜在风险却未能受到重视。Coleman等[4]已经利用离体测试技术证明BPAP可以与雌激素受体结合,产生类雌激素效应。然而BPAP对环境生物的内分泌干扰毒性至今仍未得到确认。
摇蚊(Chironomus)属于具有完全变态发育过程的水生昆虫,其生活史以卵、幼虫、蛹和成虫不同形态生活在水-沉积物系统的不同部分[5],由于其易于实验室驯养,生命周期短,对环境因子敏感,使得它们成为生态毒理学研究中进行生物监测和进行风险评估的理想受试生物[6]。摇蚊慢性毒性测试方法是OECD内分泌干扰性测试框架中第五层级的方法之一,可用于内分泌干扰物的危害确认[7]。OECD针对摇蚊这一生物特性分别建立了水体添加和沉积物添加的慢性毒性试验方法[8]。我国目前也将这2种测试方法同化为化学品危害评估方法[9],但并未就2种方法的区别和适用性做深入研究和说明。
由于摇蚊生活史的大部分时间是以幼虫的形态生活在沉积物中[10],这可能导致长时间存留在沉积物中的外源性化学物质更易对摇蚊产生毒性影响。因此水体添加法和沉积物添加法可能引起摇蚊全生命周期繁殖发育毒性测试结果的差异,特别是对于高吸附性和高脂溶性的外源性化学物质。所以有必要针对摇蚊慢性毒性测试的水体添加法和沉积物添加法开展对比研究,探讨不同添加法测试结果在化学品危害评估中的适用性。
本文选择吸附性较强(logKoc=5.93[11])、具有内分泌干扰性潜力的BPAP为研究对象,采用水体加标法和沉积物加标法,分别研究了BPAP对摇蚊羽化率、发育率、繁殖率、雌雄比等内分泌干扰性指标的影响,对比不同添加法对摇蚊毒性效应的差异并分析其原因,为水体加标和沉积物加标的摇蚊慢性毒性测试技术在我国的准确应用提供参考,为BPAP的生态风险评估提供数据支撑。
1 材料与方法(Materials and methods)
1.1 受试生物
伸展摇蚊(Chironomustentans)取自上海化工研究院,经本实验室驯养半年后用于试验。驯养条件:温度(23±1) ℃;昼夜比L:D=16 h : 8 h;光照强度为500~1 000 lux;温和曝气;湿度80%;每日喂食粉碎的鱼食悬液。
1.2 受试品
双酚AP,常用缩写 BPAP,CAS No: 2167-51-3,分析纯,有效成分为BPAP,含量>98.0%,购自梯希爱(上海)化成工业发展有限公司。
1.3 水体加标全生命周期实验
以人工配制的水-沉积物系统为试验介质。根据急性毒性实验结果,水体加标法设置空白对照组和60、120、230、450和900 μg·L-1处理组,曝气Elendt M7培养液稀释贮备液并挥干有机溶剂得到受试溶液。每个浓度4个平行,每个平行中加入20只一龄期幼虫。参考OECD化学品测试导则[12]的要求进行试验,实验条件与饲养条件一致。实验进行两代,每代25 d。每日喂食磨碎的鱼食。10 d后用纱网罩住试验烧杯,每日观察其羽化数,发现有成虫羽化立即将其收集至孵育缸(内含300 mL Elendt M7培养液)内。记录成虫产卵数并将其取出置于六孔板内,待虫卵孵化为子代一龄幼虫后将其放入新的已经平衡的水-沉积物系统,开始子代毒性暴露试验。
1.4 沉积物加标全生命周期试验
沉积物加标法设置空白组、400、800、1 600、3 200和6 400 μg·kg-1处理组。试验参考OECD化学品测试导则[13]进行,取适量贮备液分别与10 g精细石英砂混匀,常温下在通风橱放置30 min,使有机溶剂完全挥发,然后与390 g沉积物混匀,再平均分装于4个500 mL烧杯中,最后轻轻加入350 mL曝气Elendt M7培养液。48 h后加入亲代一龄期幼虫,待幼虫钻入沉积物后,开始曝气。试验过程与水体加标法一致。待子代幼虫孵化,将其加入新的已经平衡的沉积物加标的水-沉积物系统。
从第10天起每天记录水体加标法和沉积物加标法中亲代和子代的羽化数、羽化时间、雌雄性数量,亲代雌性产卵数,计算亲代和子代羽化率、发育率、性别比、亲代繁殖力。
1.5 水-沉积物体系中BPAP浓度分析
在水体加标法和沉积物加标法试验过程中额外各设置3组不加摇蚊幼虫的空白和处理组,分别在亲代摇蚊试验的第0、5、10、15、20、25 天各取水样5.0 mL、沉积物2.0 g分析BPAP的浓度。
水样的前处理方法: 6 000 r·min-1离心10 min,取上清液用甲醇与上清液(V:V=1:1)萃取后过0.45 μm滤膜进样分析。沉积物样的处理方法:常温挥发干水分后称取1.0 g干沉积物加20.0 mL乙酸乙酯并萃取,上清液过滤膜后旋蒸干,用甲醇洗涤、定量后进样分析。液相色谱/串联质谱分析条件:高效液相色谱-串联质谱仪(LC-Agilent Technologies 1290 Infinity, MS-AB SCIEX QTRAP 4500, 美国AB公司);ZORBAX Eclipse Plus C18色谱柱(150 mm×2.1 mm, 3.5 μm);流动相为甲醇:水=55:45(V:V),柱温40 ℃,流速0.5 mL·min-1,进样体积5 μL,保留时间为8.9 min。质谱条件为电喷雾(ESI)离子源、负电离模式、多反应离子监测(MRM)扫描定量分析BPAP。气帘气(CUR)压力30 psi,喷雾气(GS1)压力35 psi,辅助加热气(GS2)压力40 psi,源温度(TEM)400 ℃,离子化电压(IS) 5 500 V,碰撞能量(CE)-32.73 eV,去簇电压(DP)-87.69 V,入口电压(EP)-10 V,出口电压(CXP)-10.92 V,母离子质荷比m/z(Q1)288.7,子离子质荷比m/z(Q3)210.7。
本方法水样检出限为2.4×10-4μg·L-1,沉积物检出限为1.2×10-2μg·kg-1,水样定量限为8×10-5μg·L-1,沉积物定量限为4×10-3μg·kg-1。
1.6 数据分析
水体加标和沉积物加标全生命周期试验中羽化率、发育率、性别比和繁殖力统计方法参考OECD 化学品测试导则No. 233[8]采用Dunnett’s tests(ANOVA,SPSS 19.0)多元对比处理组与空白组的慢性毒性终点,进而确定最低效应浓度(*P<0.05)和无观察效应浓度(NOEC)。鉴于BPAP实测浓度在试验周期内变化较大,水-沉积物系统中BPAP实测浓度以不同时间点实测浓度的加权平均值表示,计算方法参考OECD 化学品测试导则No. 211[14]。
2 结果与分析(Results and analysis)
2.1 羽化率
BPAP在水体加标法试验中对摇蚊亲代、子代羽化率影响见图1。其中,摇蚊对照组(CK)亲代和子代的总羽化率均超过80%,BPAP处理组亲代和子代的羽化率与对照组相比无显著差异(P>0.05)。亲代60~900 μg·L-1处理组的总羽化率达58.8%~81.25%,其中雄性羽化率为32.5%~43.75%,雌性羽化率为26.3%~41.5%;子代60~900 μg·L-1处理组的总羽化率达55.8%~81.25%,其中雄性羽化率为25.0%~43.75%,雌性羽化率为27.5%~40.0%。
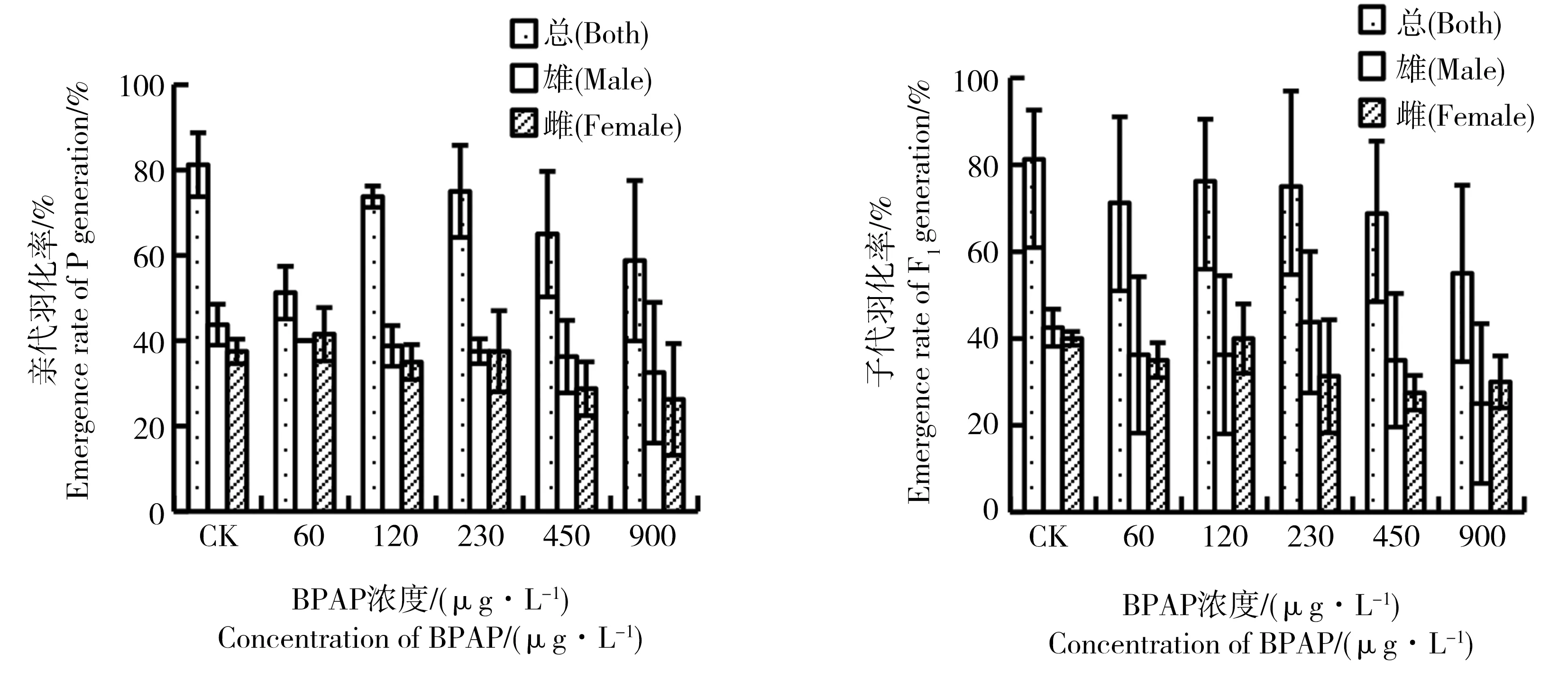
图1 BPAP对摇蚊两代羽化率的影响(水体加标法)注:CK,空白组;平均值±标准差(n=4)。Fig. 1 Emergence ratio of Chironomus tentans after exposure to BPAP over two generations (water-spiked method)Note: P generation, Parent generation; F1 generation, The first filial generation; CK, control group; Mean±standard deviation (n=4).
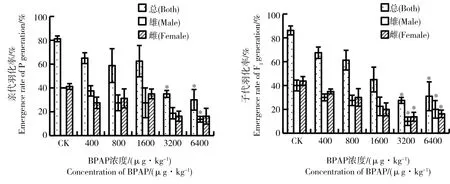
图2 BPAP对摇蚊两代羽化率的影响(沉积物加标法)注:*表示处理组与对照组存在显著差异 P<0.05。Fig. 2 Emergence ratio of Chironomus tentans after exposure to BPAP over two generations (Sediment-spiked method)Note: Significant differences from the corresponding control group, * P<0.05.
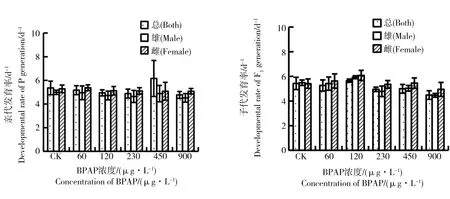
图3 BPAP对摇蚊两代发育速率的影响(水体加标法)Fig. 3 Developmental rate of Chironomus tentans after exposure to BPAP over two generations (Water-spiked method)
沉积物加标法试验中BPAP对摇蚊亲代、子代羽化率的影响见图2。3 200、6 400 μg·kg-1处理组的亲代、子代的总羽化率和雌雄羽化率与空白对照组有显著差异(P<0.05)。亲代摇蚊中,3 200 μg·kg-1及更高浓度处理组总羽化率为30%~35.0%;试验进行到子代时,总羽化率为27.5%~31.0%。由此可见,水体加标法和沉积物加标法中摇蚊子代羽化率对BPAP的敏感程度与亲代相近。
2.2 发育率
发育率(单位为d-1)是发育时间的倒数,表示平均每天的幼虫发育发生率,发育时间是指一龄期幼虫被放入水-沉积物系统之日(实验第0 天)与实验群体羽化之日之间的平均时间跨度[8]。水体加标法和沉积物加标法试验中BPAP对摇蚊亲代、子代发育率的影响见图3和4。水体加标法试验中,亲代和子代处理组发育率与对照组均无显著差异(P>0.05);沉积物加标法试验中,3 200 μg·kg-1及更高浓度处理组子代总发育率和雌性发育率均显著低于对照组。因此,沉积物加标法中摇蚊子代发育率对BPAP的敏感程度高于亲代。
2.3 性别比
水体加标法和沉积物加标法的性别比见图5。2种方法的空白组与处理组两代雌雄比都保持在1左右,水体加标法中亲代60~900 μg·L-1处理组的雌雄比为1.0~1.3,子代为0.8~2.2,子代雌雄比波动相对亲代较大;沉积物加标法中400~6 400 μg·kg-1处理组亲代雌雄比为0.7~1.3,子代为0.9~1.3。但方差分析结果表明,水体加标法和沉积物加标法中亲代、子代雌雄比均与对照组无显著性差异(P>0.05)。
2.4 繁殖力
图6为水体加标法和沉积物加标法试验的亲代产卵率。2种加标法试验中,对照组产卵率均达到80%以上,处理组的亲代产卵率均与对照组无显著差异。因而本试验条件下BPAP处理组对摇蚊繁殖力无显著影响。
2.5 水-沉积物系统中BPAP浓度测定
水体加标法亲代摇蚊毒性试验中,水体浓度和沉积物浓度的变化趋势见图7。试验开展10 d内水体浓度快速降低,沉积物中浓度10 d后显著升高。通过加权平均计算后,60、120、230、450和900 μg·L-1处理组水中BPAP实测浓度为0.26、2.80、5.63、20.59和110.78 μg·L-1。
沉积物加标法亲代摇蚊毒性试验中,水体浓度和沉积物浓度的变化趋势见图8。BPAP加入沉积物后,随时间推移水体浓度逐渐升高,沉积物中浓度逐渐降低。根据加权平均浓度计算结果,400、800、1 600、3 200和6 400 μg·kg-1处理组沉积物中BPAP的实测浓度为11.43、18.61、38.64、69.13和161.28 μg·kg-1。
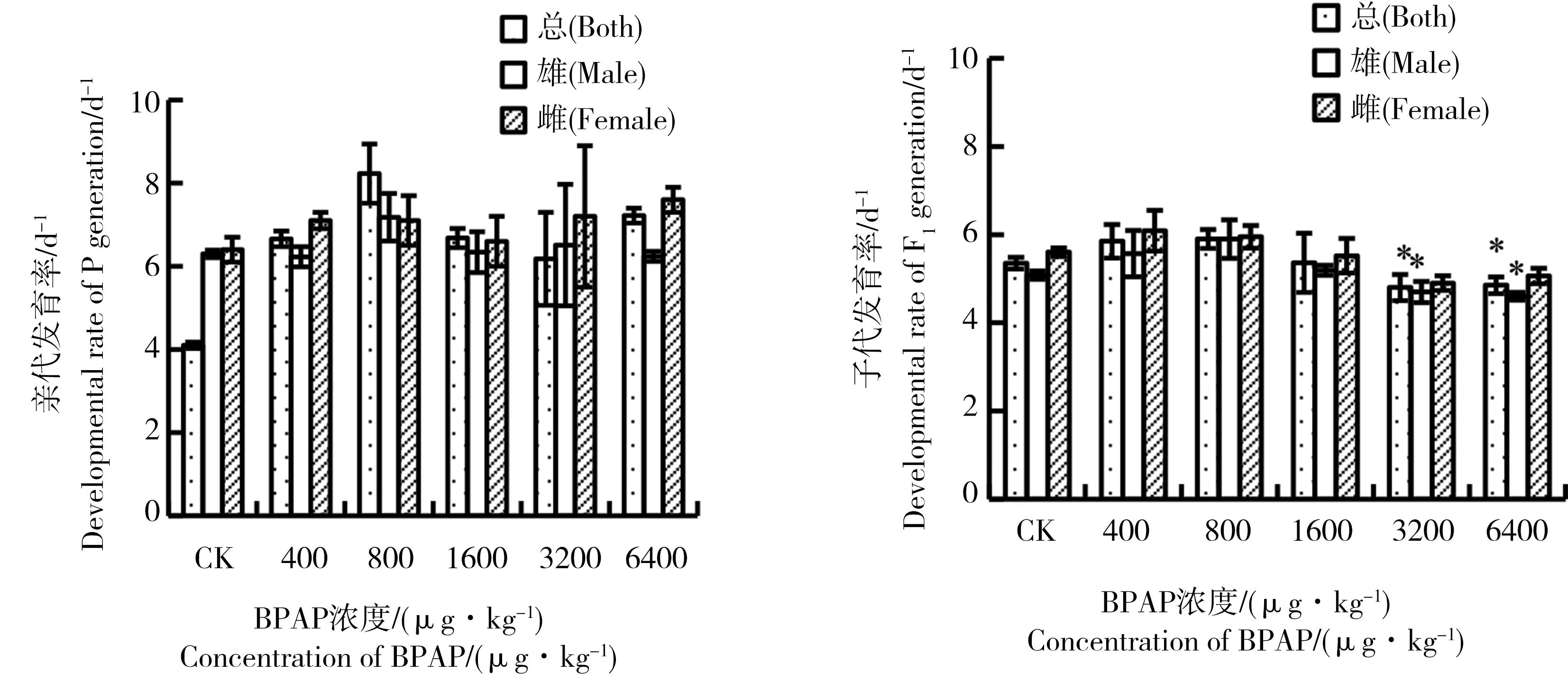
图4 BPAP对摇蚊两代发育速率的影响(沉积物加标法)注:表示处理组与对照组存在显著差异,*P<0.05。Fig. 4 Developmental rate of Chironomus tentans after exposure to BPAP over two generations (Sediment-spiked method)Note: Significant differences from the control group, *P<0.05.
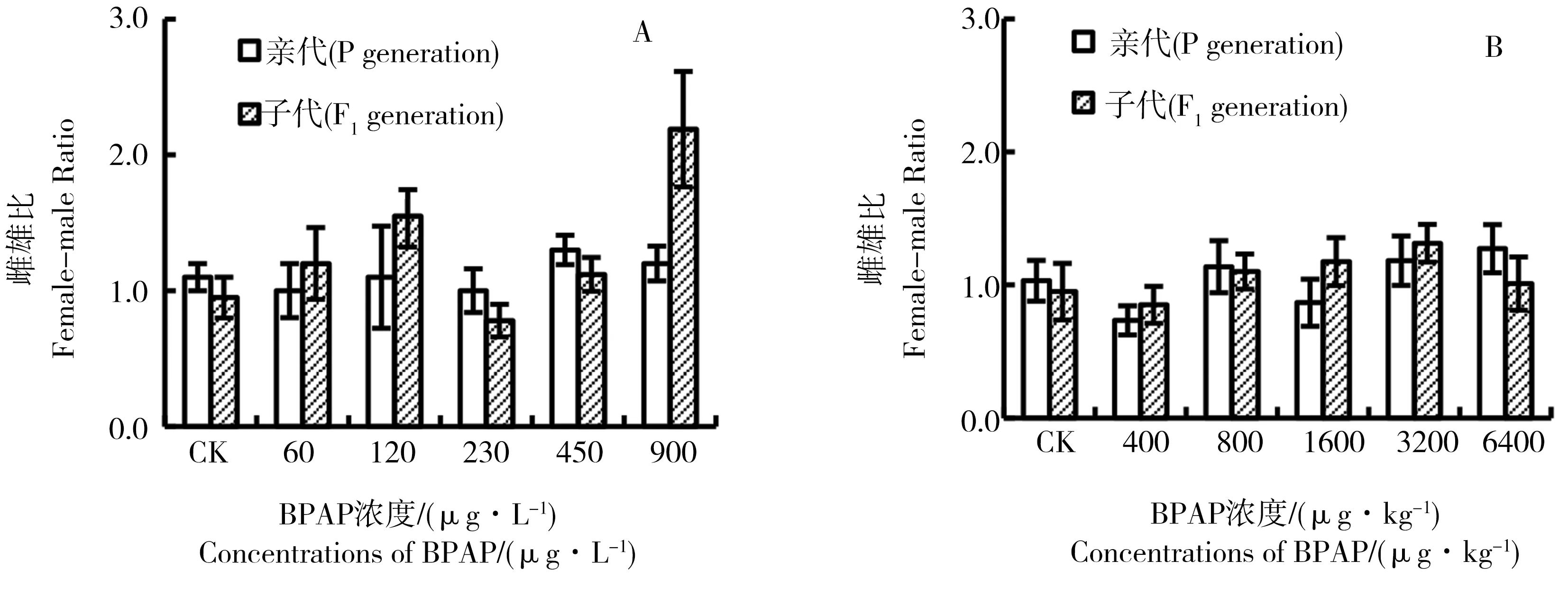
图5 BPAP 对摇蚊两代的性别比的影响注:A,水体加标法;B,沉积物加标法。Fig. 5 Sex ratio of Chironomus tentans after exposure to BPAP over two generationsNote: A, water-spiked method; B, sediment-spiked method.
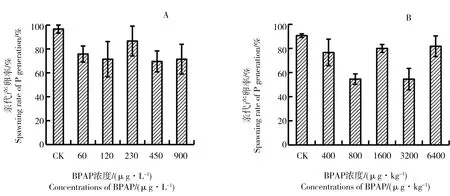
图6 BPAP对摇蚊亲代繁殖力的影响注:A,水体加标法;B,沉积物加标法。Fig. 6 Fecundity of the P generationNote: A, water-spiked method; B, sediment-spiked method.
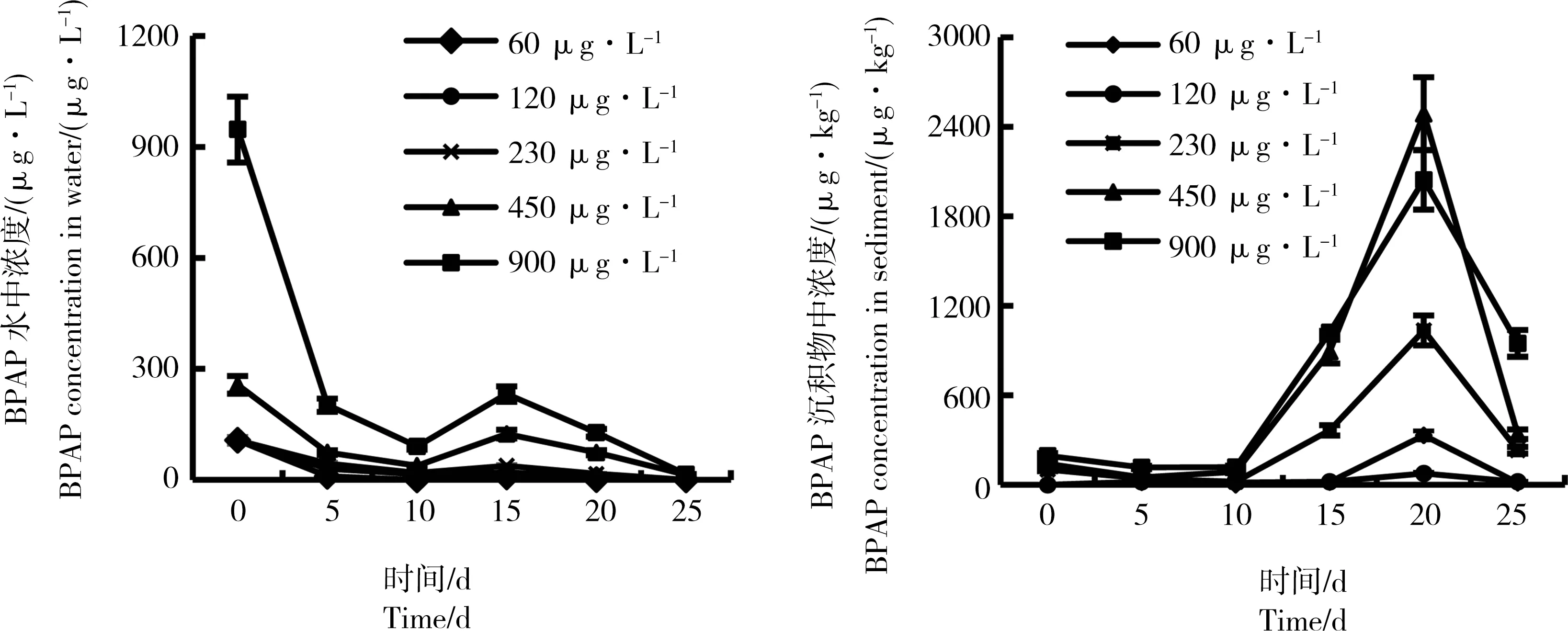
图7 水-沉积物系统中BPAP浓度变化趋势(水体加标法)Fig. 7 The measured concentrations of BPAP in water-sediment system (water-spiked method)
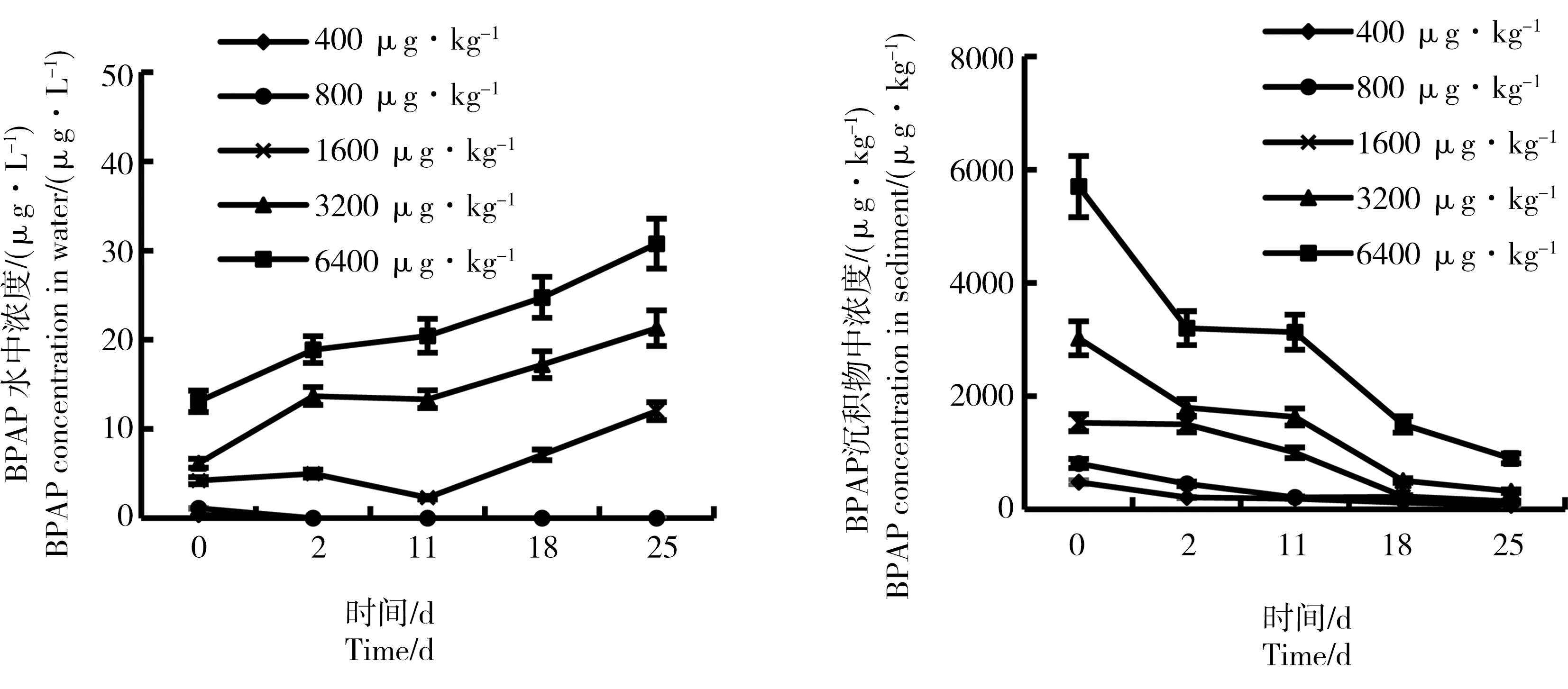
图8 水-沉积物系统中BPAP浓度变化趋势(沉积物加标法)Fig. 8 The measured concentration of BPAP in water-sediment system (sediment-spiked method)
对比不同添加方法得到的沉积物中BPAP实测浓度可知,沉积物添加法中BPAP加入系统后的11 d内在沉积物中的浓度仍维持初始浓度的50%以上,而水体添加法中BPAP的沉积物浓度在10 d内维持较低水平,之后才有所增加。以水体添加法的450 μg·L-1处理组和沉积物添加法的1 600 μg·kg-1处理组的测试结果为例,试验0~11 d沉积物中BPAP实测浓度差距较大,分别为98.4~280 μg·kg-1和1 000~1 530 μg·kg-1;而这2个处理组中BPAP的初始添加量非常接近,为157.5 μg 和160 μg。因此,沉积物添加法试验前半期,BPAP均主要存在于沉积物当中;而水体添加法试验前半期,沉积物中BPAP含量很低。推测这一方面是由于有机化合物从沉积物相到水相的分配再平衡需要一定时间,另一方面是由于BPAP本身logKoc较高,吸附性较强,较难从沉积物相进入水相。
3 讨论(Discussion)
在水体添加法摇蚊全生命周期毒性试验中,60~900 μg·L-1BPAP处理组对两代摇蚊的羽化率、发育率、性别比和繁殖力均无显著影响;而在沉积物添加法摇蚊全生命周期毒性试验中,3 200 μg·kg-1及更高浓度处理组显著降低亲代羽化率和子代羽化率、发育率。综合各项慢性毒性指标,水体和沉积物添加试验得到的BPAP对摇蚊两代发育、繁殖均无显著影响的NOEC值分别为≥900 μg·L-1和1 600 μg·kg-1。若以BPAP的初始添加质量在水-沉积物整体质量的占比计,则水体和沉积物添加法得到的无显著效应浓度分别为≥0.00070‰和0.00035‰。由此可见,沉积物添加法对摇蚊的毒性效应高于水体添加法。与此同时,本研究对水-沉积物体系中BPAP的浓度分析结果也印证了BPAP从沉积物中加入系统后的试验前半期主要存在于沉积物当中。因此,本结果验证了本研究的最初假设,即沉积物添加法易使强吸附性的外源性化学物质较长时间存留在沉积物中,而这段时间摇蚊恰好以敏感的幼虫形态存在于沉积物当中,因此沉积物添加法摇蚊全生命周期试验易得到比水体添加法更高的毒性。由此证实了实际环境中的BPAP水体直接暴露和沉积物直接暴露对摇蚊的危害性不尽相等,其风险评估应采用相应的水体或沉积物添加法得到的摇蚊毒性数据。在危害评估中,对于类似BPAP具有高吸附性或高脂溶性的化学品而言,摇蚊慢性毒性的水体添加法和沉积物添加法试验结果不能做简单的数据单位转换就相互混用。
此外,本研究得到的BPAP影响摇蚊亲代发育的无显著效应浓度(NOEC≥900 μg·L-1)远高于BPA对摇蚊的繁殖发育无显著效应浓度NOEC=100 μg·L-1[15],因此BPAP对底栖生物摇蚊的慢性毒性低于BPA,但其对水生态系统的危害性须综合其他水生生物的慢性毒性数据进行评估。
综上所述:
1)水体和沉积物添加试验得到BPAP对摇蚊两代发育、繁殖无显著影响浓度(NOEC)分别为≥900 μg·L-1和1 600 μg·kg-1。这一结果可以为BPAP的生态风险评估提供数据支持。
2)BPAP沉积物添加法对摇蚊的繁殖发育毒性效应大于水体添加法。在化学品危害评估中,摇蚊慢性毒性测试方法或数据的选择应考虑实际环境中该化学品进入水-沉积物系统的方式。
3)BPAP对底栖生物摇蚊的繁殖发育毒性低于BPA,其对水生态系统的危害性须综合其他水生生物的慢性毒性数据进一步评估。
[1] Vandenberg L N, Colborn T, Hayes T B, et al. Hormones and endocrine-disrupting chemicals: Low-dose effects and nonmonotonic dose responses [J]. Endocrine Reviews, 2012, 33(3): 378-455
[2] Schmidt J, Kotnik P, Trontelj J, et al. Bioactivation of bisphenol A and its analogs (BPF, BPAF, BPZ and DMBPA) in human liver microsomes [J]. Toxicology in Vitro, 2013, 27(4): 1267-1276
[3] 韩绍伦, 李剑, 王子健, 等. 环境内分泌干扰化合物干扰胰岛素分泌潜在作用机理[J]. 生态毒理学报, 2014, 9(2): 181-189
Han S L, Li J, Wang Z J, et al. Potential mechanisms of effects of environmental endocrine disrupting chemicals on disrupting insulin secretion [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 181-189 (in Chinese)
[4] Coleman K P, Toscano A, Wiese T E. QSAR Models of theinvitroestrogen activity of bisphenol A analogs [J]. QSAR & Combinatorial Science, 2003, 22(1): 78-88
[5] 邓鑫, 刘志红, 李晓军, 等. 沉积物中多杀霉素对摇蚊幼虫的慢性毒性效应[J]. 生态与农村环境学报, 2015(5): 784-788
Deng X, Liu Z H, Li X J, et al. Chronic toxic effects of spinosad in sediments toChironomustepperilarvae [J]. Journal of Ecology and Rural Environment, 2015(5): 784-788 (in Chinese)
[6] 杨丽伟, 张菊, 邓焕广, 等. 东平湖底泥重金属污染及其对摇蚊分布的影响[J]. 应用与环境生物学报, 2016(4): 680-688
Yang L W, Zhang J, Deng H G, et al. Heavy metal pollution and its influence on the distribution ofChironomidsin the sediments of Lake Dongping, Shandong, China [J]. Chinese Journal of Applied and Environmental Biology, 2016(4): 680-688 (in Chinese)
[7] Organisation for Economic Co-operation and Development. Guidance document on standardised test guidelines for evaluating chemicals for endocrine disruption. Technical Report for OECD Environment, Health and Safety Publications Series on Testing and Assessment No. 150 [R]. Paris: OECD, 2012
[8] OECD. OECD Guidelines for Testing of Chemicals, 233 Sediment-WaterChironomidLife-Cycle Toxicity Test Using Spiked Water or Spiked Sediment [R]. Paris: OECD, 2010
[9] 环境保护部化学品登记中心, 环境保护部, 化学品测试方法编委会. 化学品测试方法: 生物系统效应卷[M]. 北京:中国环境出版社, 2013
Ministry of Environmental Protection Chemical Registration Center, Ministry of Environmental Protection, Chemical Testing Methodology Editorial Board. The Guidelines for the Testing of Chemicals: Effects on Biotic Systems [M]. Beijing: China Environmental Press Official, 2013 (in Chinese)
[10] 刘丽, 钟文珏, 祝凌燕, 等. 沉积物中六氯苯对摇蚊幼虫的慢性毒性效应[J]. 生态毒理学报, 2014, 9(2) : 261-267
Liu L, Zhong W Y, Zhu L Y, et al. Chronic effects of hexachlorobenzen (HCB) in sediments toChironomuskiiensislarvae [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 261-267 (in Chinese)
[11] Emerson J, Levy M. Environmental Performance Index [M]// Encyclopedia of Quantitative Risk Analysis and Assessment. 2008: 1006
[12] OECD. OECD Guideline for Testing of Chemicals, 219 Sediment-WaterChironomidToxicity Test Using Spiked Water [R]. Paris: OECD, 2004
[13] OECD. OECD Guideline for Testing of Chemicals, 218 Sediment WaterChironomidToxicity Test Using Spiked Sediment [R]. Paris: OECD, 2004
[14] OECD. OECD Guidelines for Testing of Chemicals, 211DaphniamagnaReproduction Test [R]. Paris: OECD, 2012
[15] US EPA. Estimation Programs Interface SuiteTMfor Microsoft®Windows, v 4.11 or insert version used. Washington, DC: United States Environmental Protection Agency, 2012

