模拟氮沉降增加对长白山红松和水曲柳菌根真菌群落结构及多样性的影响
郭伟,耿珍珍,陈朝,李晴,杨颜熙,申思,金大明,王存国
沈阳农业大学农学院,辽宁 沈阳 110161
在全球范围内,菌根真菌与90%以上的植物根系形成互惠共生体(Bonfante et al.,2010),以促进植物对水分以及氮(N)和磷(P)等养分的吸收(Lehto et al.,2011)。在森林生态系统中,庞大的菌丝网络将树木联系起来,进行物质交换、能量流动和信息传递(Wagg et al.,2011)。因此,菌根真菌对维持森林生物多样性和调节森林生态系统对环境变化的响应等方面具有重要的意义(刘润进等,2007)。根据菌根真菌的菌丝是否侵入植物根系皮层细胞内(细胞壁与细胞膜之间),将菌根分为外生菌根和内生菌根。长期以来有关菌根真菌的鉴定及多样性分析受到学者的广泛关注(唐明等,2007;施晓峰等,2017;Yu et al.,2017)。近年来,分子生物学技术的快速发展极大地促进了菌根真菌群落结构研究的发展(Liang et al.,2008)。例如,Opik et al.(2006)对全球不同生态系统中植物根内生真菌群落组成的研究表明,在 52种植物根内共存在95种内生菌根真菌。2015年2月国际知名期刊《New Phytologist》专辑“Ecology and evolution of mycorhizas”中多篇文章探讨了森林土壤碳循环与外生菌根真菌功能性状及群落结构之间的关系(Clemmensen et al.,2015),这将有利于通过研究植物菌根真菌群落结构的变化探讨森林生态系统功能对全球变化的响应特征(Lilleskov et al.,2002)。
目前,全球大气氮沉降的急剧上升(增速为 5 kg∙hm-2∙a-1)导致陆地生态系统酸化和富营养化,进真菌结构改变对森林生态系统功能的影响(李晓亮,2015;Vasutovaet al.,2017)。本研究依托长白山野外大型氮添加平台,选取阔叶红松林中两种代表树种水曲柳(Fraxinus mandshurica)和红松(Pinus koraiensis)作为研究对象,分别属于内生菌根树种(Guo et al.,2008;孙玥等,2010)和外生菌根树种。运用高通量测序技术,研究经过6年模拟氮沉降增加后,两树种不同土壤层次菌根真菌群落结构的差异及其对氮沉降增加的响应特征,探讨菌根真菌在不同菌根类型树种响应大气氮沉降增加中的重要作用,以期为菌根真菌群落结构与森林生态系统功能关联研究提供科学依据。而驱动生物多样性和群落结构发生变化。中国是仅次于欧洲和美国的全球第三大氮沉降区,总氮沉降量已超过 15 Tg∙a-1(Liu et al.,2011),过量的 N沉降会对森林生态系统的健康和功能产生不利影响。东北森林生态系统是中国重要的碳汇,在吸收CO2和减缓气候变暖方面具有重要作用(Fang et al.,2001)。长白山原始阔叶红松林生物种类繁多,是中国东北典型森林类型之一,也是全球变化的敏感区域之一。2007年长白山地区的干湿氮沉降量为23 kg∙hm-2∙a-1,预计2020年将达到54 kg∙hm-2∙a-1(Lü et al.,2007)。因此,在当前全球大气氮沉降加剧的背景下,学者对森林生态系统地上部分的响应特征进行了深入研究,而对地下部分菌根的研究主要集中在细根的侵染状况及菌根真菌群落多样性等方面(Van Diepen et al.,2010)。许多生态系统的菌根真菌对氮沉降增加的响应十分敏感(Talbot et al.,2008)。研究表明,氮沉降增加降低了外生真菌的丰度,改变了其群落结构组成(Kjller et al.,2012)。然而,氮沉降增加对内生真菌的影响存在较大的不确定性(Van Diepen et al.,2013)。
高通量测序具有速度快、准确度高和深度测序等优点,已被广泛应用于菌根真菌群落结构与生态功能变化规律的研究上,从而更加深入地探讨菌根
1 研究地区概况和研究方法
1.1 研究区概况
研究样地位于长白山原始阔叶红松林内定位站1号标准地附近(42°01'N,128°06'E,海拔768 m)。在长白山地区,阔叶红松林分布于海拔500~1100 m的玄武岩台地上,坡度平缓、排水良好。该地区属于典型的大陆性季风气候,冬季寒冷漫长、春秋较短、夏季气温较高。该地区年均温为 3.5 ℃,最高月均温为20.5 ℃(8月),最低月均温为-16.5 ℃(1月);年均降雨量为700 mm,70%~80%降雨发生在生长季(5—10月)。土壤类型为在火山灰母质上发育的暗棕壤,由于冬季寒冷,土壤季节性冻层分布很广,且持续时间较长,融冻形成土壤上层滞水,导致土壤发生潜育化和白浆化。夏季高温多雨,植物生长繁茂,有机质大量积累,故土壤表层覆盖较厚的有机物。表层土壤(0~10 cm)容重为 0.35 g∙cm-3,亚表层土壤(10~20 cm)容重为0. 68 g∙cm-3(Yu et al.,2014)。研究区的主要乔木为红松(P. koraiensis)、水曲柳(F. mandshurica)、紫椴(Tilia amurensis)、色木槭(Acer mono)和糠椴(Tilia mandshurica)等;主要灌木为毛榛子(Corylus mandshurica)、卫矛(Euonymus alatus)、忍冬(Lonicera japonica)、东北山梅花(Philadelphus schrenkii)等;主要草本植物有银莲花(Anemone raddeana)、莎草(Cyperus microiria)、延胡索(Funaria officinalis)、山茄子(Brachybotrys paridiformis)等。
1.2 试验设置
2009年8月,在阔叶红松林地内选择地势平坦(坡度1°~5°)的6个50 m×50 m样方(3个施N处理,3个作为对照),任意2个样方之间设置有不低于 20 m宽的缓冲区。本试验施 N水平为 50 kg∙hm-2∙a-1,在每年生长季的 5—10月 17日前后选择无降水的天气喷施,每次喷施全年施N量的1/6。将用于喷施的NH4NO3溶解在40 L水中后,利用肩背式喷雾器在样地内来回均匀喷洒,对照样地则喷施等量的水。
1.3 细根采集和菌根真菌群落组成分析
取样前,在样地外分别挖取红松和水曲柳的根系,从与主根相连的侧根上判断取样树种的根系特征,对其细根的形状、颜色和气味等基本特征进行识别,并保留相应的样品。2015年8月,在6个样地内,各随机选取5个点,去除地表枯落物,用内径为5 cm的土钻钻取土芯,深度为20 cm,分成0~10 cm和10~20 cm两层。将取出的5个土样混合后轻轻装入已编号的自封袋中,要特别注意保持根段的完整性,再装入带有冰块的冷藏箱内运回实验室。在实验室内,洗去根段上的土壤,依据目标树种的细根形态特征,分别挑选出红松和水曲柳的细根。用低温(1~2 ℃)去离子水仔细清洗根系样品,然后放入直径为15 cm的装有1 ℃去离子水的培养皿中。按照Pregitzer et al.(2002)分级方法,将最末端的根定义为1级根,着生于1级根上的根定义为2级根,依次类推,着生于2级根上的根为3级根。用镊子挑选 2 g左右的 1~3级新鲜活根存于-80 ℃冰箱,用于 DNA提取。菌根真菌测序由深圳恒创基因科技有限公司于 Illumina MiSeq/Hiseq测序平台上完成。PCR扩增选取的是ITS的通用引物ITS1和ITS2(White et al.,1990)。
1.4 数据处理
不同树种间菌根真菌群落结构的差异运用R软件进行主坐标分析(PCoA);QIIME软件包进行4种多样性指数(Observed-species、Chao、Shannon、PD-whole-tree)的计算;选取KRONA软件关注属的 OTU进行样本内和样本间的系统进化及相对丰度比较分析;采用t检验比较不同处理、土壤层次菌根真菌多样性指数的差异(P<0.05)。
2 结果与分析
2.1 菌根真菌测序鉴定结果及分析
在门水平上,担子菌门(Basidiomycota)相对丰度高达68.95%;子囊菌门(Ascomycota)相对丰度为31.05%,其他还包括壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、接合菌门(Zygomycota)和Rozellomycota(图1、图2)。
在属的水平上,粒毛盘菌属(Lachnum)相对丰度最高,为 25.25%,其次是红菇属(Russula),为21.10%,乳牛肝菌属(Suillus)相对丰度为13.20%,Scopuloides和棉革菌属(Tomentella)相对丰度相似分别为8.41%和8.30%,微皮伞属(Marasmiellus)、丝盖伞属(Inocybe)和蜡壳菌属(Sebacina)相对丰度分别为5.53%、4.92%和4.24%(图1)。
2.2 不同树种菌根真菌群落结构的差异
红松(PK)和水曲柳(FM)菌根真菌群落结构存在显著差异(图 2)。主坐标分析结果表明,第1和2主成分分别占总变异的16.79%和13.83%,累计贡献率为30.62%。水曲柳位于第3象限,施N后与第1主成分呈负相关关系。红松位于第1和4象限,施N后分别与第1和2主成分呈正相关关系。说明两树种菌根真菌群落结构相似性较低,且红松菌根真菌群落内部变异较大。施N增加了水曲柳和红松之间菌根群落结构的差异(图2)。

图2 水曲柳和红松菌根真菌群落结构的主坐标分析Fig. 2 Principal co-ordinates analysis (PCoA) of mycorrhizal fungi community structure of F. mandshurica and P. koraiensis

图1 红松和水曲柳菌根真菌群落组成Fig. 1 Mycorrhizal fungi community composition of P. koaiensis and F. mandshurica
2.3 施N对红松菌根真菌群落结构的影响
施 N显著影响不同土壤层红松菌根真菌群落的物种组成和丰度(图 3、图 4)。与对照相比,施 N 降低了 0~10 cm 土壤层担子菌门(Basidiomycota)和接合菌门(Zygomycota)的丰度,提高了子囊菌门(Ascomycota)的丰度(图3),并且降低了红松菌根真菌属的数量(施氮前后分别为121、96)。对照样地0~10 cm土壤层红松菌根真菌丰度较高的属分别是粒毛盘菌属(Lachnum)、棉革菌属(Tomentella)和丝盖伞属(Inocybe)等,而施N提高了红菇属(Russula)的丰度,降低了粒毛盘菌属(Lachnum)的丰度(图3)。
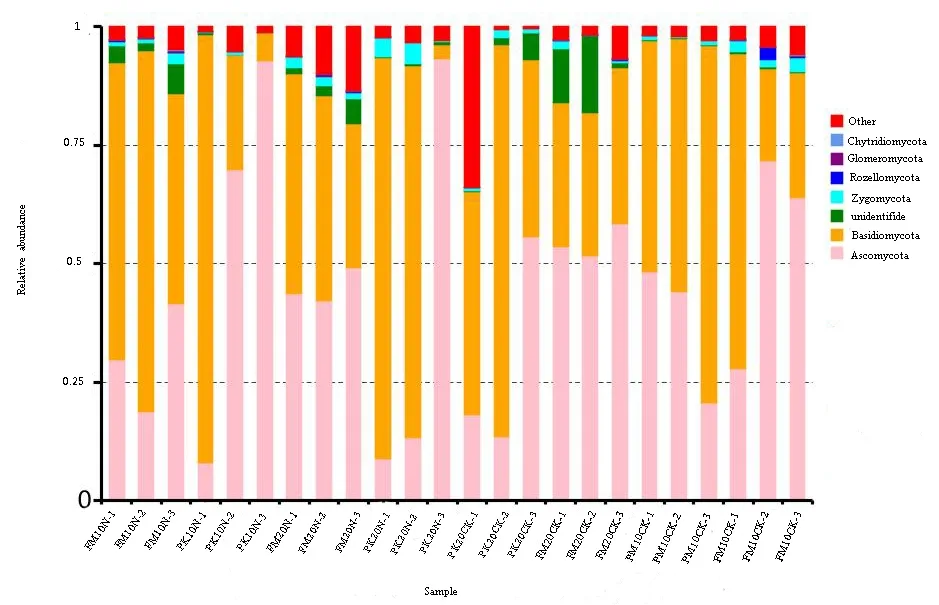
图3 施N对水曲柳和红松菌根真菌门水平上丰度的影响Fig. 3 Effects of nitrogen addition on mycorrhizal fungi relative abundance of F.mandshurica and P.koraiensis at phylum level n=3,下同 n=3, the same below
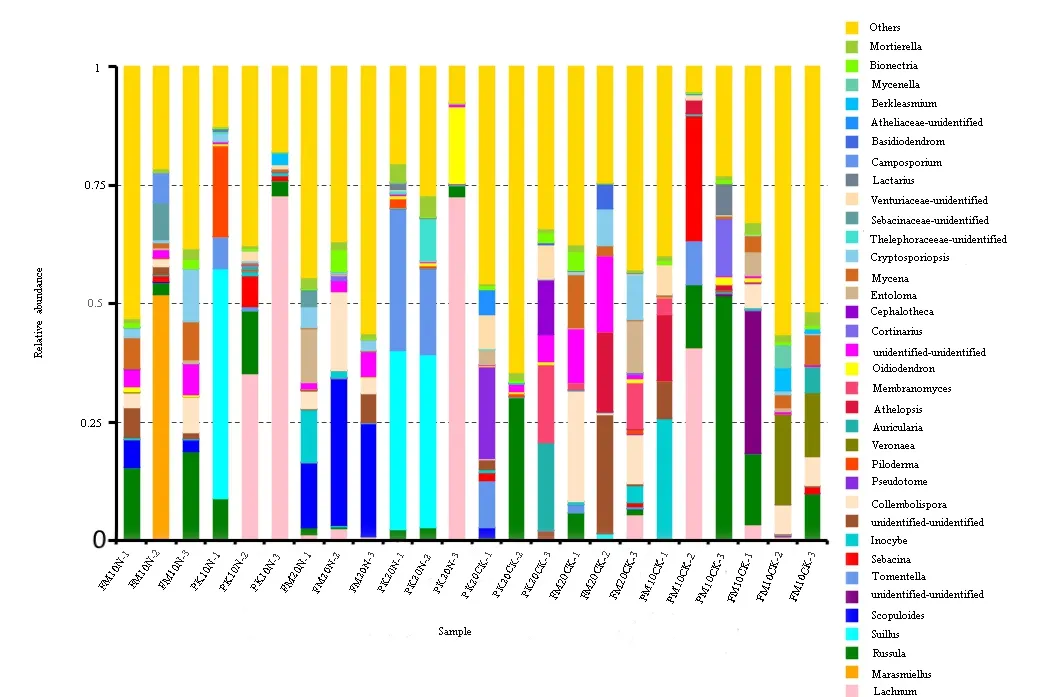
图4 施N对水曲柳和红松菌根真菌属水平上丰度的影响Fig. 4 Effects of nitrogen addition on mycorrhizal fungi relative abundance of F. mandshurica and P. koraiensis at genus level
对于10~20 cm土壤层,施N提高了子囊菌门(Ascomycota)和接合菌门(Zygomycota)的丰度,降低了Rozellomycota和球囊菌门(Glomeromycota)的丰度(图3)。与对照相比,施N对红松菌根真菌属的数量影响较小(施氮前后分别为140、138)。对照样地丰度较高的属分别是革菌属(Tomentella)、红菇属(Russula)和粒毛盘菌属(Lachnum)等,施 N提高了革菌属(Tomentella)、粒毛盘菌属(Lachnum)和乳牛肝菌属(Suillus)等属的丰度,降低了红菇属(Russula)的丰度(图4)。
施 N对不同土壤层红松菌根真菌多样性的影响不同(图5)。对照和施N样地0~10 cm土壤层红松菌根真菌多样性和均匀度无显著差别,其Shannon指数的变化范围分别为2.5~4.2和3.2~5.0;Observed-species指数分别为 150~250和 170~280;PD-whole-tree指数分别为 45~85和 68~100;Chao1指数分别为160~250和165~300。但是施N显著增加了 10~20 cm 土壤层红松菌根真菌的多样性,Shannon、Observed-species和PD-whole-tree指数平均值分别提高了1.5、1.4和1.4倍(图5)。
2.4 施N对水曲柳菌根真菌群落结构的影响
施N显著影响了不同土壤层水曲柳菌根真菌群落组成和丰度(图3、图4)。与对照相比,施N降低了0~10 cm土壤层子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)和 Rozellomycota等的丰度,提高了担子菌门(Basidiomycota)和球囊菌门(Glomeromycota)的丰度(图3)。施N降低了水曲柳菌根真菌属的数量(施氮前后分别为190、130)。对照样地0~10 cm土壤层水曲柳菌根真菌丰度较高的属分别是粒毛盘菌属(Lachnum)、红菇属(Russula)和蜡壳菌属(Sebacina)等,而施N提高了微皮伞属(Marasmiellus)、红菇属(Russula)和 Scopuloides等属的丰度,降低了粒毛盘菌属(Lachnum)、棉革菌属(Tomentella)和Veronaea等属的丰度(图4)。
对于10~20 cm土壤层,施N提高了水曲柳菌根真菌担子菌门(Basidiomycota)、接合菌门(Zygomycota)和球囊菌门(Glomeromycota)的丰度,降低了子囊菌门(Ascomycota)和Rozellomycota的丰度(图3)。与对照相比,施N对水曲柳菌根真菌属的数量影响较小(施氮前后分别为157、160)。对照样地丰度较高的属分别是粒毛盘菌属(Lachnum)、红菇属(Russula)和丝盖伞属(Inocybe)等,而施 N提高了微皮伞属(Marasmiellus)和Scopuloides等属的丰度,降低了红菇属(Russula)、棉革菌属(Tomentella)和丝盖伞属(Inocybe)等属的丰度(图4)。
本研究结果表明,施N使0~10 cm和10~20 cm土壤层水曲柳菌根真菌多样性显著增加(图 5)。在0~10 cm土壤层,Shannon、Observed-species和PD-whole-tree指数平均值分别提高了1.4、1.6和2.5倍;在10~20 cm土壤层,各指数平均值分别提高了1.6、1.4和1.7倍。
3 讨论
3.1 红松和水曲柳菌根真菌群落物种组成对施 N的响应
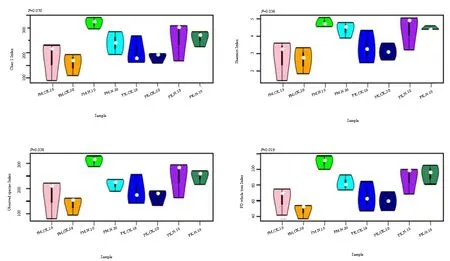
图5 施N对水曲柳和红松菌根真菌多样性的影响Fig. 5 Effects of nitrogen addition on mycorrhizal fungi diversity of F. mandshurica and P. koraiensis
本研究发现红松和水曲柳菌根真菌主要由外生菌根真菌的担子菌门(Basidiomycota)和子囊菌门(Ascomycota)组成,而内生菌根真菌的球囊菌门(Glomeromycota)较少(图 1、3)。图力古尔等(2010)对长白山阔叶红松林大型真菌多样性的研究也表明,外生菌根真菌占据较高比例。两树种菌根真菌群落中的常见属主要有微皮伞属(Marasmiellus)、红菇属(Russula)、Scopuloides、丝盖伞属(Inocybe)、蜡壳菌属(Sebacina)、小菇属(Mycena)和乳菇属(Lactarius)等;优势属包括粒毛盘菌属(Lachnum)、红菇属(Russula)和乳牛肝菌属(Suillus)。粒毛盘菌属(Lachnum)是本研究丰度最高的属,在菌根真菌群落中占主导地位(He et al.,2016),其物种分布广泛,具有较高的经济价值(徐灿,2017)。王薇等(2015)研究长白山阔叶林、针阔混交林、针叶林、亚高山岳桦林和高山苔原5种主要植被类型中阔叶红松林的大型真菌优势属,发现乳菇属(Lactarius)是5个主要植被区均存在的优势属。本研究在红松和水曲柳细根中均发现了粒毛盘菌属(Lachnum)、红菇属(Russula)和丝盖伞属(Inocybe)等属,表明这些属的菌根真菌可能与不同树种形成共生关系,从而在不同树种之间形成菌丝网络。红菇属(Russula)不仅与不同树种的根系共生形成菌根(周玮等,2014),而且具有较高经济价值,姜清彬等(2016)发现红菇属(Russula)7个菌株可以促进马尾松(Pinus massoniana)苗木生长。另外,本研究发现乳菇属(Lactarius)只存在红松细根中,蜡壳菌属(Sebacina)、小菇属(Mycena)只存在水曲柳细根中,这表明不同树种菌根真菌群落都有各自的特有组分,菌根真菌与宿主植物之间存在专一性,其分布受不同树种的生物学特性的影响(Bullock,2006)。
本研究结果表明,红松和水曲柳菌根真菌群落中不同属及同一属的菌根真菌对施 N的响应不同(图3)。6年施N后,无机N利用率较高的红松和水曲柳菌根真菌,如 Piloderma、乳牛肝菌属(Suillus)丰度增加,而 Auricularia、Athelopsis、Membranomyces等丰度急剧下降,这表明土壤N有效性可能对不同属的菌根真菌产生明显的选择性影响(Egerton-Warburton et al.,2000)。施N后蜡壳菌属(Sebacina)出现在水曲柳菌根真菌群落中,Cephalotheca在红松菌根真菌群落中消失。另外,在红松菌根真菌群落中,施N使“厌氮”菌根真菌,如丝膜菌属(Cortinarius)、红菇属(Russula)、乳菇属(Lactarius)等属的丰度下降(图 3)。但Cox et al.(2010)在成熟欧洲赤松(Pinus sylvestris)林中未发现丝膜菌属(Cortinarius)与土壤N有效性之间的显著关系。6年施N后,红菇属(Russula)和 Scopuloides在水曲柳菌根真菌群落中的丰度上升,在红松菌根真菌群落中的丰度降低;而乳牛肝菌属(Suillus)、粒毛盘菌属(Lachnum)、小菇属(Mycena)和被孢霉属(Mortierella)则相反。Lilleskov et al.(2001)发现N沉降使白云杉(Picea glauca)EM菌根真菌群落中乳菇属(Lactarius)、蜡蘑(Laccaria)和桩菇菌属(Paxillus)等属的丰度增加;丝膜菌属(Cortinarius)、乳牛肝菌属(Suillus)和口蘑属(Tricholoma)等属的丰度下降。树木与真菌之间的共生关系存在一定的相互选择性,不同树木根系形态及其生理代谢等方面的差异,影响着真菌的生长与发育、繁殖、定殖与扩展(Hijri et al.,2006)。树木可能分配给对其有益的菌根真菌(如红菇属Russula)较多的有机物,以促进其对N的吸收(Grman,2012)。因此,对N的吸收能力和同化途径上的较大差异导致不同菌根真菌对N添加产生不同响应。
本研究结果表明,不同土壤层红松和水曲柳菌根真菌对施N的响应存在差异(图3)。6年施N使水曲柳0~10 cm土壤层红菇属(Russula)、Inocybe和小菇属(Mycena)等菌根真菌的丰度升高,10~20 cm土壤层的丰度降低;6年施N使红松0~10 cm土壤层乳牛肝菌属(Suillus)、蜡壳菌属(Sebacina)、小菇属(Mycena)、乳菇属(Lactarius)等菌根真菌的丰度降低,10~20 cm土壤层的丰度升高(图3)。菌根真菌的生长受到土壤环境因子的影响(张旭红,2013),如土壤含水量、土壤pH、土壤盐碱含量等,这些因子随土壤深度的变化可能导致不同土壤层红松和水曲柳菌根真菌对土壤N素的利用能力和耐受范围产生差异性(Jumpponen et al.,2010)。
3.2 红松和水曲柳菌根真菌群落多样性对施 N的响应
本研究结果表明,经过6年施N后,红松和水曲柳菌根真菌群落多样性发生明显改变(图 4)。施 N显著增加了两个土壤层次水曲柳菌根真菌群落以及 0~10 cm 土壤层红松菌根真菌群落的多样性。此结果在对西南亚高山针叶林建群种粗枝云杉(Picea asperata)EM菌根真菌多样性的研究中被证实(李月蛟等,2015)。然而与本研究不同的是,施N使瑞典云杉森林挪威云杉(Picea abies)和红松(P. koraiensis)EM真菌的多样性降低(Jonsson et al.,2000;Frey et al.,2004)。另外,Wright et al.(2009)并未发现施 N对异叶铁杉(Tsuga heterophylla)外生菌根真菌的多样性有影响。菌根真菌群落多样性对施 N的不同响应可能与研究样地的土壤养分等因子有关(Treseder et al.,2002)。在温带森林,例如长白山阔叶红松林,植物的生长通常受N限制(杨丽韫等,2005)。因此,植物与菌根真菌形成共生关系,以促进自身对养分的吸收,而施N在一定程度上缓解了土壤养分的限制,有利于菌根真菌多样性的增加。
菌根真菌群落多样性对施N的不同响应也可能与植物根系的C分配密切相关。施N能够促进植物地上部分的生长,提高植物的生产力,增加植物对地下部分的相对 C分配(薛璟花等,2005)。植物根系 C分配的增加缓解了菌根真菌之间的竞争,使菌根真菌中的特异类群(unique species group)减少,共有类群(common species group)增加(Dahlberg,2001)。施 N也可能增加了菌根真菌群落中的“欺骗者”真菌,即从树木中获取C,但并不为树木提供养分的某些真菌,从而增加菌根真菌群落多样性(Morris et al.,2008;Kiers et al.,2011)。另外,施N量也是影响红松和水曲柳菌根真菌群落多样性变化的重要因素。Lilleskov et al.(2002)对白云杉(Picea glauca)外生菌根真菌群落结构的研究发现,低N样地的 Piloderma、丝膜菌属(Cortinarius)和棉革菌属(Tomentella)在高N样地中完全消失。在一定范围内,施N有利于菌根真菌的生长发育,但超过一定水平,施N会抑制菌根真菌的生长发育,即菌根真菌对N素营养的利用是有限的。本研究施N量50 kg∙hm-2∙a-1处于低N水平(洪丕征等,2016),能够促进菌根真菌的生长,有利于其多样性的增加。
4 结论
连续6年的模拟氮沉降增加改变了长白山阔叶红松林中外生菌根树种红松和内生菌根树种水曲柳菌根真菌群落结构和多样性。在属水平上,施N显著降低了表层(0~10 cm)红松和水曲柳菌根真菌数量,同一属或不同属的红松和水曲柳菌根真菌对施N均表现出响应差异。另外,连续6年施N显著增加了不同土壤层次(0~10 cm和10~20 cm)红松和水曲柳菌根真菌的多样性。本试验通过对不同菌根类型树种菌根真菌群落结构对 N沉降增加的响应研究,进一步了解了菌根真菌的多样性、生态适应性及其对生态因子的响应机制,有助于深入理解全球变化背景下菌根真菌在森林生态系统功能中的重要作用。
BONFANTE P, GENRE A. 2010. Mechanisms underlying beneficial plant-fungus interactions in mycorrhizal symbiosis [J]. Nature Communications, 1: 1-11.
BULLOCK J M. 2006. Plants [M]//In: Sutherland W J. Ecological census techniques: a handbook, 2nd ed. Cambridge: Cambridge University Press.CLEMMENSEN K E, FINLAY R D, DAHLBERG A, et al. 2015. Carbon sequestration is related to mycorrhizal fungal community shifts during long-term succession in boreal forests [J]. New Phytologist, 205(4):1525-1536.
COX F, BARSOUM N, LILLESKOV E A, et al. 2010. Nitrogen availability is a primary determinant of conifer mycorrhizas across complex environmental gradients [J]. Ecology Letters, 13(9): 1103-1113.
DAHLBERG A. 2001. Community ecology of ectomycorrhizal fungi: an advancing interdisciplinary field [J]. New Phytologist, 156(3): 555-562.
EGERTON-WARBURTON L M, ALLEN E B. 2000. Shifts in arbuscular mycorrhizal communities along an anthropogenic nitrogen deposition gradient [J]. Ecological Applications, 10(2): 484-496.
FANG J Y, CHEN A P, PENG C H, et al. 2001. Changes in forest biomass carbon storage in China between 1949 and 1998 [J]. Science,292(5525): 2320-2322.
FREY S D, KNORR M, PARRENT J L, et al. 2004. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperatehardwood and pine forests [J].Forest Ecology and Management, 196(1): 159-171.
GRMAN E. 2012. Plant species differ in their ability to reduce allocation to non-beneficial arbuscular mycorrhizal fungi [J]. Ecology, 93(4): 711-718.
GUO D L, XIA M X, WEI X, et al. 2008. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species [J]. New Phytologist,180(3): 673-683.
HAAS B, GEVERS D, EAR A, et al, 2011. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons [J]. Genome research, 21(3): 494-504.
HE F, YANG B D, WANG H, et al, 2016. Changes in composition and diversity of fungal communities along Quercus mongolica forests developments in Northeast China [J]. Applied Soil Ecology, 100:162-171.
HIJRI I, SYKOROVA Z, OEHL F, et al. 2006. Communities of arbuscular mycorrhizal fungi in arable soils are not necessarily low in diversity[J]. Molecular Ecology, 15(8): 2277-2289.
JONSSON L, DAHLBERG A, BRANDRUD T E. 2000. Spatiotemporal distribution of an ectomycorrhizal community in an oligotrophic Swedish Piceaabies forest subjected to experimental nitrogen addition:Above-and below-ground views [J]. Forest Ecology and Management,132(2-3): 143-156.
JUMPPONEN A, JONES K L, BLAIR J. 2010. Vertical distribution of fungal communities in tallgrass prairie soil [J]. Mycologia, 102(5): 1027-1041.
KIERS ET, DUHAMEL M, BEESETTY Y, et al. 2011. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis [J]. Science,333(6044): 880-882.
KJLLER R, NILSSON LO, HANSEN K, et al. 2012. Dramatic changes in ectomycorrhizal community composition, root tip abundance and mycelial production along a stand-scale nitrogen deposition gradient[J]. New Phytologist, 194(1): 278-286.
LEHTO T, ZWIAZEK J J. 2011. Ectomycorrhizas and water relations oftrees: a review [J]. Mycorrhiza, 21(2): 71-90.
LIANG Z, DRIJBER R A, LEE D J. et al. 2008. DGGE-cloning method to characterize arbuscular mycorrhizal community structure in soil [J].Soil Biology and Biochemistry, 40(4): 956-966.
LILLESKOV E A, FAHEY T J, LOVETT G M. 2001. Ectomycorrhizal fungal aboveground community change over an atmospheric nitrogen deposition gradient [J]. Ecological Applications, 11(2): 397-410.
LILLESKOV E A, FAHEY T, HORTON T. 2002. Belowground ectomycorrhizal fungal community change over a nitrogen deposition gradient in Alaska [J]. Ecology, 83(1): 104-115.
LIU X J, DUAN L, MO J M, et al. 2011. Nitrogen deposition andits ecological impact in China: An overview [J]. Environmental Pollution,159(10): 2251-2264.
LÜ C Q, TIAN H Q. 2007. Spatial and temporal patterns of nitrogen deposition in China: Synthesis of observational data [J]. Journal of Geophysical Research, 112(D22): D22S05.
MORRIS M H, PEREZ-PEREZ M A, SMITH M E, et al. 2008. Multiple species of ectomycorrhizal fungi are frequently detected on individual oak root tips in a tropical cloud forest [J]. Mycorrhiza, 18(8): 375-383.OPIK M, MOORA M, LIIRA J, et al. 2006. Composition of root-colonizing arbuscular myconrhizal fungal communities in different ecosystems around the globe [J]. Journal of Ecology, 94(4): 778-790.
PREGITZER K S, DE F J L, BURTON A J, et al. 2002. Fine-root architecture of nine North American trees[J]. Ecological Mon-ographs,72: 293-309.
TALBOT J M, ALLISON S D, TRESEDER K K. 2008. Decomposers in disguise: mycorrhizal fungi as regulators of soil C dynamics in ecosystems under global change [J]. Functional Ecology,22(6):955-963.
TRESEDER K K, ALLEN M F. 2002. Direct nitrogen and phosphorus limitation of arbuscular mycorrhizal fungi:a model and field test [J].New Phytologist, 155(3): 507-515.
VAN DIEPEN L T A, ENTWISTLE E M, ZAK D R. 2013. Chronic nitrogen deposition and the composition of active arbuscular mycorrhizal fungi [J]. Applied Soil Ecology, 72: 62-68.
VAN DIEPEN L T A, LILLESKOV E A, PREGITZER K S, et al. 2010.Simulated nitrogen deposition causes a decline of intra-and extraradical abundance of arbuscular mycorrhizal fungi and changes in microbial community structure in Northern Hardwood forests [J]. Ecosystems,13(5): 683-695.
VASUTOVAM,EDWARDS-JONASOVAM,BALDRIANP, et al, 2017.Distinct environmental variables drive the community composition of mycorrhizal and sprotrophic fungi at the alpine treeline ecotone [J].Fungal Ecology, 27(Part A): 116-124.
WAGG C, JANSA J, STADLER M, et al. 2011a. Mycorrhizal fungal identity and diversity relaxes plant-plant competition [J]. Ecology,92(6): 1303-1313.
WHITE T J, BRUNS T, LEE S, et al. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [J]. PCR protocols: a guide to methods and applications, 18: 315-322.
WRIGHT S, BERCH S M, BERBEE M. 2009. The effect of fertilization on the below-ground diversity and community composition of ectomycorrhizal fungi associated with western hemlock (Tsuga heterophylla) [J]. Mycorrhiza, 19(4): 267-276.
YU J,XUEZ K,HEX L, et al. 2017. Shifts in composition and diversity of arbuscular mycorrhizal fungi and glomalin contents during revegetation of desertified semiarid grassland [J].Applied Soil Ecology, 115: 60-67.
YU M X, LI Q F, HAYES M J, et al. 2014. Are droughts becoming more frequent or severe in China based on the standardized precipitation evapotranspiration index: 1951—2010? [J]. International Journal of Climatology, 34(3): 545-558.
洪丕征, 刘世荣, 于浩龙, 等. 2016. 模拟氮沉降对红椎人工幼龄林土壤微生物生物量和微生物群落结构的影响[J]. 山东大学学报(理学版), 51(5): 18-28.
姜清彬, 仲崇禄, 陈羽, 等. 2016. 红菇菌根食用菌接种马尾松苗期的共生效应研究[J]. 中南林业科技大学学报, 36(8): 6-9, 38.
李晓亮. 2015. 藏东南地区海拔和土地利用方式对丛枝菌根真菌多样性和群落结构的影响[D]. 北京: 中国农业大学: 12
李月蛟, 朱利英, 尹华军, 等. 2015. 连续三年夜间增温和施氮对云杉外生菌根及菌根真菌多样性的影响[J]. 生态学报, 335(9): 2967-2977.
刘润进, 陈应龙. 2007. 菌根学[M]. 北京: 科学出版社: 1-447.
施晓峰, 黄晶晶, 史亚, 等. 2017. 半夏丛枝菌根真菌多样性研究[J]. 陕西中医药大学学报, 40(3): 75-81.
孙玥, 庄海峰, 贾淑霞, 等. 2010. 多年施用氮肥对水曲柳人工林内生菌根真菌侵染及其根尖形态的影响[J]. 林业科学, 46(9): 51-57.
唐明, 黄艳辉, 盛敏, 等. 2007. 内蒙古盐碱土中AM真菌的多样性与分布[J]. 土壤学报, 44(6): 1104-1110.
图力古尔, 陈今朝, 王耀, 等. 2010. 长白山阔叶红松林大型真菌多样性[J]. 生态学报, 30(17): 4549-4558.
王薇, 图力古尔. 2015. 长白山地区大型真菌的区系组成及生态分布[J].吉林农业大学学报, 37(1): 26-36.
徐灿. 2017. 粒毛盘菌黑色素及其衍生物结构、生物活性与作用机制[D].合肥: 合肥工业大学: 57.
薛璟花, 莫江明, 李炯, 等. 2004. 氮沉降对外生菌根真菌的影响[J]. 生态学报, 8(24): 1790-1796.
薛璟花, 莫江明, 李炯, 等. 2005. 氮沉降增加对土壤微生物的影响[J].生态环境, 14(5): 777-782.
杨丽韫, 罗天祥, 吴松涛. 2005. 长白山原始阔叶红松林不同演替阶段地下生物量与碳、氮贮量的比较[J]. 应用生态学报, 16(7):1195-1199.
周玮, 周运超, 叶立鹏. 2014. 种植密度及土壤养分对马尾松苗木根系的影响[J]. 中南林业科技大学学报, 34(11): 18-22.

