模拟氮沉降对高寒草甸土壤纤毛虫群落的影响
宁应之,张惠茹,王芳国,杨永强,杜国祯
1. 西北师范大学生命科学学院,甘肃 兰州 730070;2. 兰州大学生命科学学院,甘肃 兰州 730000
大气污染已经成为当今世界亟待解决的重要问题之一,其中由于化石燃料的燃烧、汽车尾气的排放和农业化肥的使用等情况日益严重,含氮化合物排放量急剧上升,导致氮沉降增加(韩雪等,2014),随之引发一系列生态环境问题,例如森林植被衰退、土壤和水体酸化、物种多样性降低等(Lu et al.,2014),这引起了科学家和公众的密切关注。目前国内外学者对氮沉降的研究主要集中在其对森林生态系统、温室气体通量以及土壤环境因子的影响等方面(王晖等,2006;张炜等,2008;李秋玲等,2013)。关于氮沉降对土壤动物的影响,则多见于徐国良(2004,2005)、林英华(2010)、荣海等(2011)、周丹燕等(2015)对农田和森林生态系统中土壤动物群落的研究,而有关草原生态系统中原生动物受氮沉降影响的调查鲜有报道。
甘南位于青藏高原东部,是青藏高原向黄土高原和内陆盆地过渡的典型地区,因其独特的地理单元和气候特征而具有丰富的生物资源(刘旻霞,2017)。高寒草甸作为当地最主要的草地类型(牛钰杰等,2017),是氮沉降等环境变化的敏感区域。土壤纤毛虫是最复杂和最高等的单细胞真核生物,因其具有独特的形态结构、生理功能和能对周围环境变化做出迅速反应等特点(宁应之等,2017),在生态学研究领域有着不容忽视的意义。大气氮沉降以无机态及有机态两种形式发生,无机态所占比重较大,约为70%,且硝态氮和铵态氮为无机氮素的主要形态(程云云等,2017),因此本研究选取硝酸铵人工模拟氮沉降,以甘南高寒草甸为研究样区,旨在揭示不同浓度氮肥作用下,土壤纤毛虫群落及土壤环境因子的变异,并探讨其相关性,以阐明氮沉降对其所产生的影响,为土壤原生动物对氮沉降的响应研究提供科学依据,补充氮沉降对生态系统影响的评价内容,为草原生态系统的良好稳定发展提供合理施肥的科学依据。
1 研究地区与研究方法
1.1 研究区概况
甘南藏族自治州玛曲县位于甘肃省西南部(图1),地处甘、青、川三省交界地带,地理坐标为100°45′~102°29′E,33°06′~34°30′N,海拔 3500~3800 m。该地区地势西高东低,气候属典型的高原大陆性气候,无明显四季之分,地貌复杂。年平均气温1.1~2.7 ℃,年降水量约611.9 mm(包延东等,2017)。样区主要土壤类型为高山草甸壤,呈微酸性至碱性(戚登臣等,2007);主要植被类型为高寒草甸,以莎草科(Cyperaceae)和禾本科(Gramineae)为主,多分布矮生嵩草(Kobresia humilis)、线叶嵩草(K. capillifolia)和披碱草(Elymus dahuricus)等。
图1 研究区地理位置Fig. 1 Location of study area
1.2 研究方法
1.2.1 样地设置
2009年在甘南玛曲县阿孜实验站选取实验样地,设置16个(4×4)面积为60 m2(6 m×10 m)的小样方,为防止干扰,各样方间设置1 m缓冲地带(不施肥),同时仅冬春季放牧。结合当地氮沉降情况,参照国际相关研究的处理方法(Gundersen et al.,1998),设计 4个不同水平的处理,即对照组(CK,不施氮肥)、低氮处理组(T5,5 g∙m-2∙a-1)、中氮处理组(T10,10 g∙m-2∙a-1)和高氮处理组(T20,20 g∙m-2∙a-1),每个处理组重复4次,随机分布,保证每列每行都有4个不同水平氮沉降处理组。于次年5月底进行一次性氮沉降处理,所用肥料为颗粒状NH4NO3,其有效氮含量约46%。为避免氮沉降不均产生斑块异质而造成实验误差,将NH4NO3溶于水并均匀洒入样地,CK喷洒等量自来水,各样方除氮施用量不同外,其他处理保持一致。
1.2.2 样品采集与处理
于2011年分季节完成4次采样。采用用梅花五点取样法,拣去土层表面凋落物,用15 mL圆筒形采样器采集0~5 cm土壤层土样25份,混匀装袋并做好标记。采样时观察样地植被类型,并用GPS测定仪测得样区海拔和地理坐标。所得新鲜土样部分用于测土壤含水量及 pH,剩余土样倒入白瓷盘中,覆盖透气草纸使其自然风干备用,紧闭门窗以防空气中的纤毛虫包囊进入土壤而污染土样(宁应之等,2007)。
1.2.3 鉴定方法和数据测定
(1)纤毛虫的培养和鉴定
定性研究采用“非淹没培养皿法”(non-flooded petri dish method),即在25 ℃下将50 g风干土样置于直径为15 cm的培养皿中,加土壤浸出液令其在充分浸润但不淹没的状态下培养(Foissner,1992),之后用生物显微镜进行活体镜检分类,并配合 Wilbert蛋白银染色法(Wilbert,1975)进行观察,根据实验记录,依据Lynn(2008)分类系统对纤毛虫进行分类。定量研究采用“3级10倍环式稀释法”,即将风干土样稀释至10-1、10-2、10-3这3种浓度,并将由0.5 g NaCl+1.2 g琼脂+98 mL蒸馏水配制而成的培养基趁热倒入直径为9 cm的培养皿中,快速埋入5个小玻璃杯,取3级土壤稀释液各1 mL接种于各玻璃杯内,置于25 ℃下培养,之后分别在培养第 4、7、11天时镜检分类,根据密度换算表计算纤毛虫数量(Stout,1962)。
(2)土壤理化因子的测定
土壤含水量采用烘干法进行测定(李广文等,2009);土壤温度于采样时使用曲管地温计(温度范围:-10~60 ℃)进行测量;土壤pH使用TSS-851土壤湿度酸度计进行测量(四平市电子技术研究所);土壤速效氮使用全自动流动注射仪进行测量(兰州大学生命科学学院)。
1.3 数据处理
统计纤毛虫物种数量并进行类群划分,将物种数量占全部物种总数比例最多的目(order)定义为优势类群,次多的目为次优势类群,剩余各目均为常见类群(宁应之等,1998)。
对不同氮沉降处理组的相关指标进行单因素方差分析,采用LSD法比较显著差异性分析;对土壤纤毛虫物种数据进行氮处理与季节间无重复双因子方差分析;对土壤纤毛虫物种数据与环境因子进行冗余分析及Pearson相关性分析。所有数据均运用SPSS 23.0软件进行处理;运用Primer 5.0进行Cluster及MDS分析;运用Canoco 4.5进行冗余分析;运用Arcview gis 9.3及GPS获得的经纬度数据绘制样区地图;运用Origin 8.0绘制柱状图。
土壤纤毛虫群落多样性采用 Gleason-Margalef多样性指数 d(沈韫芬等,1990)进行评价,具体计算公式如下:

式中,S为类群数(50 g实验土样中观察到的所有物种数);N为群落中所有类群个体总数(纤毛虫密度×土样质量,土样质量为50 g)。
C/P系数指纤毛虫中r-对策者与K-对策者的比值,即肾形纲(Colpodea)纤毛虫与异毛纲(Heterotrichea)、瓶纤纲(Armophorea)和旋毛纲(Spirotrichea)纤毛虫的比值。它能够在一定程度上评价生态环境质量状况,在一般生态环境中C/P系数≤1,且其值越小表明生境越稳定、越良好(Foissner et al.,2005)。
2 结果与分析
2.1 土壤纤毛虫群落特征对氮沉降的响应
2.1.1 群落组成
本研究在 4个样点共鉴定到土壤纤毛虫 121种,隶属于9纲16目28科46属(表1)。其中,优势类群为散毛目(Sporadotrichida),共 3科 10属27种,占物种总数的22.31%;次优势类群为刺钩目(Haptorida),共4科8属24种,占物种总数的19.83%;常见类群有肾形目(Colpodida)、尾柱虫目(Urostylida)、篮环目(Cyrtolophosidida)、齿管目(Chlamydodontida)、前管目(Prorodontida)、帆口目(Pleuronematida)、排毛目(Stichotrichida)、四膜目(Tetrahymenida)、游仆虫目(Euplotida)、瓶纤目(Armophorida)、固着目(Sessilida)、篮口目(Nassulida)、嗜污目(Sathrophilus)和异毛目(Heterotrichida)等14类,共计70种,占物种总数的57.85%。
各处理组纤毛虫群落组成也存在显著差异,如图2所示,CK纤毛虫类群数最为丰富,且随着氮沉降量量的增加,各处理组纤毛虫群落组成趋于简单化。CK 及 T5优势类群为散毛目(Sporadotrichida);T10优势类群为散毛目和肾形目(Colpodida);而T20优势类群仅有肾形目,这表明氮沉降处理在使纤毛虫群落组成简单化的同时,也使得分布其中的纤毛虫物种也相应低等化,由高等复杂的腹毛类纤毛虫变为低等适应性更强的肾形类纤毛虫。
2.1.2 物种分布
经统计,各处理组土壤纤毛虫物种分布情况为:CK共分布68种,占物种总数的56.20%,物种最为丰富;T5和T10次之,分别具53、43种,占物种总数的43.80%、35.54%;T20物种分布最少,仅24种,占物种总数的19.83%。回归分析表明,随氮沉降量增加,纤毛虫物种数显著减少,回归方程为 ŷ=-0.4599x+30.364(R²=0.9881,P=0.006)。
应用 Primer 5.0对各处理组的物种分布进行Cluster和MDS分析,结果见图3。在欧氏距离为0.8相似性水平上各处理组被分为三类,T5与 T10组合在一起,CK和T20各自独成一组。在欧氏距离为1.3相似性水平上各处理组又被聚为两类,T5、T10与CK聚为一组,T20独成一组。MDS分析结果与 Cluster一致。这表明 T5与 T10物种分布最为相似,它们与CK物种分布较相似,而T20与其他处理组差异很大。
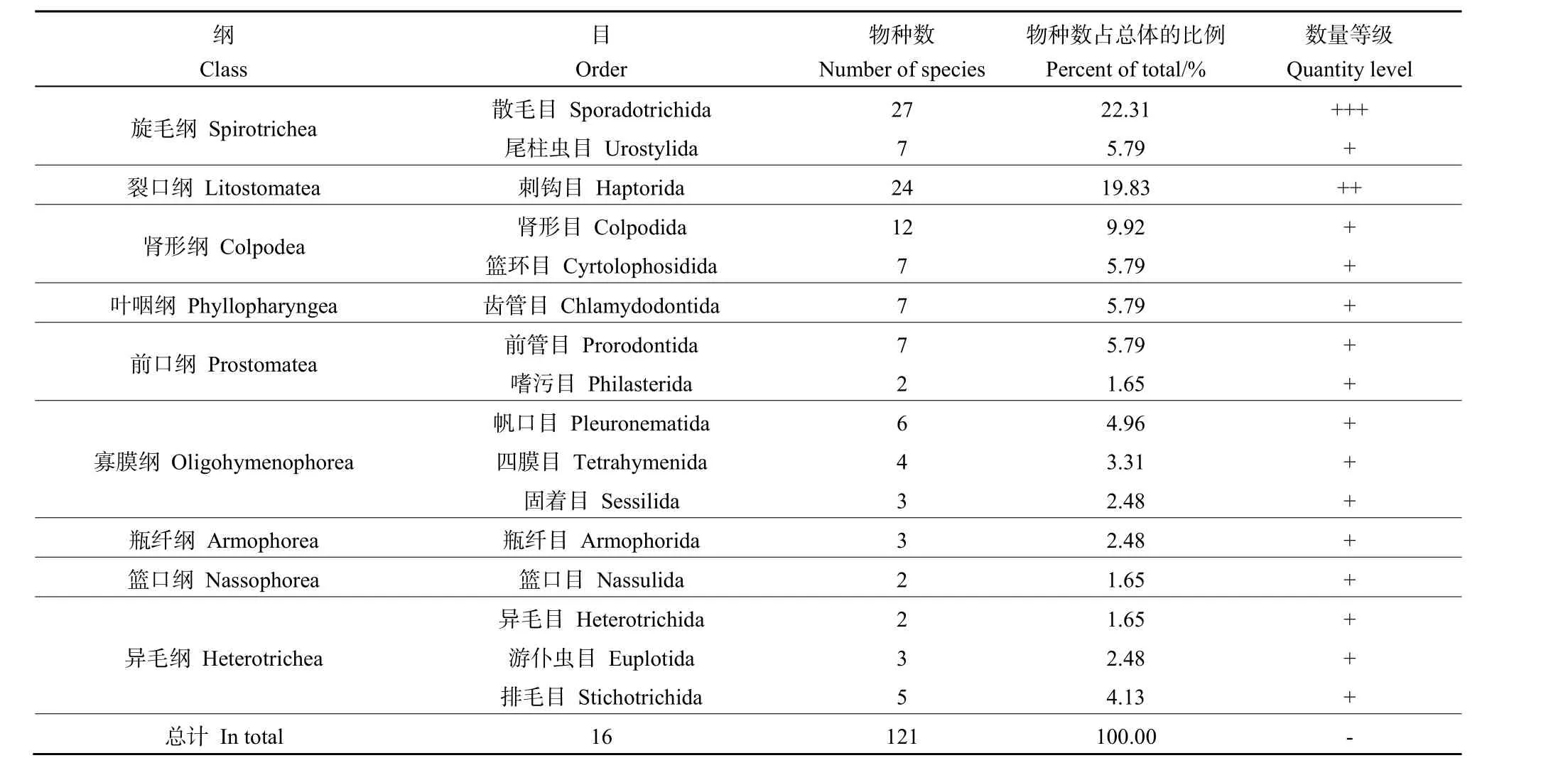
表1 纤毛虫群落组成及数量等级Table 1 Ciliate community composition and quantity level
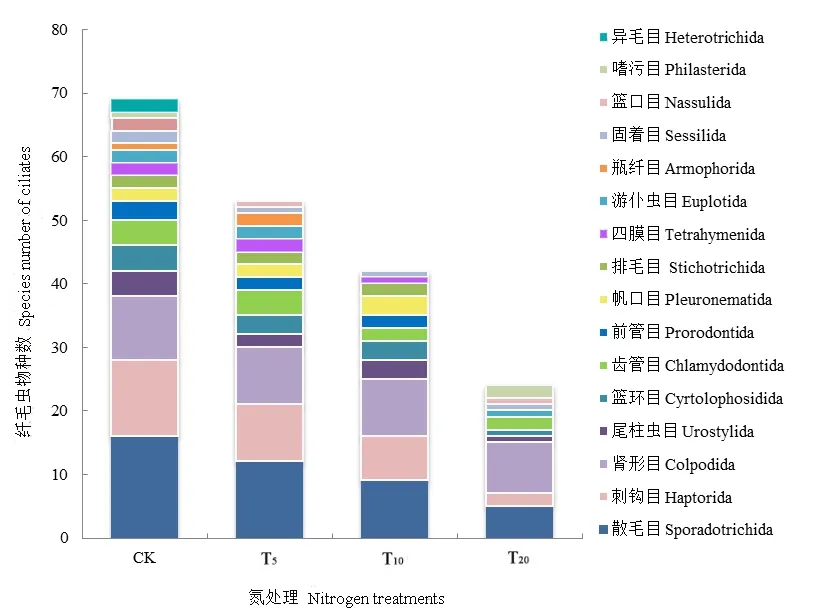
图2 各处理组土壤纤毛虫群落组成Fig. 2 The community composition of soil ciliates in various treatment group
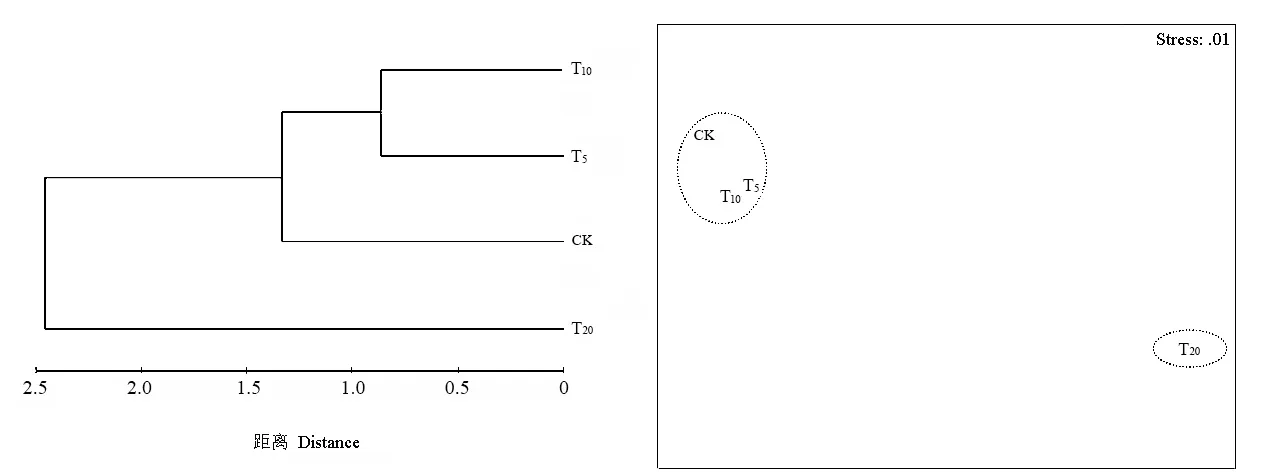
图3 各处理组土壤纤毛虫物种分布的Cluster和MDS分析Fig. 3 The cluster and MDS analysis on species distribution of soil ciliates in various treatment group
2.1.3 优势种
将出现频次较高的种定义为优势种。就各处理组的物种分布而言,CK优势种为小尖毛虫(Oxytricha minor)、野生假膜虫(Notohymena selvatica)、刚强殖口虫(Gonostomum strenuum)、粘游仆虫(Euplotes muscicola)、钝单镰虫(Drepanomonas obtusa);T5优势种为刚强殖口虫(G. strenuum)、颗粒尖毛虫(O. granulifera)和钝单镰虫(D. obtusa);T10优势种为颗粒尖毛虫(O.granulifera)、僧帽肾形虫(Colpoda cucullus)和粗糙肾形虫(C. aspera);T20优势种单一,为僧帽肾形虫(C. cucullus)和土壤肾形虫(C. edaphoni)。随着氮沉降量增加,优势种也从腹毛类纤毛虫演替为肾形类纤毛虫,且种类数逐渐减少。
2.1.4 广布种和特有种
广布种即为所有处理组中均出现的种,共 12种,占物种总数的9.92%。特有种指仅在一个处理组中出现的物种,CK中分布最多,共39种,占物种总数的 32.23%;T5分布 29种,占物种总数的23.97%;T10分布12种,占物种总数的9.92%;T20仅分布2种,占物种总数的1.65%。各处理组中特有种数目变化与优势种一致,即 CK>T5>T10>T20,回归分析也表明,随着氮肥处理浓度的增加,特有种种类数显著减少,回归方程为ŷ=-0.4976x+18.951(R²=0.9383,P=0.031)。
2.1.5 C/P系数
CK、T5、T10的 C/P系数分别为 0.54、0.63、0.86,而T20的C/P系数大于1,说明CK中以K-型腹毛类纤毛虫占优势,而 T20中以 r-型肾形类纤毛虫为主,表明土壤环境状况随氮沉降量增加逐渐趋于恶劣,高氮处理严重破坏了土壤环境。
2.2 土壤环境因子对氮沉降的响应
如表2所示,氮沉降处理对土壤含水量、土壤温度和速效氮的影响差异均不显著,但对pH具有显著影响(P<0.05)。各氮沉降处理组土壤含水量均高于对照组,且随着氮沉降量增大呈上升趋势,4个季节均以 T20土壤含水量最高。氮沉降处理对土壤温度的影响与含水量呈相反趋势,即随着氮沉降量增加,土壤温度下降,且其随季节变化呈现出夏季最高、冬季最低的特征。与对照组相比,氮沉降处理使pH下降了0.03~0.83个单位,沉降量越高其下降幅度越大。氮沉降处理对速效氮的影响总体表现为随沉降量的增加,速效氮含量也增加,而在各季节表现出不同的趋势。
2.3 土壤纤毛虫物种数、密度及多样性指数对氮沉降的响应
土壤纤毛虫物种数、密度及多样性指数均随不同水平氮沉降处理发生了不同程度的改变。如图 4所示,土壤纤毛虫物种数在各季节均表现为对照组(CK)显著高于氮沉降处理(P<0.05),而在各氮沉降处理组中纤毛虫物种数又随着氮沉降量的增加呈下降趋势,T20中观察到的物种数最少。这与荣海等(2011)、徐国良等(2005)对单施氮肥对土壤动物生物量的影响研究结果相一致,即高浓度氮处理会引起土壤动物类群数的下降。
土壤纤毛虫密度随着氮沉降量增加表现出不同的趋势,T5(春:138.50;夏:194.58;秋:269.58;冬:341.50)和T10(春:163.25;夏:195.58;秋:341.67;冬:384.92)纤毛虫密度显著高于CK(春:123.67;夏:165.58;秋:146.67;冬:198.08)(P<0.05),且各季节均以 T10纤毛虫密度为最大。除夏季外,T20(春:143.67;夏:98.33;秋:156.42;冬:218.50)纤毛虫密度均略大于 CK,但差异不显著,这表明低水平氮处理对纤毛虫密度表现为促进作用,而高水平下促进作用减弱,存在阈值效应。
不同水平氮处理对Gleason-Margalef多样性指数的影响与物种数一致,即随着氮沉降量的增大,多样性指数显著下降(P<0.05),CK(春:3.45;夏:3.99;秋:3.49;冬:4.58)多样性指数最高,T5(春:2.95;夏:3.26;秋:2.96;冬:3.90)次之,T10(春:2.57;夏:2.73;秋:2.68;冬:3.35)再次,T20(春:1.58;夏:1.53;秋:1.80;冬:2.05)最低。
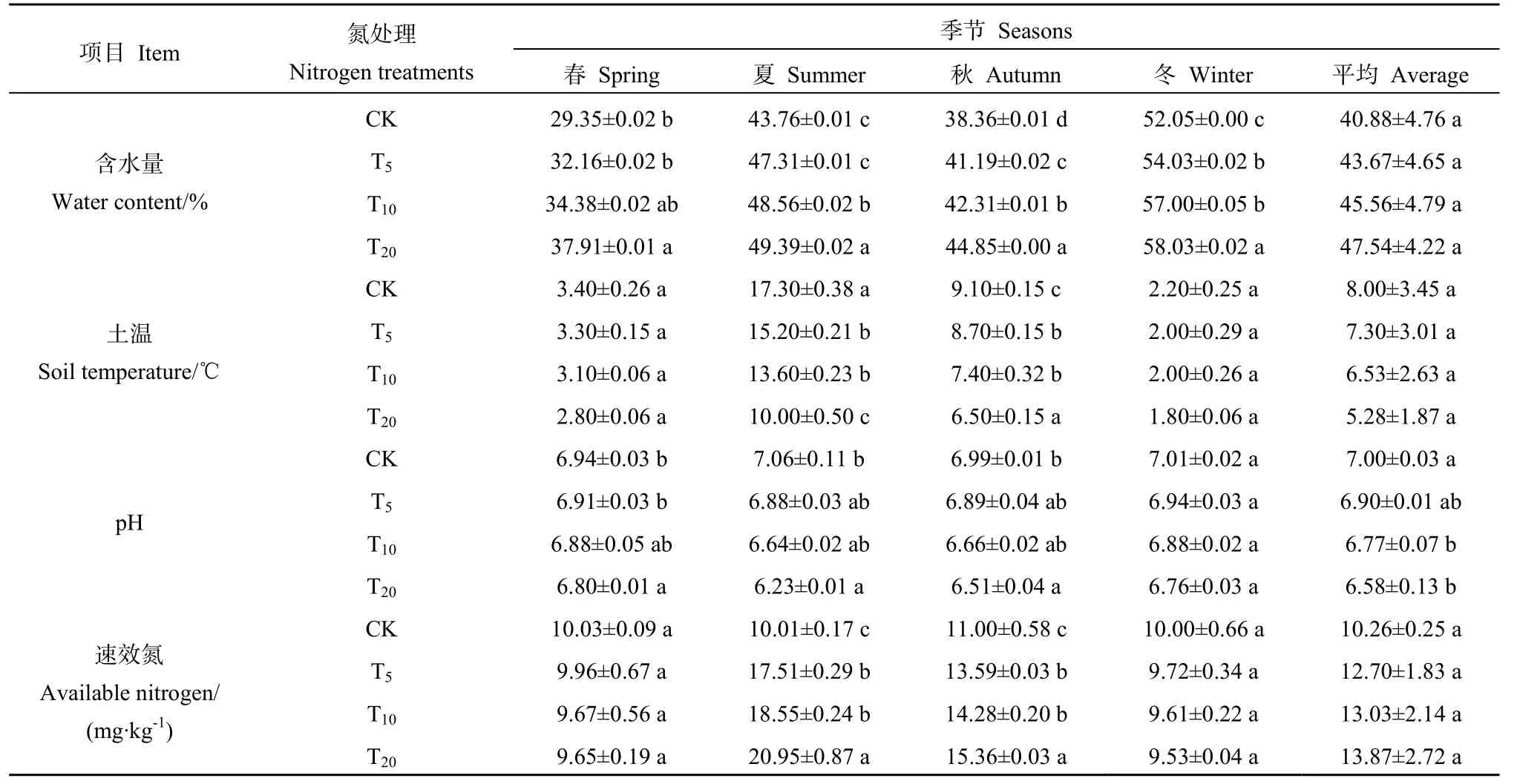
表2 各处理组环境因子Table 2 Environmental factors in various treatment group
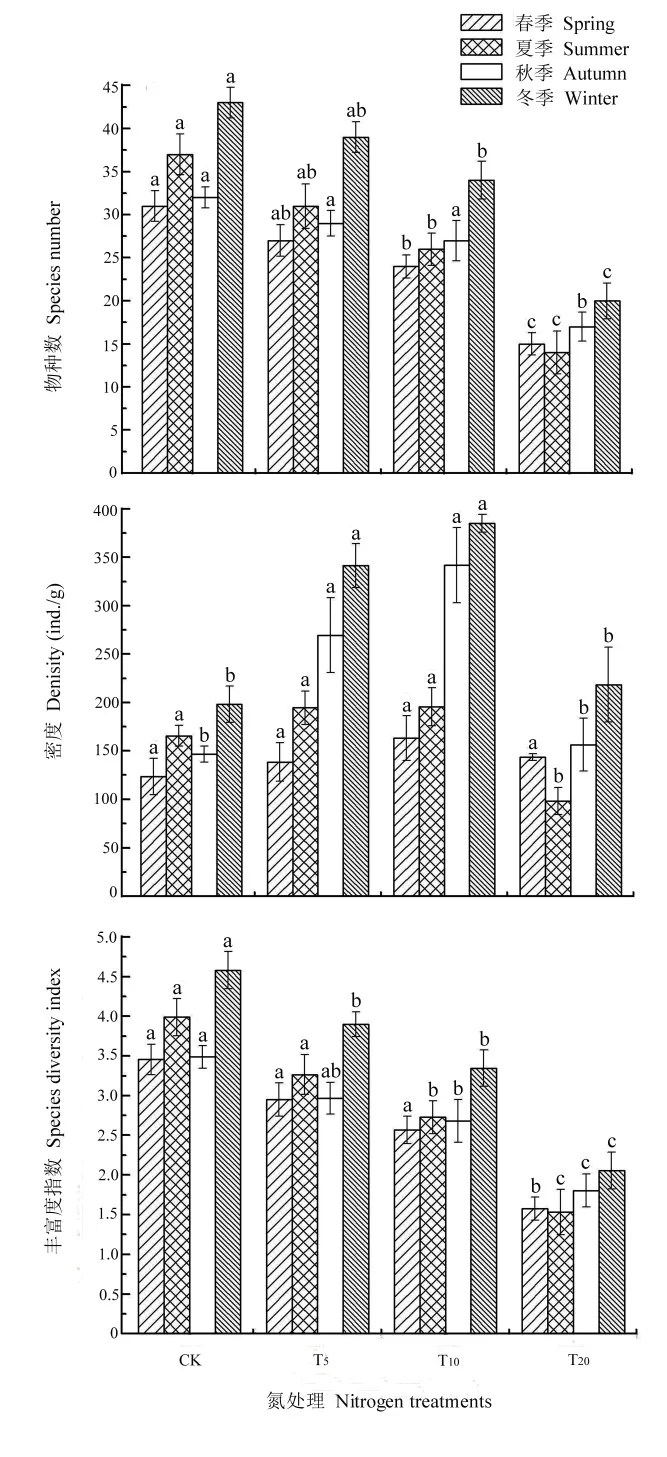
图4 各处理组纤毛虫物种数、密度和多样性指数Fig. 4 Species number, density, species diversity index in various treatment group
对土壤纤毛虫物种数、密度及多样性指数进行氮处理与季节间的无重复双因子方差分析,结果显示,土壤纤毛虫物种数对氮处理(P=0.000,F=12.424)和季节(P=0.000,F=16.168)的响应差异显著;密度对氮处理(P=0.000,F=3.867)和季节(P=0.000,F=20.750)的响应差异也显著;多样性指数对氮处理(P=0.000,F=12.414)和季节(P=0.000,F=10.515)的响应同样差异显著。
2.4 土壤环境因子对不同氮沉降处理土壤纤毛虫的影响
2.4.1 土壤纤毛虫物种数据与土壤环境因子的RDA分析
为确定合适的模型并进行排序分析,首先对物种数据进行DCA分析,即非约束性排序-去趋势对应分析,得知结果中 4个轴的最大梯度为 0.212,故采用线性模型-冗余分析(RDA)探讨纤毛虫物种数据与环境因子之间的关系。如表3所示,通过对环境因子进行蒙特卡罗置换检验(Monte Carlo Permutation Test),结果显示,含水量与pH是对纤毛虫群落具有显著影响的环境因子,通过手动预选对其与纤毛虫物种数据进行 RDA分析,提取到 2个有效排序轴(表 4),特征值分别为 0.5390和0.1140,累计贡献率达到65.3%,因此RDA排序分析一定程度上可反映土壤纤毛虫物种数据与环境因子之间的相关关系。第1排序轴与土壤含水量和土壤pH都呈正相关,第2排序轴与土壤含水量呈正相关,与土壤pH呈负相关。
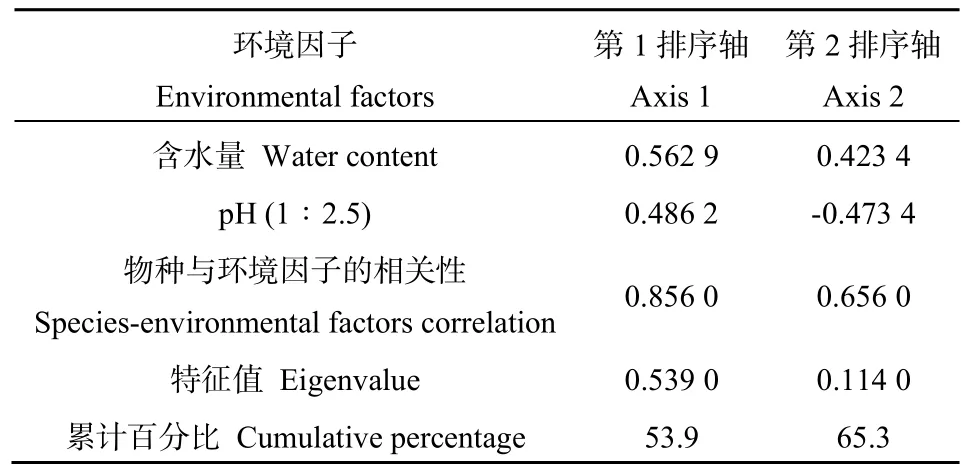
表4 环境变量与排序轴的相关系数Table 4 Correlation coefficients between environmental factors with ordination axes of RDA
图5所示为反映土壤环境因子与纤毛虫物种数据的RDA二维排序图,图中数字1~4代表氮沉降量依次增加的春季各处理组,同理 5~16代表氮沉降量依次增加的夏、秋、冬季各处理组。根据各射线夹角可知,纤毛虫密度与土壤含水量、纤毛虫物种数与土壤pH都呈正相关,相关性较强,纤毛虫多样性指数与土壤含水量和土壤pH均呈负相关。分析样点与环境因子间的相互关系可知,对照组与低氮处理组样点多分布于环境因子同侧,与环境因子关系更为密切,因此,RDA排序图可以很好地反映出纤毛虫物种参数与环境因子之间的关系。
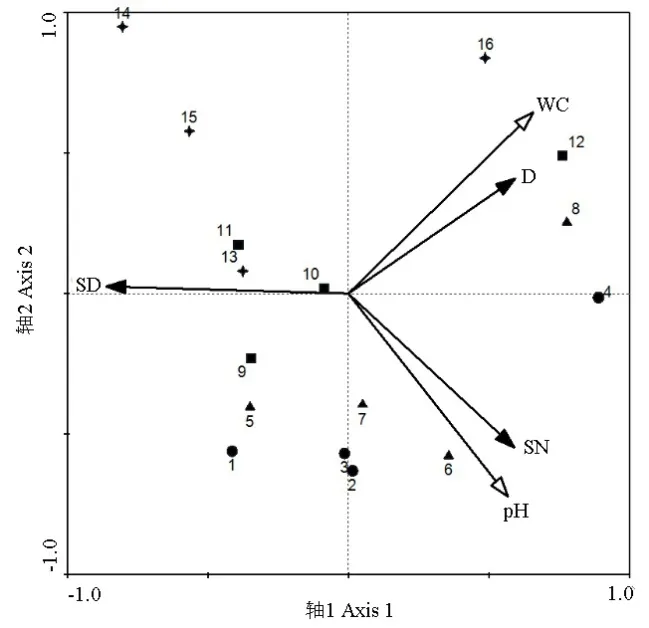
图5 物种-环境因子相关RDA排序图Fig. 5 RDA analysis ordination diagram of species-environment relationships
2.4.2 土壤纤毛虫物种数据与土壤环境因子的相关性分析
运用SPSS 23.0对土壤纤毛虫物种数据与环境因子进行Pearson相关性分析(Pearson correlation analysis),结果如表5所示,在氮处理下,土壤含水量与物种多样性指数呈极显著负相关(P=0.004),与密度呈显著正相关(P=0.036);土壤 pH与物种数呈极显著正相关(P=0.001);其他各因子之间相关性不显著。这与上述 RDA冗余分析的结果相吻合。综上所述,通过对各样点进行不同水平氮处理,该研究样区的环境因子发生了不同程度的改变,其中含水量与pH为起主导作用的因素,可以对纤毛虫的群落特征参数产生不同程度的影响。

表5 纤毛虫物种数据与环境因子的Pearson相关性分析Table 5 Relationships between species and environmental factors using Pearsonʹs correlation coefficient
3 讨论
3.1 氮沉降对土壤环境因子的影响
人工模拟氮沉降对研究区土壤环境因子产生了不同程度的影响,结果显示,氮处理对土壤 pH的影响最为显著(P<0.05),对土壤含水量、土壤温度和速效氮的影响均不显著。氮沉降处理使土壤pH显著下降,且氮沉降量越高,下降幅度越大,这与齐莎等(2010)、周丹燕等(2015)研究结果相一致。究其原因,过量的NO3-除通过反硝化作用或淋溶作用散失外,剩余部分被滞留在土壤中(肖辉林,2001),这可能使土壤处于氮“过饱和”状态,从而发生强烈的酸化作用;其次,Foster et al.(1989)研究表明,土壤中Ca2+的净损失会导致土壤酸化,而由氮沉降引起的土壤中 NO3-的过量会导致土壤中 Ca2+和 Mg2+等阳离子的淋失加重,故土壤随氮沉降量的增加呈明显弱酸性。各氮沉降处理组土壤含水量随氮沉降量增加呈上升趋势,这主要是由于各处理组土壤速效氮成分随着氮沉降量增大而升高,且植被覆盖率随植被总生物量的升高有所增加(周丹燕等,2015),从而提高了土壤保水性;而各氮沉降处理土壤含水量的季节变化均表现为冬季>夏季>秋季>春季,这与研究区所处的自然环境密切相关。氮沉降处理对土壤温度的影响与含水量呈相反趋势,即氮沉降量越高,土壤温度越低,但差异不显著;土壤温度也随季节变化呈现夏季最高、冬季最低的特征。氮沉降处理对土壤速效氮含量的影响在各季节间表现出不同趋势:春季各处理组速效氮含量无显著变化,这是由于研究区春季气温较低,植被生长及微生物活动相对较弱,单施氮肥对土壤速效氮含量影响并不显著;夏、秋两季速效氮含量随氮沉降量加大而增大,这是由于随着植被生长逐渐旺盛,微生物对腐殖质的分解等作用加强,且人为添加硝酸铵,使土壤中的硝态氮和氨态氮含量上升;而在冬季,氮沉降处理组速效氮含量相较于对照组有所下降,这是由于集中降雨期(5—10月)过后,淋溶作用加强,且植被的生长消耗了大量速效氮。
3.2 氮沉降对土壤纤毛虫群落的影响
随氮沉降量增大,各处理组土壤纤毛虫物种数呈线性显著减少(P<0.05),这与已有研究结果相一致,齐莎等(2010)认为,连续5年氮处理后,土壤生物量及其多样性均显著降低,在土壤原生动物中,土壤纤毛虫对氮处理的响应最为积极。根据前文对土壤纤毛虫物种数据与环境因子之间的 RDA分析和Pearson相关性分析可知,土壤pH与纤毛虫物种数呈极显著正相关(P<0.01)。人工模拟氮沉降后,土壤环境发生变化,其中最为显著的是土壤pH降低,导致土壤酸化,氮沉降量越高,pH下降幅度越大,T20处理组土壤pH均值为6.58,而最适宜纤毛虫生长的土壤 pH在 6.7~7.0之间(沈韫芬,1999),因此高氮处理组中纤毛虫物种数最低。此外,徐国良等(2003)指出氮沉降物性质也可对土壤动物的生长和繁殖产生直接作用,如酸沉降物与土壤动物直接接触可致其死亡。
氮沉降处理对纤毛虫密度的影响表现为 CK<T20<T5<T10,其中,T10纤毛虫密度最大,这表明氮沉降对纤毛虫密度的影响具有阈值效应,当氮沉降量控制在一定范围内时,对纤毛虫密度表现为促进作用,但当氮沉降量过高时,促进作用减弱。RDA分析与 Pearson相关性分析表明,土壤含水量与物种密度呈显著正相关(P<0.05),随氮沉降量的增加,各处理组土壤含水量呈上升趋势,因此纤毛虫密度在低氮及中氮处理后增加,但在高氮处理后有所下降,这是由于过量的氮肥使土壤中速效氮含量上升,降低了水分的有效性;再者,邱波等(2004)研究表明,单施氮肥会降低植被多样性,作为土壤原生动物最重要的栖息地,植被根系多样性的破坏也会使其密度降低。
纤毛虫多样性指数表现为 CK>T5>T10>T20,即随着氮沉降量增加,各处理组纤毛虫群落组成趋于简单化,优势种和特有种单一且都为具有良好适应能力的肾形虫,纤毛虫由较为高等的K-型纤毛虫演替为简单低等的r-型纤毛虫。究其原因,腹毛类纤毛虫属于纤毛虫中较为高级的阶元,个体大,只有当环境良好时才可以大量生存,而高氮处理使其受到环境胁迫,因此在 T20处理组中腹毛类纤毛虫分布最为罕见;其次,该类群主要摄食细菌、藻类及其他原生动物,氮沉降量处理在使土壤环境发生变化的同时,也会使土壤团聚体及土壤溶液渗透压发生改变,从而导致土壤微生物活动量减弱,转入休眠状态甚至死亡(宇万太等,2008),最终改变土壤微生物群落结构(张海芳等,2017)。肾形类纤毛虫是土壤纤毛虫中最常见的三大类群之一,除对摄食要求较低外,该类群适应能力极强,具有完善而迅速的脱包囊和形成包囊机制,因而能存活于氮沉降后较为恶劣的环境中,甚至经过长期适应,拥有较强的耐受性而成为高氮处理组的优势类群。随氮沉降量增加,纤毛虫物种数降低而密度增加,这也是纤毛虫多样性指数呈下降趋势的直接原因。
4 结论
本研究表明,在甘肃甘南高寒草甸人工模拟氮沉降后,高氮处理对纤毛虫群落组成具有消极影响,即高浓度氮肥不利于土壤纤毛虫群落物种多样性的提高,且对土壤纤毛虫密度的影响具有阈值效应。氮沉降处理通过影响土壤环境因子进而改变土壤纤毛虫群落结构,其主要制约因子为土壤含水量和pH。为维持稳定良好的生态系统功能,推荐5~10 g∙m-2∙a-1氮肥施用量作为高寒草甸最佳施肥水平参考值。氮沉降对生态系统的影响是一个长期渐进的过程,由于本试验研究周期较短,其对高寒草甸土壤纤毛虫群落的长期作用有待对多个影响因素、多地点及多时间点展开更深入的研究。
致谢:英国自然历史博物馆 Alan Warren(E-mail:a.warren@nhm.ac.uk)研究员为本文的英文摘要进行了润色,特此致谢!
FOISSNER W, BERGER H, XU K, et al. 2005. A huge, undescribed soil ciliate (Protozoa: Ciliophora) diversity in natural forest stands of Central Europe [J]. Biodiversity & Conservation, 14(3): 617-701.
FOISSNER W. 1992. Estimating the species richness of soil protozoa using the “non-flooded petridish method” [C]//Lee J J, Soldo ATods.Protocols in Protozoology. Lawrence: Allen Press: 10.1-10.2.
FOSTER N W, HAZLETT P W, NICOLSON J A, et al. 1989. Ion leaching from a sugar maple forest in response to acidic deposition and nitrification [J]. Water, Air, & Soil Pollution, 48(1-2): 251-261.
GUNDERSEN P, EMMETT B A, KJONAAS O J, et al. 1998. Impact of nitrogen deposition on nitrogen cycling in forests: a synthesis of NITREX data [J]. Forest Ecology and management, 101(1): 37-55.
LU X, MAO Q, GILLIAM F S, et al. 2014. Nitrogen deposition contributes to soil acidification in tropical ecosystems [J]. Global change biology,20(12): 3790-3801.
LYNN D. 2008. The ciliated protozoa: characterization, classification, and guide to the literature [M]. Berlin: Springer Science & Business Media:1-605.
STOUT J D. 1962. An estimation of microfaunal populations in soils and forest litter [J]. European Journal of Soil Science, 13(2): 314-320.
WILBERT N. 1975. An improved technique of protargol impregnation for ciliates [J]. Mikrokosmos, 64(6): 171-179.
包延东, 刘长仲. 2017. 甘南州天然草原生态环境现状及恢复治理对策[J]. 甘肃畜牧兽医, 47(3): 108-109.
程云云, 孙涛, 王清奎, 等. 2017. 模拟氮沉降对温带森林土壤线虫群落组成和代谢足迹的影响[J]. 生态学报, 38(2): 1-10.
韩雪, 王春梅, 蔺照兰. 2014. 模拟氮沉降对温带森林凋落物分解的影响[J]. 生态环境学报, 23(9): 1503-1508.
李广文, 王永洁, 罗金明, 等. 2009. 融冻时期扎龙湿地土壤含水量变化研究[J]. 高师理科学刊, 29(6): 71-74.
李秋玲, 肖辉林, 曾晓舵, 等. 2013. 模拟氮沉降对森林土壤化学性质的影响[J]. 生态环境学报, 22(12): 1872-1878.
林英华, 黄庆海, 刘骅, 等. 2010. 长期耕作与长期定位施肥对农田土壤动物群落多样性的影响[J]. 中国农业科学, 43(11): 2261-2269.
刘旻霞. 2017. 甘南高寒草甸植物元素含量与土壤因子对坡向梯度的响应[J]. 生态学报, 37(24): 1-10.
宁应之, 沈韫芬. 1998. 中国典型地带土壤原生动物: I. 区系特征和物种分布[J]. 动物学报, 44(1): 5-9.
宁应之, 王娟, 刘娜, 等. 2007. 甘肃天水麦积山风景名胜区土壤纤毛虫的物种多样性[J]. 动物学研究, 28(4): 367-373.
宁应之, 杨元罡, 苏苌, 等. 2017. 放牧对沼泽化草甸土壤纤毛虫群落的影响[J]. 生态学杂志, 36(6): 1614-1621.
牛钰杰, 周建伟, 杨思维, 等. 2017. 基于地形因素的高寒草甸土壤温湿度和物种多样性与初级生产力关系研究[J]. 生态学报, 37(24): 1-12.
戚登臣, 李广宇. 2007. 黄河上游玛曲湿地退化现状, 成因及保护对策[J]. 湿地科学, 5(4): 341-347.
齐莎, 赵小蓉, 郑海霞, 等. 2010. 内蒙古典型草原连续5年施用氮磷肥土壤生物多样性的变化[J]. 生态学报, 30(20): 5518-5526.
邱波, 罗燕江, 杜国祯. 2004. 施肥梯度对甘南高寒草甸植被特征的影响[J]. 草业学报, 13(6): 65-68.
荣海, 范海兰, 李茜, 等. 2011. 模拟氮沉降对农田大型土壤动物的影响[J]. 东北林业大学学报, 39(1): 85-88.
沈韫芬, 章宗涉, 龚循矩, 等. 1990. 微型生物监测新技术[M]. 北京: 中国建筑工业出版社: 1-524.
沈韫芬. 1999. 原生动物学[M]. 北京: 科学出版社: 1-656.
王晖, 莫江明, 薛璟花, 等. 2006. 氮沉降增加对森林凋落物分解酶活性的影响[J]. 热带亚热带植物学报, 14(6): 539-546.
肖辉林. 2001. 大气氮沉降对森林土壤酸化的影响[J]. 林业科学, 37(4):111-116.
徐国良, 莫江明, 周国逸, 等. 2003. 土壤动物与N素循环及对N沉降的响应[J]. 生态学报, 23(11): 2453-2463.
徐国良, 莫江明, 周国逸, 等. 2004. 模拟氮沉降对苗圃地土壤动物群落的影响[J]. 生态环境, 13(4): 487-492.
徐国良, 莫江明, 周国逸. 2005. 模拟氮沉降增加对南亚热带主要森林土壤动物的早期影响[J]. 应用生态学报, 16(7): 1235-1240.
宇万太, 姜子绍, 周桦, 等. 2008. 不同土地利用方式对潮棕壤微生物量碳及其周转率的影响[J]. 生态学杂志, 27(8): 1302-1306.
张海芳, 刘红梅, 赵建宁, 等. 2017. 贝加尔针茅草原土壤真菌群落结构对氮素和水分添加的响应[J]. 生态学报, 38(1): 1-11.
张炜, 莫江明, 方运霆, 等. 2008. 氮沉降对森林土壤主要温室气体通量的影响[J]. 生态学报, 28(5): 2309-2319.
周丹燕, 卜丹蓉, 葛之葳, 等. 2015. 氮添加对沿海不同林龄杨树人工林土壤动物群落的影响[J]. 生态学杂志, 34(9): 2553-2560.

