超高效液相色谱质谱联用技术在发酵乳有机酸分析中的应用
米智慧,陈永福,张和平
(内蒙古农业大学乳品生物技术与工程教育部重点实验室奶制品加工农业部重点实验室,呼和浩特010018)
0 引言
发酵乳系指牛乳等动物乳经乳酸菌发酵工艺而制成的一大类乳制品,是营养与保健功能兼备的食品之一[1-3]。因此有机酸组成及含量的测定对评价发酵乳品质具有重要作用。
如今测定有机酸的方法主要有:毛细管电泳法[4-5]、离子排斥色谱法[6-7]、高效液相色谱法[8-10]、气相色谱法[11]、气相质谱联用法[12-13]和超高效液相质谱联用法等[14-15]。液相质谱法相对于其它方法具有分离效果好、分离速度快、检出限低、分辨率高、灵敏度高等优点,并且对于有机酸的种类能明确判别。Huang Y与Xiang G等[16-17]利用该方法对有机酸进行定量分析。因此,本研究拟充分利用对极性化合物具有极佳保留特性的亚1.8μm颗粒的色谱柱ACQU ITY®HSS T 3,建立快速、灵敏的LC-M S方法并将其应用于发酵乳样品的定量分析。
1 实验
(1)仪器。Waters ACQU ITY UPLC-QTOF MS超高效液相色谱-四级杆飞行时间质谱仪,Waters MassLynx 4.1及QuanLynx工作站,Milli-Q纯水仪。
(2)试剂。超纯水(Milli-Q超纯水机制备),甲酸、甲酸钠(纯度为99%),乙腈(Optima®LC-M S级)。
(3)样品预处理。将发酵乳样品解冻后,准确称取1 g于10 mL的EP管中,加1 mol/L HCL 4 mL,漩涡混匀后,取1.5mL混合液于2 m LEP管中,11 000 g高速离心5 min,取1 mL上清液经0.22μm膜过滤于样品瓶中,待测备用。
(4)LC-M S条件。色谱柱W atersHSST 3(1.8μm,2.1mm×100mm),柱温30℃,流动相分别为(A)0.1%甲酸/1mmol/L甲酸铵溶液-(B)乙腈溶液,梯度洗脱条件(0~0.5 min,3%~3%B;0.5~3 min,3%~10%B;3~4 min,10%~30%B;4~5 min,30%~30%B;5~5.3 min,30%~3%B,运行时间6 min),流速0.25 mL/min,进样体积5.0μL。质谱检测采用ESI负离子模式,毛细管电压2.5 kV,锥孔电压40 V,离子源温度100℃,脱溶剂气温度450℃,锥孔气流量50 L/h,脱溶剂气流量600 L/h,并且以亮氨酸-脑啡肽[M-H=554.2615]作为质量校正轴的参比物。
(5)标准曲线的绘制。分别准确称取乙酸,乳酸,琥珀酸0.02 g,用超纯水充分溶解,再定容到100 mL,乙酸,乳酸,琥珀酸的质量浓度为200μg/mL,此溶液作为标准储备液,再逐级进行稀释,配成质量浓度为0.1,0.5,1,2,5μg/mL的混合标样,于-20℃冰箱保存备用。以上述5个不同质量浓度的标样各进样5.0μL,测得峰面积(Y),绘制峰面积(Y)与质量浓度(X)的标准曲线如表2所示,各化合物在各自浓度范围内线性良好。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 色谱柱的选择
有机酸带有羧基(-COOH),具有较强的极性,因此适合极性色谱柱。陈永福等[17]采用ZorbaxC 18SB-Aq色谱柱对发酵乳中的有机酸进行分析,虽具有分离效果,但分析时间较长,且灵敏度低,检出限高,无法检测到含量较小的有机酸。此外,刘瑶等[18]采用亲水作用色谱-质谱(H ILIC-LC-M S)测定参附注射液中的有机酸,但平衡色谱柱时间较长。本研究选用对极性化合物具有最佳保留特性的亚1.8μm颗粒的色谱柱W aters ACQU ITY®HSS T 3色谱柱对发酵乳中有机酸进行分离。
2.1.2 缓冲液及浓度选择
乙酸,乳酸和琥珀酸等有机酸的pKa值范围在3.5~4.5左右,为了抑制有机酸的电离,本研究选择缓冲液pH值为2。液相色谱一般采用磷酸盐缓冲液作为流动相对样品进行分离,但磷酸是非挥发酸,对液相及质谱都有一定的损害,所以本研究采用了甲酸铵缓冲液。由于有机酸具有较强的极性,利用相似相溶的原理,在流动相中加入了体积分数为0.1%的甲酸。
本研究分别采用3种不同流动相,以梯度洗脱(梯度洗脱条件如表1)的形式进行试验验证:A为0.1%甲酸水溶液与乙腈溶液,B为0.1%甲酸-5mm oL甲酸铵溶液与乙腈溶液,C为0.1%甲酸-1 mm o l/L甲酸铵溶液与乙腈溶液。结果表明,流动相A使目标化合物有杂峰,基线较高,色谱峰有毛刺;B中加了甲酸铵缓冲液后其峰型明显改善,无杂峰,峰型窄且尖,无毛刺且保留时间稳定无漂移,改变缓冲液浓度,流动相B体系与C体系在色谱柱上的保留效果基本一致。但是考虑到高浓度的缓冲盐体系会对色谱柱及溶剂管理器有一定的损害,且会对质谱喷雾造成影响,所以采用0.1%甲酸-1 mm ol/L甲酸铵溶液与乙腈作为流动相。当流动相流速为0.2 mL/min时,流速较低,色谱图峰形较宽;当流速为0.25 mL/min与0.3 mL/min的流速对色谱峰型并无太大影响,考虑到质谱喷雾效果,故采用0.25 mL/min作为最优流速。
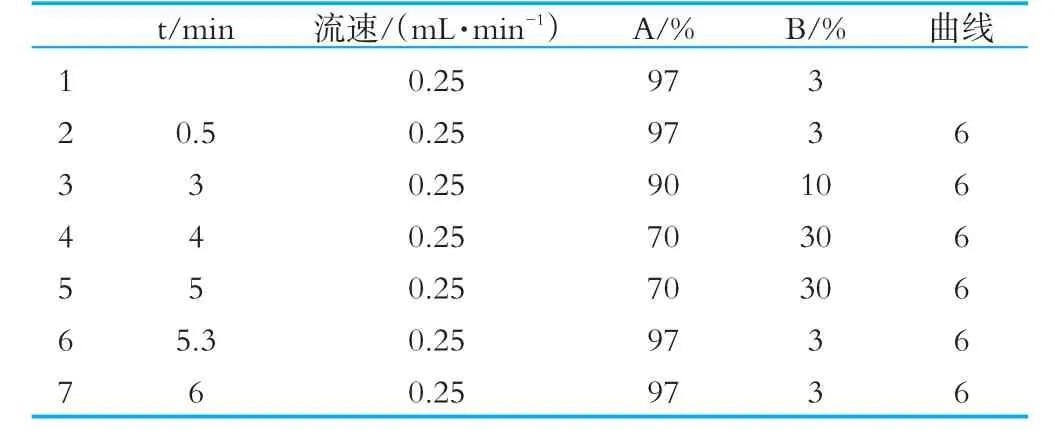
表1 流动相梯度洗脱

图1 有机酸标准样品色谱
2.2 线性范围与检出限
将混合标样进行逐级稀释,按低浓度到高浓度进行序列进样,得到标准品溶液的峰面积以及响应值。以有机酸标准品的峰面积为纵坐标,溶液质量浓度为横坐标进行标准曲线的绘制,计算回归方程和线性系数,同时以信噪比(S/N)为3∶1和10∶1为基准分别测得各化合物的检出限和定量限,结果如表2所示。由表2可以看出,各化合物在其浓度范围内线性较好,定量限范围为10~200 ng/mL,检出限范围为2.5~40 ng/mL。
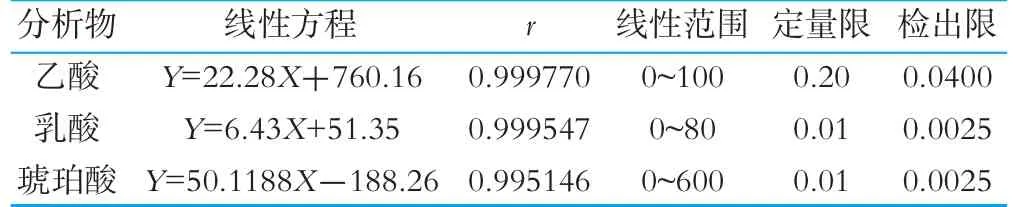
表2 有机酸的线性范围、线性回归方程、相关系数、方法检出与定量限 μg/mL
2.3 精密度与回收率实验
分别向已知浓度的样品中加入不同浓度的标准液(分别相当于发酵乳原有质量分数的80%,100%和120%),每一质量分数3份,每一加标溶液进行5次平行实验,按照1(4)中的方法,液质条件进行UPLC-M S分析,记录峰面积,计算其相对标准偏差(RSD),结果如表3所示。有机酸加样回收率范围93.5%~106.07%,各物质的回收率符合标准回收率范围(100%±20%),RSD均小于7%,说明该实验的精密度良好。
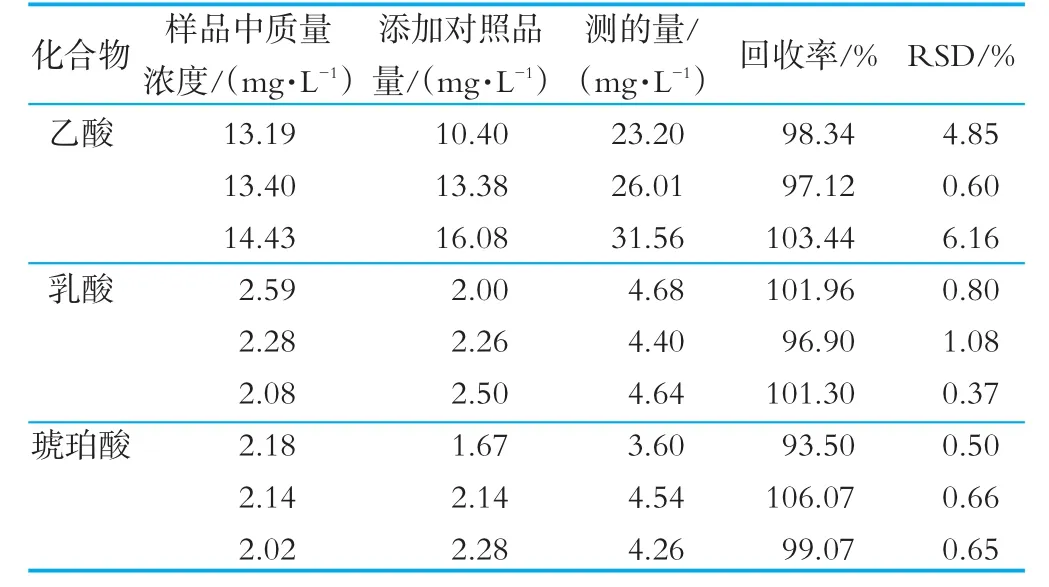
表3 回收率与精密度实验结果
3 结论
本研究基于UPLC-M S建立了发酵乳中乙酸、乳酸与琥珀酸的检测方法。试验选用ACQU ITY®HSST3色谱柱,以用质量分数为0.1%甲酸水溶液与乙腈溶液,0.1%甲酸-5mm ol/L甲酸铵溶液与乙腈溶液,0.1%甲酸-1 mm ol/L甲酸铵溶液与乙腈溶液3种流动相进行分析。结果表明,0.1%甲酸-1 mm o l/L甲酸铵溶液与乙腈溶液体系的色谱峰尖锐且对称,保留时间稳定,响应值高。通过绘制有机酸的标准曲线,得到了3种有机酸的线性回归方程以及线性范围。有机酸加样回收率范围93.5%~106.07%,相对标准偏差RSD值在0.5%~7%之间,说明本试验方法稳定、准确度高、回收率合格,为评定发酵乳的特性提供可靠依据。
[1]JELEN P,GALLMANN P,COOLBEAR T.Current and future applications of fermentation technology in the dairy industry[J].International Dairy Federation Special Issue,2003:10-20.
[2]VALLIC,TRAILLW B.Culture and food:a model of yoghurt consumption in the EU[J].Food Quality and Preference,2005,16(4):291-304.
[3]LOURENS-HATTINGH A,VILJOEN B C.Yogurt as probiotic carrier food[J].International Dairy Journal,2001,11(1):1-17.
[4]KENNEY B F.Determination of organic acids in food samples by capillary electrophoresis[J].Journal of Chromatography A,1991,546:423-430.
[5]PERESR G,MORAESE P,M ICKE G A,et al.Rapid method for the determination of organic acids in wine by capillary electrophoresis with indirect UV detection[J].Food Control,2009,20(6):548-552.
[6]CHINN ICI F,SPINABELLIU,R IPON IC,et al.Optimization of the determination of organic acids and sugars in fruit juices by ion-exclusion liquid chromatography[J].Journal of Food Composition and Analysis,2005,18(2):121-130.
[7]ALCAZAR A,FERNANDEZ-CACERESP L,MARTIM J,et al.Ion chromatographic determination of some organic acids,chloride and phosphate in coffee and tea[J].Talanta,2003,61(2):95-101.
[8]ZEPPA G,CONTERNO L,GERBIV.Determination of organic acids,sugars,diacetyl,and acetoin in cheese by high-performance liquid chromatography[J].Journal of agricultural and food chemistry,2001,49(6):2722-2726.
[9]SHUIG,LEONG L P.Separation and determination of organic acids and phenolic compounds in fruit juices and drinks by high-performance liquid chromatography[J].Journal of Chromatography A,2002,977(1):89-96.
[10]KONG Y,ZHANG L L,SUN Y,et al.Determination of the Free Amino Acid,Organic Acid,and Nucleotide in Commercial Vinegars[J].Journal of Food Science,2017,82(5):1116-1123.
[11]YANG M H,CHOONG Y M.A rapid gas chromatographic method for direct determination of short-chain(C2-C12)volatile organic acids in foods[J].Food Chemistry,2001,75(1):101-108.
[12]GRAHAM B,MAYOL‐BRACERO O L,GUYON P,et al.Water-soluble organic compounds in biomass burning aerosols over Amazonia 1.Characterization by NMR and GC-MS[J].Journal of Geophysical Research:Atmospheres,2002,107(D20).
[13]BEINER K,PLEWKA A,HAFERKORN S,et al.Quantification of organic acids in particulate matter by coupling of thermally assisted hydrolysis and methylation with thermodesorption-gas chromatography-mass spectrometry[J].Journal of Chromatography A,2009,1216(38):6642-6650.
[14]HUANG Y,TIAN Y,ZHANG Z,et al.A HILIC-MS/MSmethod for the simultaneous determination of seven organic acids in rat urine as biomarkers of exposure to realgar[J].Journal of Chromatography B,2012,905:37-42.
[15]XIANG G,YANG L,ZHANG X,et al.A comparison of three methods of extraction for the determination of polyphenols and organic acids in tobacco by UPLC-MS-MS[J].Chromatographia,2009:70(5-6):1007-1010.
[16]陈永福,王记成,云振宇,张和平.高效液相色谱法测定传统发酵乳中的有机酸组成[J].中国乳品工业,2007,(01):54-58.
[17]刘瑶,张娜,史社坡,宋青青,李军,宋月林,屠鹏飞.亲水作用色谱-质谱联用法同时测定参附注射液中的14种有机酸[J].中国中药杂志,2016,(18):3342-3348.

