核桃油贮藏过程抗氧化能力的研究
彭星星 ,乔茜华 ,张红云 ,高海军 ,高敬铭 ,戴冠苹 ,秦祎芳
(1.河南省粮油饲料产品质量监督检验中心,河南 郑州 450000;2.国家电网公司运行分公司郑州管理处,河南 郑州 450000)
核桃为世界四大干果之一。我国也是核桃的原产地之一,栽培面积和产量均居世界之首。现今核桃已然成为了我国核桃主产区乡村经济的支柱产业之一,在推动农业结构调整、提高农民收入和保障我国食用油供给安全等方面起到了重要的作用。祖国医学指出,核桃性温、味甘、无毒,有健胃、补血、润肺、养神等成效[1]。核桃具有很高的营养价值[2-5],核桃含油量约为65%,被称为“树上的油库”,核桃油脂肪酸组成主要是亚油酸、油酸和亚麻酸等不饱和脂肪酸,含量高达约为90%[6-7],对于降低胆固醇防治冠心病、动脉硬化和心肌梗塞等疾病有很大作用[8-10]。核桃油中富含黄酮类物质[11-12],还含有神经酸、鳕油酸、EPA、DHA、角鲨烯、褪黑素、黄酮、胡萝卜素等微量营养成分[13],能够防治动脉粥样硬化[14]、具有抗氧化[15]等功效。
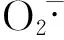
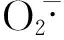
1 材料与方法
1.1 材料与试剂
1.1.1 材料
试验用核桃油(冷榨法,无任何添加剂)取自陕西海源生态农业有限公司,在试验前进行密封贮藏,防止其氧化变质。
1.1.2 试剂
1,1-二苯基-2-苦肼基DPPH,Sigma公司;维生素C,邻苯三酚,三羟甲基氨基甲浣(Tris),水杨酸,硫酸亚铁,氢氧化钠,98%浓硫酸,双氧水,盐酸,无水乙醇,试验用水为蒸馏水。
1.2 仪器与设备
EL-204型电子天平,梅特勒-托利多仪器上海有限公司;720紫外分光光度计,上海美谱达仪器有限公司;TDL-5低速离心机,赛默飞世尔科技公司;恒温水浴锅,太仓市试验设备厂;pH计。
1.3 核桃油抗氧化能力的测定
1.3.1 核桃油清除DPPH·自由基能力试验
DPPH·溶于乙酸乙酯中呈现出紫色,在波长515 nm处有最大吸收值,并且浓度和吸光度为线性关系,物质的抗氧化能力可以由物质对DPPH·的清除能力来表示。主要通过紫外分光光度法进行测定。
(1)称取0.000 39 g DPPH,用乙酸乙酯定容至100 mL,得到浓度为1×10-4mol/L的DPPH溶液,低温放置,待用;
(2)在10 mL的试管中分别加入含2 mL未氧化核桃油、氧化10 d核桃油、氧化20 d核桃油、氧化30 d核桃油、VC的乙酸乙酯溶液,浓度分别对应为0.03 g/mL、0.06 g/mL、0.09 g/mL、 0.12 g/mL、0.15 g/mL。之后再依次加入DPPH反应液4 mL,摇匀,放置暗处反应30 min,反应结束后,在515 nm波长处测定吸光度值;
(3)对照组为2 mL样品加入4 mL乙酸乙酯溶液;空白组为2 mL乙酸乙酯溶液加入4 mLDPPH反应液。以乙酸乙酯溶液作为参比,测定其吸光度,记录下吸光度值,由此计算DPPH.的清除率。
注:Ai—2 mL样品溶液+4mLDPPH溶液测定的吸光度值。
Ai0—2 mL样品溶液+4mL乙酸乙酯溶液测定的吸光度值。
A0—2 mL乙酸乙酯+4mLDPPH溶液测定的吸光度值。
1.3.2 核桃油清除羟基自由基能力试验
Fenton反应是用二价铁离子作为催化体系,用双氧水作为氧化剂的氧化反应体系,在化学反应过程中可以产生羟基自由基,依据对水杨酸-乙醇反应体系的氧化情况,确定待测样品能否对羟基自由基产生清除效果。在化学反应过程中,二价铁离子被其氧化成三价铁离子可能发生混凝反应从而生成沉淀。
(1)制备硫酸亚铁溶液(6 mmol/L):准确称取0.083 4 g七水合硫酸亚铁用少量蒸馏水溶解,然后转移至50 mL 容量瓶中精确定容,获得6 mmol/L的硫酸亚铁溶液;
(2)制备水杨酸-乙醇体系(6 mmol/L):准确称取0.041 4 g水杨酸溶于少量无水乙醇中,然后用无水乙醇溶液准确定容为50 mL(100 mL),得到6 mmol/L水杨酸-乙醇体系;
(3)制备0.1%的双氧水溶液:用微量移液器准确量取含30%浓度双氧水溶液166.7 μL转移至50 mL容量瓶中,用蒸馏水定容至刻度,得到0.1%的双氧水溶液。
在10 mL的试管中分别加入1 mL 6mmol/L的水杨酸-乙醇溶液和1 mL 6mmol/L硫酸亚铁溶液,之后分别加入1mL的样品溶液(用无水乙醇定容),浓度分别为0.03 、0.06、0.09、 0.12、0.15 g/mL,最后加入0.8 mL双氧水溶液,使反应开始,摇匀,将其放置于37 °C水浴锅中反应30 min,水浴反应完毕之后在3500 r/min速度下离心10 min,然后取上清液在510 nm波长处测定其吸光度值,以无水乙醇取代双氧水作为对照组,以无水乙醇取代样品溶液作为空白组。
注:Ai—为样品的吸光度值。
Ai0—以无水乙醇代替双氧水对照组的吸光度值。
A0—以无水乙醇代替样品空白的吸光度值。
1.3.3 核桃油清除超氧阴离子自由基能力试验
邻苯三酚在弱碱性环境下(Tris-HCl溶液提供)能够使自身发生氧化分解反应,生成超氧阴离子自由基。在反应进行过程中,超氧阴离子自由基不断地增多,在这一过程中生成带有颜色的中间产物,从而使反应溶液在波长420 nm下吸光度值在一段时间内随时间变化而成线性增长关系。所以,在这一时间段内,吸光度的变化能够反应样品对超氧阴离子自由基的抑制能力。
(1)制备邻苯三酚溶液(30 mmol/L):准确称取0.189 2 g邻苯三酚,用10 mmol/L的盐酸溶液溶解,定容于50 mL容量瓶中,此溶液需临场配制;
(2)制备10 mmol/L HCl:加0.86 m L的浓盐酸至1 000 mL的水中。
(3)Tris-HCl溶液(pH=8.2):配制1L 0.05 M(50 mmol/L)Tris-HCl溶液,称量7.88 g Tris-HCl置于1 L烧杯中,加入约800 mL左右的去离子水,用玻璃棒充分搅拌溶解后加入浓盐酸调节至所需要的pH值,然后将溶液定容至1 L,经高温高压灭菌后,在室温下保存。
(4)制备样品溶液(1.0 mg/mL):分别称取0.025 g未氧化核桃油、氧化10 d核桃油、氧化20 d核桃油、氧化30 d核桃油、维生素C用无水乙醇定容至25 mL容量瓶中,得到1.0 mg/mL的样品乙醇溶液和维生素C溶液。
具体实验方法:分别称取样品未氧化核桃油、氧化10 d核桃油、氧化20 d核桃油、氧化30 d核桃油乙醇溶液、维生素C溶液(1.0 mg/mL)1.0mL,放置于10 mL试管中,之后加入pH为8.2的Tris-HCl溶液5.0 mL,邻苯三酚溶液50 μL,迅速混匀,以蒸馏水为空白每30 s测定波长420 nm处的吸光度值。
注:Ai—(1 mL样品溶液+5 mLTris-HCl溶液+50 μL邻苯三酚溶液)的吸光值
A0—(1 mL蒸馏水+5 mLTris-HCl溶液+50 μL邻苯三酚溶液)的吸光值
2 结果与分析
2.1 核桃油清除DPPH·自由基能力的研究
不同氧化天数的核桃油(Walnut Oil,下表中简称WO)样品对DPPH·的清除能力如图1所示:
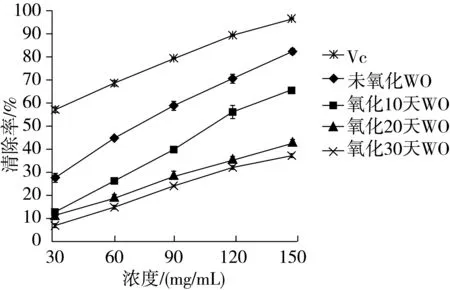
图1 不同氧化天数的核桃油对DPPH·的清除率
表1 不同氧化天数核桃油对DPPH·抑制的回归曲线
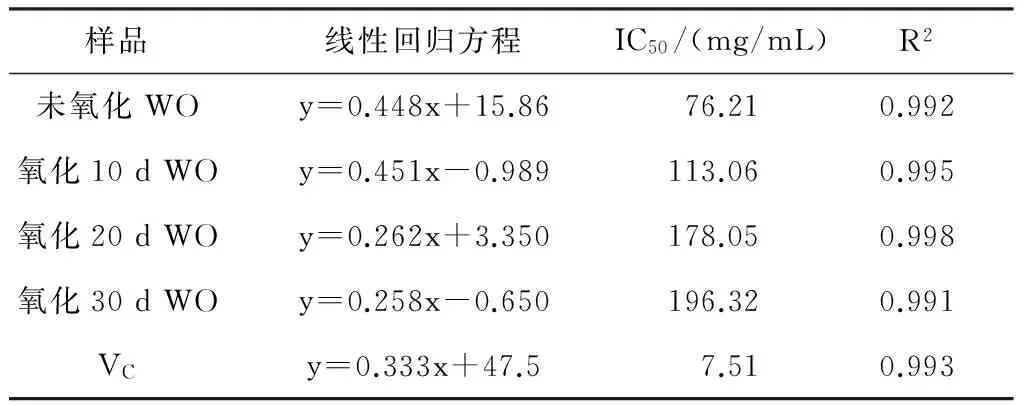
样品线性回归方程IC50/(mg/mL)R2未氧化WOy=0.448x+15.8676.210.992氧化10dWOy=0.451x-0.989113.060.995氧化20dWOy=0.262x+3.350178.050.998氧化30dWOy=0.258x-0.650196.320.991VCy=0.333x+47.57.510.993
经比较发现,随着浓度水平的增加,不同氧化天数的核桃油对DPPH·的抑制率也随之增加,并且氧化时间越短,核桃油的清除效果越好,76.21mg/mL质量浓度未氧化核桃油清除DPPH·自由基的能力为50%,相当于7.51 mg/mL质量浓度 VC对DPPH·清除自由基的能力,相当于113.06 mg/mL质量浓度氧化10 d核桃油清除DPPH·的能力,相当于178.05 mg/mL质量浓度氧化20 d核桃油清除DPPH·的能力,相当于196.32 mg/mL质量浓度氧化30 d核桃油清除DPPH·的能力。此结论与孟阿会[17]的结果相一致,这可能是由于随着氧化时间的增长,核桃油中的天然抗氧化成分如黄酮、生育酚等的含量也急剧降低,核桃油的抗氧化能力也逐渐减弱,清除DPPH·的能力也逐渐减低[20]。
2.2 核桃油清除羟基自由基能力的研究
不同氧化天数的核桃油样品对·OH的清除能力如图2所示:
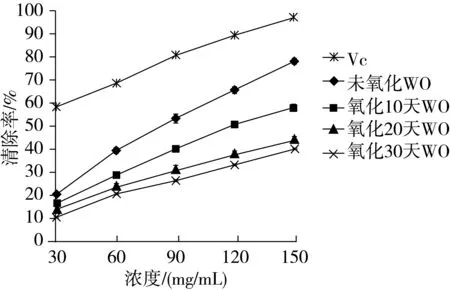
图2 氧化不同天数核桃油对·OH的清除率
表2 不同氧化天数核桃油对·OH抑制的回归曲线
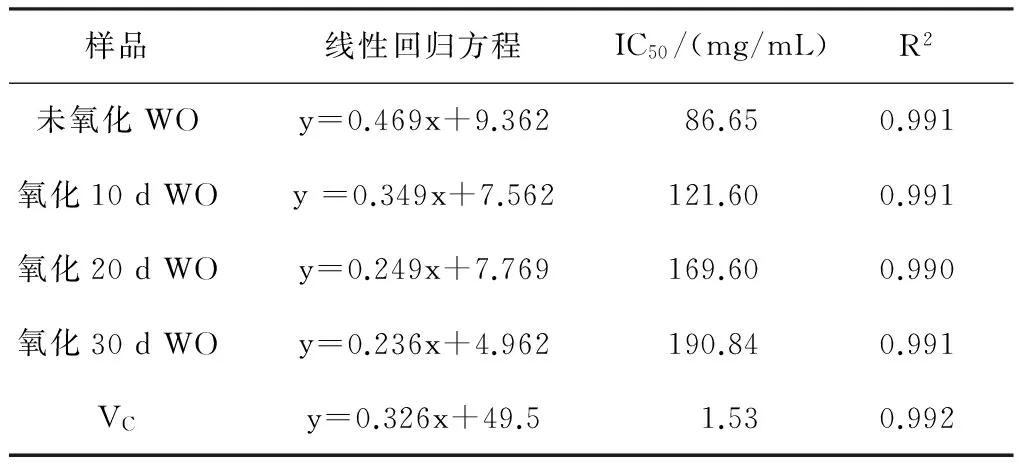
样品线性回归方程IC50/(mg/mL)R2未氧化WOy=0.469x+9.36286.650.991氧化10dWOy=0.349x+7.562121.600.991氧化20dWOy=0.249x+7.769169.600.990氧化30dWOy=0.236x+4.962190.840.991VCy=0.326x+49.51.530.992
经比较发现,86.65 mg/mL质量浓度未氧化核桃油清除·OH自由基的能力为50%,相当于1.53 mg/mL质量浓度 VC对OH·清除自由基的能力,相当于121.60 mg/mL质量浓度氧化10 d核桃油对·OH清除自由基的能力,相当于169.60 mg/mL质量浓度氧化20 d核桃油清除·OH的能力,相当于190.84 mg/mL质量浓度氧化30 d核桃油清除·OH的能力。随着浓度水平的增加,不同氧化天数核桃油对·OH的抑制率增加,并且氧化时间越短,核桃油的清除效果越好。这可能是由于随着氧化时间的增长,核桃油中的天然抗氧化成分如植物甾醇等的含量也急剧降低,核桃油的抗氧化能力也逐渐减弱[21]。
2.3 核桃油清除超氧阴离子自由基能力的研究
不同氧化天数的核桃油样品及维生素C对超氧阴离子自由基的清除能力如图3所示:
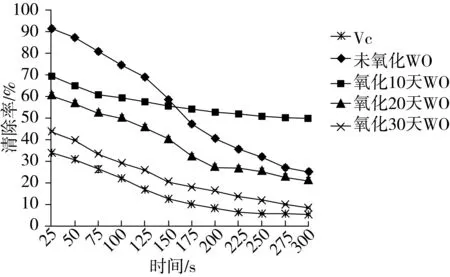

图3 核桃油对超氧阴离子的清除率
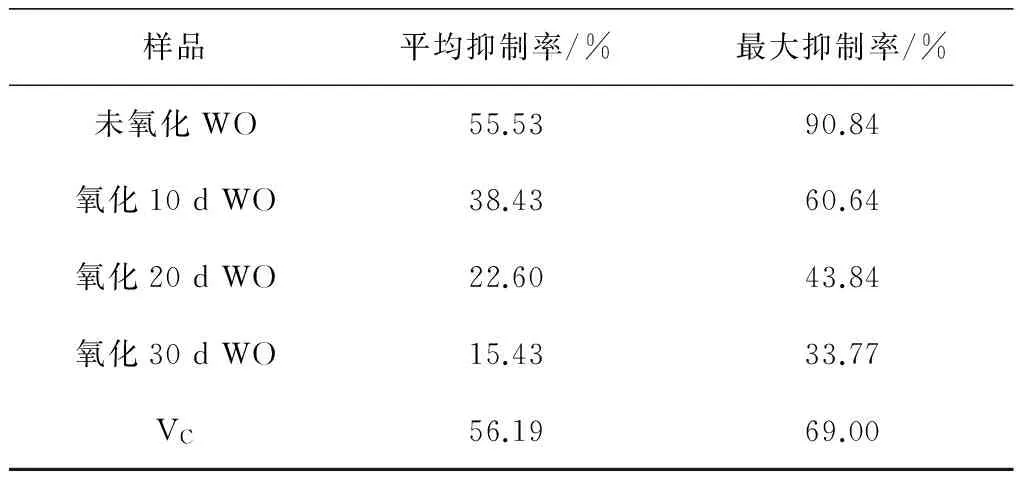
样品平均抑制率/%最大抑制率/%未氧化WO55.5390.84氧化10dWO38.4360.64氧化20dWO22.6043.84氧化30dWO15.4333.77VC56.1969.00
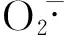
3 结论
[1]李时珍(明).本草纲目(下册)[M].北京:人民卫生出版社,1982:1084.
[2]李敏,刘媛,孙翠,等.核桃营养价值研究进展[J].中国粮油学报,2009(6):166-170.
[3]王利华.核桃的营养保健功能及加工利用[J]. 中国食物与营养,2007(8):28-30.
[4]李仁敏.核桃营养及药用研究进展[J].农产品加工,2004(12):26-27.
[5]郗荣庭,张毅萍.中国果树志:核桃卷[M].北京:中国林业出版社,1996.
[6]陆浩,杨会芳,毕艳兰,等.山核桃油的理化性质及脂肪酸组成分析[J].中国油脂,2010,35(5):73-76.
[7]王顺民,郑丹,汤斌,等.山核桃油中的脂肪酸GC法分析[J].中国调味品,2009,34(1):106-108+117.
[8]Zibaeenezhad,M.J.,Rezaiezadeh,M.,Mowla,A.,Ayatollahi,S.M.T.,Panjehshahin,M.R.Antihypertriglyceridemic effect of walnut oil[J].Angiology,2003.54(4):411-414.
[9]Willis L. Dose-dependent effects of walnuts on motor and cognitive function in aged rats[J]. Brit J Nutr, 2009,101(8):1140-1144.
[10]Griel A. An increase in dietary n-3 fatty acids decreases a marker of bone resorption in humans[J]. J Nutr, 2007 (6):2.
[11]余旭亚,王洪钟,郑桂兰,等.核桃油总黄酮含量的测定[J].中国油脂,2002,27(1):59-60.
[12]余旭亚,陈朝银,王洪钟,等.核桃仁与核桃油总黄酮含量比较研究[J].食品研究与开发,2002,23(6):25-26.
[13]赵声兰,陈朝银,葛锋,等.核桃油功效成分研究进展[J].云南中医学院学报,2010,33(6):71-74.
[14]陈丹,赵声兰. 核桃油保健及药用功效研究[J].亚太传统医药,2009,5(1):27-29.
[15]张清安,李建科,李泽珍.核桃油对小鼠肝脏与脑组织的抗氧化作用[J].营养学报,2004,26(5):408-409.
[16]韩军歧,张有林,陈双平,等.葵花籽油的超声波提取及抗氧化研究[J].食品工业科技,2005,26(1):52-541.
[17]孟阿会.核桃油成分及抗氧化性质研究[D].北京林业大学,2012.
[18]周凤娟,苏朋,孔翠萍,等.核桃油体外清除自由基活性的研究[J].中国油脂,2007(7):32-33.
[19]张丽,宋丽军,曹静洁等.新疆薄皮核桃油氧化稳定性的研究[J].农业机械,2012(12):41-45.
[20]孙丽萍,王大仟,张智武.11种天然植物提取物对DPPH自由基的清除作用[J].食品科学,2009(1):45-47.
[21]赵红红,李波,李万林,等.微波辅助提取菜籽油中植物甾醇及其清除羟基自由基研究油脂加工[J].2014,22(5):20-24.●

