消癌平联合X射线照射对人肝癌HepG2细胞增殖和凋亡的影响
王剑锋,方 芳,于 雷,王志成
(1.吉林大学中日联谊医院放疗科,吉林 长春 130033;2.吉林大学公共卫生学院营养与食品卫生学教研室,吉林 长春 130021;3. 吉林大学第二医院放疗科,吉林 长春 130041;4.吉林大学公共卫生学院 卫生部放射生物学重点实验室,吉林 长春 130021)
肝细胞癌是我国常见的恶性肿瘤,放射治疗(放疗)是原发性肝癌的重要治疗手段[1]。放疗常与手术、介入栓塞化疗、分子靶向药物和化疗药物联合应用,以提高治疗效果[2-4]。抗肝细胞癌药物消癌平(XAP)注射液的有效成分是中药材通关藤提取物,是萝摩科牛奶菜属植物通关散的藤茎,具有清热解毒、化痰软坚的作用,临床上用于食道癌、肺癌和肝癌的治疗[5]。XAP可以抑制肿瘤细胞生长,诱导周期阻滞并促进细胞凋亡,肝癌细胞在受射线照射后可出现G2期阻滞,但两者联合应用对肝细胞癌作用机制方面的研究少有报道。本研究旨在将XAP与X射线联合应用,探讨其协同增强对肝癌细胞的杀伤效应,为肝细胞癌的治疗提供新的思路。
1 材料与方法
1.1 细胞株及主要试剂人肝癌HepG2细胞由吉林大学公共卫生学院卫生部放射生物学重点实验室保存。培养血清及高糖DMEM培养基(江苏恩莫阿塞生物技术有限公司),AnnexinⅤ/FITC凋亡检测试剂盒(南京凯基生物科技发展有限公司),碘化丙啶(propidium iodide,PI,美国Sigma公司),CCK8试剂盒(Cell Counting Kit-8,日本Dojindo公司),GAPDH和caspase-3多克隆抗体(美国Santa Cruz公司),XAP注射液(南京圣合药业有限公司,国药准字:Z20025868,每支20 mL,含有效成分通关藤25 g),其他试剂均为国产分析纯。
1.2 实验分组及细胞处理实验分为对照组、XAP组、2 Gy照射组和XAP + 2 Gy照射组。HepG2细胞培养于含有10%胎牛血清及青、链霉素的高糖DMEM中,于37℃、5% CO2条件下培养。根据参考文献[6],XAP注射液在终浓度>50 mg·L-1的情况下具有明显的效应,所以本实验采用的终浓度为75 mg·L-1。按照实验分组分别将生长状态良好的HepG2细胞按照一定的浓度接种于96孔、24孔和6孔板,分别检测细胞增殖活性、细胞周期进程和细胞凋亡率以及细胞凋亡蛋白caspase-3的表达。X射线照射采用X-RAD320生物辐照仪(美国PXI公司),照射条件:电压180 kV,电流12.0 mA,靶皮距70 cm,剂量率 1.0 Gy·min-1,总剂量为2 Gy。
1.3 CCK8试剂盒检测细胞增殖活性HepG2细胞按照5 × 104个细胞/孔接种于96孔板,24 h后按照终浓度为75 mg·L-1加入XAP注射液预处理细胞,12 h后进行2 Gy X射线照射,计为0 h,分别于12、24和48 h后每孔加入10 μL CCK-8 试剂,继续培养1 h,轻轻震荡后在490 nm 处酶标仪检测各孔吸光度[A(490)]值,代表细胞增殖活性,实验设6复孔。
1.4 流式细胞术检测细胞周期HepG2细胞按照4 × 105个细胞/孔接种24孔板,24 h后按照终浓度为75 mg·L-1加入XAP注射液预处理细胞,12 h后进行2 Gy X射线照射,24 h后收集细胞,1 mol·L-1PBS洗2次,每管中加入200 μL的PI和100 μL RNaseA,轻微震荡混匀,室温条件避光20 min,上机收细胞,CellQuest软件收集,ModFit软件分析数据,结果以各期细胞百分率表示。
1.5 流式细胞术检测细胞凋亡率HepG2细胞接种、加药和照射处理同1.4,24 h后收集细胞,1 mol·L-1的PBS洗2次,每个管中加入5 μL PI和5 μL Annexin Ⅴ-FITC试剂,混匀后避光10 min,上机收集细胞,CellQuest软件收集,ModFit软件分析数据,结果以凋亡细胞百分率表示。
1.6 Western blotting法检测caspase-3蛋白表达HepG2细胞按照2 × 105个细胞/孔接种6孔板,24 h后按照终浓度为75 mg·L-1加入XAP注射液预处理细胞,12 h后行2 Gy X射线照射,24 h后收集细胞,利用RIPA裂解液裂解细胞,总蛋白提取后进行定量,按照25 μg蛋白上样进行SDS-PAGE电泳,将蛋白转到硝酸纤维膜后,利用TBST配置的5%脱脂奶粉进行封闭1 h,4℃过夜GAPDH和caspase-3一抗孵育。含有0.05% Tween 20的TBST洗3次,每次5 min,辣根过氧化物酶标记的二抗37℃下孵育1 h,TBST洗3次,利用化学发光试剂ECL进行显像,并进行拍照分析。
2 结 果
2.1 各组细胞增殖活性HepG2细胞经XAP处理和2 Gy照射后,在12、24和48 h时,与对照组比较,XAP组、2 Gy照射组和XAP + 2 Gy照射组细胞增殖活性明显降低(P<0.05或P<0.01),且XAP + 2 Gy照射组细胞增殖活性较XAP组和2 Gy照射组明显降低(P<0.05或P<0.01)。见表1。
表1 各组HepG2细胞的增殖活性
Tab.1 Proliferation activities of HepG2 cells in various groups

表1 各组HepG2细胞的增殖活性
GroupA(490)value(t/h) 122448Control0.41±0.020.58±0.020.68±0.05XAP0.31±0.02∗0.23±0.02∗∗0.28±0.04∗∗2Gyradiation0.28±0.02∗0.35±0.01∗∗#0.29±0.02∗∗XAP+2Gyradiation0.15±0.01∗∗△#0.08±0.01∗∗△#0.11±0.01∗∗△#
*P<0.05,**P<0.01vscontrol group;△P<0.01vs2 Gy radiation group;#P<0.01vsXAP group.
2.2 各组细胞不同周期细胞百分率HepG2细胞经XAP处理和2 Gy照射后24 h,与对照组比较,XAP组、2 Gy照射组和XAP+2 Gy照射组S期和G2/M期细胞百分率明显增加(P<0.05或P<0.01),G0/G1期细胞百分率明显降低(P<0.01),其中2 Gy照射组及XAP + 2 Gy照射组S期和G2/M期细胞百分率较XAP组均明显增加(P<0.01);与XAP组和2 Gy照射组比较,XAP+2 Gy组G0/G1期细胞百分率明显降低(P<0.05 或P<0.01),G2/M期细胞百分率增加(P<0.05或P<0.01)。见表2。
表2 各组HepG2细胞不同周期细胞百分率
Tab.2 Percentages of HepG2 cells at different phases in various groups

表2 各组HepG2细胞不同周期细胞百分率
GroupPercentageofcellsG0/G1SG2/MControl55.20±2.1142.89±1.531.90±0.77XAP48.05±1.13∗∗44.34±1.23∗7.61±2.35∗∗2Gyradiation26.66±0.95∗∗#58.57±0.69∗∗#14.77±1.61∗∗#XAP+2Gyradiation20.28±1.53∗∗△#60.70±2.12∗∗#18.95±0.84∗∗△#
*P<0.05,**P<0.01vscontrol group;△P<0.05vs2 Gy radiation group;#P<0.01vsXAP group.
2.3 各组细胞凋亡率HepG2细胞经XAP处理和2 Gy照射后24 h,流式细胞术检测细胞凋亡百分率,对照组、XAP组、2 Gy照射组和XAP+2 Gy照射组细胞凋亡率分别为(5.78±0.71)%、(14.02±1.05)%、(15.95±0.24)%和(30.53±2.67)%,XAP组、2 Gy组和XAP+2 Gy组细胞凋亡百分率均较对照组明显升高(P<0.05或P<0.01);与XAP组和2 Gy照射组比较,XAP+2 Gy照射组细胞凋亡率明显升高(P<0.01)。见图1。
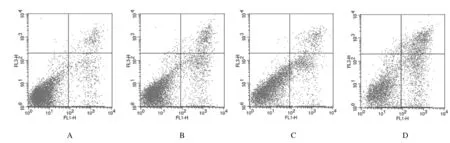
A:Control group; B:XAP group; C:2 Gy radiation group; D:XAP+2 Gy radiation group.
2.4 各组 HepG2细胞caspase-3蛋白表达HepG2细胞经XAP处理和2 Gy照射后24 h,Western blotting法检测凋亡蛋白caspase-3的断裂,可见caspase-3蛋白被切割成相对分子质量为17 000和19 000的片段,与对照组比较,XAP组、2 Gy照射组和XAP+2 Gy照射组相对分子质量为17 000和19 000的caspase-3片段表达均增加,提示其细胞凋亡增加。见图2。
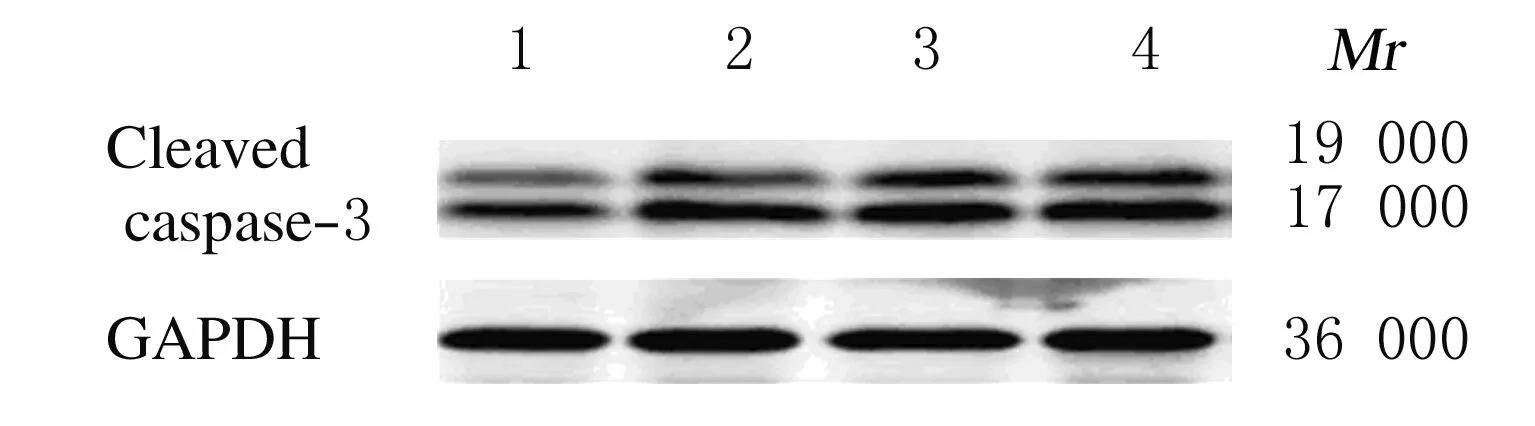
Lane 1:Control group; Lane 2:XAP group; Lane 3:2 Gy radiation group; Lane 4:XAP+2 Gy radiation group.
3 讨 论
美国国家综合癌症网络(NCCN)肝癌诊治指南推荐:外照射放疗可作为不能手术的原发性肝癌患者的理想治疗手段,我国也在原发性肝癌诊疗规范中推荐了肝癌的放射治疗。曾昭冲[1]指出:肝癌放疗需要结合其他治疗手段。放疗与其他疗法的联合应用早有先例,能够明显提高肝癌的治疗效果,且减少正常组织的不良反应,这其中包括与增敏剂的联合、与分子靶向治疗联合、与基因治疗联合以及联合热疗等[7]。
本文作者前期研究[8-9]结果显示:电离辐射可以诱导MCF-7细胞G2/M期阻滞,进而导致细胞凋亡的增加。在本研究中,2 Gy照射后,肝癌细胞HepG2增殖被抑制,细胞周期阻滞于G2/M期,且细胞凋亡率较对照组明显升高,说明X射线照射针对肝癌细胞也具有相似的作用。XAP以通关藤为原料,利用现代提取技术提取获得,临床主要应用于抗癌、消炎和平喘,主要用于食道癌、胃癌、肺癌、大肠癌、宫颈癌和白血病等多种恶性肿瘤的治疗,发挥作用的主要机制是诱导细胞凋亡和提高机体免疫力等[10-11]。有研究[12]表明:XAP联合化疗药物顺铂能明显增强其对高转移人卵巢癌HO-8910PM细胞的抑制作用,且能促进细胞凋亡,诱导G0/G1期细胞阻滞,降低侵袭能力。本研究结果显示:XAP对人肝癌HepG2细胞有明显的增殖抑制作用,且与X射线对肝癌HepG2细胞的抑制作用相似,二者联合时效果更明显;但与以往研究不同的是:XAP对HepG2细胞具有诱导G2/M期阻滞,与郑爱文等[12]的结果略有不同,而与赵和平等[13]的研究结果相似。
针对于XAP和X射线照射均具有凋亡促进作用、且以诱导肿瘤细胞凋亡为目的的治疗方案已成为肿瘤研究领域的一个热点[14]。本研究通过流式细胞术检测细胞凋亡的变化,同时利用Western blotting法检测凋亡效应蛋白caspase-3断裂的情况,结果显示:XAP和X射线照射均可诱导HepG2细胞凋亡,二者联合能够使诱导能力大大加强;同时,caspase-3被切割成相对分子质量为17 000和19 000的片段,也证明了二者联合的凋亡诱导作用。
综上所述,XAP与X射线照射联合作用于人肝癌HepG2细胞,具有明显的细胞增殖抑制、细胞周期阻滞和凋亡诱导作用,且二者联合应用可产生协同效应。但其是否涉及到其他机制,如何发挥协同作用,对动物实验是否具有相似的结果等问题,仍需进一步探讨。本研究结果为临床上肝癌的放射治疗提供了新的思路和实验数据。
[1] 曾昭冲. 原发性肝癌放射治疗现状及前景 [J].中国实用外科杂志,2014,34(8):699-702.
[2] Wang WH,Wang Z,Wu JX,et al.Survival benefit with IMRT following narrow-margin hepatectomy in patients with hepatocellular carcinoma close to major vessels [J].Liver Int,2015,35(12):2603-2610.
[3] Chen SW,Lin LC,Kuo YC,et al.Phase 2 study of combined sorafenib and radiation therapy in patients with advanced hepatocellular carcinoma [J].Int J Radiat Oncol Biol Phys,2014,88(5):1041-1047.
[4] Yoon HI,Song KJ,Lee IJ,et al.Clinical benefit of hepatic arterial infusion concurrent chemoradiotherapy in locally advanced hepatocellular carcinoma:a propensity score matching analysis [J].Cancer Res Treat,2016,48(1):190-197.
[5] Yao S,To KK,Wang YZ,et al.Polyoxypregnane steroids from the stems of Marsdenia tenacissima [J].J Nat Prod,2014,77(9):2044-2053.
[6] 方奕奇.消癌平注射液体外作用于HEL细胞株的实验研究 [D].南京:南京中医药大学,2010.
[7] 马晓洁,宋明洋,谭榜宪.原发性肝癌放疗联合其他治疗的新进展 [J].现代肿瘤医学,2015,23(1):139-141.
[8] Wang J,Li Y,Liu Y,et al.Overexpression of truncated AIF regulated by Egr1 promoter radiation-induced apoptosis on MCF-7 cells [J].Radiat Environ Biophys,2015,54(4):413-421.
[9] 王剑锋,方 芳,刘 扬,等.Egr1介导的人截短型凋亡诱导因子表达载体的构建及其在乳腺癌MCF-7细胞中的辐射诱导表达规律 [J].吉林大学学报:医学版,2012,38(3):521-526.
[10]Huang Z,Wang Y,Chen J,et al.Effect of Xiaoaiping injection on advanced hepatocellular carcinoma in patients [J].J Tradit Chin Med,2013,33(1):34-38.
[11]陶小鑫,于 浩,柏建岭.消癌平注射液联合化学治疗对非小细胞肺癌的临床疗效及安全性 Meta分析 [J].医药导报,2014,33(1):48-53.
[12]郑爱文,李 涛,陈雅卿,等.消癌平联合顺铂对高转移人卵巢癌HO-8910PM细胞的抑制作用 [J].中华肿瘤杂志,2016,38(1):11-16.
[13]赵和平,梁丽群.消癌平联合奥曲肽对对Hepa1-6细胞作用的实验研究 [J].中国药物与临床,2010,10(1):59-60.
[14]马安然,任宁宁,韩立博,等.基于医学数字X线影像频谱特征的图像检索[J].中国医学物理学杂志,2016,33(9):933-938.

