Gli1基因在胃癌组织中的表达及其对胃癌细胞生物学特性的影响
杨冬野,焦 洋,檀碧波,杜志坚,胡晓杰,刘 飞
(1.河北省人民医院普外四科,河北 石家庄 050051;2. 河北省人民医院消化二科,河北 石家庄 050051;3.河北医科大学第四医院外三科,河北 石家庄 050011)
虽然近几十年对胃癌的研究不断深入并取得了较多成就,但是目前胃癌的发病机制尚未阐明,胃癌诊治效果也没有取得突破性进展,因此寻找新的调控胃癌进展的基因对胃癌的综合诊治有重要意义。研究[1-5]表明:胶质瘤相关癌基因1(glioma-associated oncogene 1,Gil1)作为肿瘤发生、发展和侵袭的重要相关因素,近年来也被证实在多种人类肿瘤发生发展中发挥关键作用,如非小细胞肺癌和基底细胞癌等。有研究[6]表明:特异性抑制Gli1表达能介导胃癌细胞凋亡。目前关于Gli1在胃癌的发生发展过程中的作用及机制还缺少深入的实验研究。RNA 干扰(RNA interference,RNAi)进行特异性基因表达抑制的核酸操作技术,现已成为研究肿瘤基因治疗的有力工具[7]。因此,本研究对Gli1在胃癌组织中的表达进行探讨,并利用RNA 干扰技术以Gli1基因为靶点,研究Gli1对胃癌细胞生物学特性的影响及机制,为阐明胃癌进展机制提供实验依据。
1 资料与方法
1.1 一般资料选取2015年8月—2016年12月于河北省人民医院普通外科及河北医科大学第四医院普通外科手术切除、病理证实的胃癌患者95例,其中男性47例,女性48例,中位年龄66岁,分别选取胃癌组织和癌旁组织(距肿瘤边缘≥3 cm、镜检未见癌细胞),标本于术中离体后分为2份,一份于液氮速冻,并转入-80℃冻存;另一份于中性甲醛中固定。人胃癌细胞株MKN28、SGC7901、BGC823和胃上皮细胞株GES-1购自中科院上海细胞研究所。CCK-8(日本同仁公司),RPMI 1640培养液和胰蛋白酶(美国Gibco公司),Trizol试剂(美国Invitrogen公司),兔抗人Gli1、P27、MMP-2、MMP-9及β-actin多克隆抗体(美国Sigma公司),免疫组织化学试剂盒购自北京中杉公司。各基因的PCR引物由上海吉玛技术公司合成。
1.2 细胞培养人胃癌MKN28、SGC7901、BGC823细胞株和胃永生化上皮细胞株GES-1置于含10%胎牛血清的RPMI 1640培养液中,在含5% CO2、37℃条件下恒温孵育,2~3 d传代1次。细胞用含0.02% EDTA的0.25%胰蛋白酶溶液消化传代,实验时将生长至60%~70%融合的细胞消化后制成细胞悬液备用。
1.3 实时定量荧光PCR(RT-qPCR)法检测胃癌组织、癌旁组织和人胃癌细胞中Gli1 mRNA表达水平利用Trizol法提取胃癌组织、癌旁组织和胃癌细胞中的总RNA,检测提取的RNA的纯度。按照逆转录试剂盒说明将RNA反转录成cDNA,按照RT-qPCR试剂盒操作说明书进行目的基因的扩增。以GAPDH作为内参,根据Ct值按照2-△△Ct方法计算mRNA表达水平。每组实验重复3次,取平均值。
1.4 免疫组织化学法检测Gli1蛋白在胃癌组织中的表达采用免疫组织化学技术检测Gli1蛋白在胃癌组织和癌旁组织中的表达。严格按试剂盒说明书进行操作。Gli1蛋白以细胞质和/或细胞膜出现黄色或褐色颗粒为染色阳性,计算阳性表达率。
1.5 BGC823细胞转染后Gli1 mRNA表达水平检测将转染后的BGC823细胞分为正常培养的细胞(对照组)、转染NS-siRNA细胞(NS-siRNA组)和转染Gli1-siRNA细胞(Gli1-siRNA组),按照RT-qPCR试剂盒操作说明书检测各组细胞中Gli1 mRNA表达。每组设6个复孔。
1.6 CCK8法检测细胞增殖率细胞分组同上。各组细胞培养结束后弃去培养基,按CCK-8试剂盒说明书加入含有CCK-8的培养基(CCK-8溶液∶培养基=1∶10) 100 μL,37℃孵育1 h,酶标仪450 nm处测定各孔吸光度(A)值,计算细胞增殖率,细胞增殖率=(给药孔平均A值/ 对照孔平均A值)×100%。实验重复3次。
1.7 Transwell小室法检测细胞迁移能力细胞分组同上。消化各组细胞后,PBS清洗1或2次,含1%BSA无血清1640培养基调整BGC823细胞浓度为l×106mL-1,取BGC823细胞悬液200 μL加入Transwell小室的上室,常规培养24 h,取出小室,湿棉签擦除上室内的BGC823细胞,结晶紫染色后在显微镜下(×400)计数穿膜的BGC823细胞数目,以穿膜细胞数表示细胞迁移能力。
1.8 Western blotting法检测各组细胞中P27、MMP-2和MMP-9蛋白表达水平细胞分组同上。取1×107个细胞,加入细胞裂解液100 μL裂解。4℃、8 000 r·min-1离心10 min。Bradford法测定蛋白浓度。取40 μg蛋白样品,10%十二烷基硫酸钠(Sodiumdodecylsulfate,SDS) 聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分离,电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。5%脱脂奶粉室温封闭90 min,分别加入稀释的Gli1、P27、MMP-2和MMP-9一抗,4℃过夜。加入二抗,曝光、显影、定影。以蛋白条带的平均吸光度(A)值表示蛋白相对表达水平。
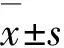
2 结 果
2.1 胃癌组织和癌旁组织中Gli1 mRNA表达水平和Gli1蛋白阳性表达率RT-qPCR法和免疫组织化学法检测95例胃癌组织和癌旁组织中Gli1基因的表达。胃癌组织中Gli1 mRNA表达水平(1.00±0.18)明显高于癌旁组织(0.43±0.09)(t=27.606,P<0.01);胃癌组织中Gli1蛋白阳性表达率(75.79%,72/95)明显高于癌旁组织(22.11%,21/95)(χ2=54.782,P<0.01)。见图1(插页三)。
2.2 不同细胞中Gli1 mRNA的表达水平以胃上皮细胞株GES-1为参照,采用RT-qPCR法检测Gli1 mRNA在胃癌细胞株MKN28、SGC7901和BGC823的表达水平。GES-1、MKN28、SGC7901和BGC823细胞中Gli1mRNA相对表达水平分别为1.00±0.09、2.17±0.23、3.32±0.39和5.57±0.62,多组间比较差异有统计学意义(F=86.341,P<0.01)。组间两两比较:GES-1与MKN28、GES-1与SGC7901、GES-1与BGC823、MKN28与SGC7901、MKN28与BGC823和SGC7901与BGC823比较差异均有统计学意义(P<0.01)。胃癌细胞株BGC823中Gli1 mRNA表达最高,故选择BGC823做后续研究。
2.3 转染后各组细胞中Gli1 mRNA表达水平3组细胞中Gli1 mRNA表达水平分别为:对照组100.00%±9.17%,con-siRNA组98.57%±9.53%,Gli1-siRNA组57.28%±6.06%,Gli1-siRNA组 Gli1 mRNA表达水平明显低于对照组和con-siRNA组(F=48.322,P<0.01)。
2.4 各组胃癌细胞增殖率转染后24 h,Gli1-siRNA组细胞增殖率(62.01%±6.31%)明显低于对照组(100.00%±7.97%)和con-siRNA组(88.75%±8.19%)(F=54.428,P<0.01)。
2.5 各组胃癌细胞迁移能力Gli1-siRNA组穿膜细胞数(63±7)低于对照组(155±15)和con-siRNA组(151±13)(F=257.788,P<0.01)。
2.6 各组胃癌细胞中P27、MMP-2和MMP-9蛋白表达水平Gli1-siRNA基因转染细胞后,采用Western blotting法检测各组细胞中P27、MMP-2和MMP-9蛋白表达水平。与对照组比较,con-siRNA组细胞中P27、MMP-2和MMP-9蛋白表达水平差异均无统计学意义(P>0.05);与con-siRNA组比较,Gli1-siRNA组P27蛋白表达水平明显升高(P<0.05),MMP-2和MMP-9蛋白表达水平明显降低(P<0.05)。见表1和图2。

表1 各组胃癌细胞中P27、MMP-2和MMP-9蛋白表达水平
*P<0.05 compared with con-siRNA group.

Lane 1:Control group;Lane 2:Con-siRNA group;Lane 3:Gli1-siRNA group.
3 讨 论
胃癌是我国常见的消化系统恶性肿瘤,治疗效果及预后均不理想,因此探索新的治疗方法已成为胃癌治疗亟待解决的问题。研究[8]表明:基因治疗在癌症病因治疗中发挥着重要作用。Hedgehog信号通路自1980年被发现以来,其作用逐渐被人们认识。作为来自内胚层的信号分子之一,Shh信号通路在胚胎发育、成熟器官形成及形态维持中扮演重要角色。近年来研究[9-10]显示:Sonic Hedgehog信号通路是参与多种肿瘤侵袭转移的重要信号通路之一。Gli1是Hedgehog信号通路的核心成员,发挥着通路功能调节作用[11]。研究[12]显示:Gli1在胃癌组织中高表达。但目前对Gli1基因是否影响胃癌细胞的迁移及其机制仍缺乏相关文献报道。
本研究对胃癌组织和癌旁组织中Gli1基因表达检测结果显示:Gli1基因在胃癌组织中表达上调,提示Gli1基因的异常激活可能参与胃癌的侵袭与转移过程。
本研究又进一步在细胞水平上利用Gli1-siRNA技术抑制Gli1后观察胃癌细胞的增殖和迁移及其可能机制,结果显示:与对照组和con-siRNA组比较,Gli1-siRNA组细胞活性受到明显抑制;Transwell小室法检测细胞迁移,Gli1-siRNA转染后胃癌细胞迁移数目明显减少。本研究结果表明:抑制细胞中Gli1基因表达可降低胃癌细胞增殖能力和迁移侵袭能力,因此Gli1基因可能成为胃癌潜在的治疗靶基因。
为进一步探讨Gli1基因对胃癌细胞的增殖和迁移作用的可能机制,根据文献报道P27蛋白参与调控肿瘤细胞的增殖,当P27蛋白表达增加时,其增殖受到抑制[13]。MMP在肿瘤细胞的侵袭和转移中发挥重要的作用,其中,对通路中某些节点(如MMP-2和MMP-9)研究成为目前的研究热点[14-17]。本研究检测了Gli1-siRNA转染后胃癌细胞中P27、MMP-2和MMP-9蛋白表达的变化,本研究结果显示:抑制细胞Gli1表达后,P27的蛋白表达水平上调,而MMP-2、MMP-9的蛋白表达水平下调,提示抑制Gli1后可通过调控迁移侵袭相关因子而发挥对胃癌细胞的抑制作用,但其具体的分子作用机制仍需进一步研究。
[1] Inaguma S,Riku M,Ito H,et al. GLI1 orchestrates CXCR4/CXCR7 signaling to enhance migration and metastasis of breast cancer cells[J]. Oncotarget,2015,6(32):33648-33657.
[2] Wahid M,Jawed A,Mandal RK,et al.Vismodegib,itraconazole and sonidegib as hedgehog pathway inhibitors and their relative competencies in the treatment of basal cell carcinomas[J].Crit Rev Oncol Hematol,2016,98:235-241.
[3] Athar M,Li C,Kim AL,et al.Sonic hedgehog signaling in Basal cell nevus syndrome[J].Cancer Res,2014,74(18):4967-4975.
[4] Bermudez O,Hennen E,Koch I,et al.Gli1 mediates lung cancer cell proliferation and Sonic Hedgehog-dependent mesenchymal cell activation[J].PLoS One,2013,8(5):e63226.
[5] Chen JS,Li HS,Huang JQ,et al.Down-regulation of Gli-1 inhibits hepatocellular carcinoma cell migration and invasion[J].Mol Cell Biochem,2014,393(1/2):283-291.
[6] 王 雷,杜媛鲲,米 源, 等. Gli抑制剂诱导胃癌细胞凋亡作用的研究[J]. 重庆医学,2016,45(29):4050-4052.
[7] Takei Y,Kadomatsu K,Yuzawa Y,et al.A small interfering RNA targeting vascular endothelial growth factor as cancer therapeutics [J].Cancer Res,2004,64(10):3365-3370.
[8] Lichtenstein P,Holm NV,Verkasalo PK,et al.Environmental and heritable factors in the causation of cancer:analyses of cohorts of twins from Sweden,Denmark,and Finland[J].Surv Ophthalmol,2000,45(2):167-175.
[9] Yoo YA,Kang MH,Kim JS,et al.Sonic hedgehog signaling promotes motility and invasiveness of gastric cancer cells through TGF-beta-mediated activation of the ALK5-Smad 3 pathway[J].Carcinogenesis,2008,29(3):480-490.
[10]梁新军,魏少忠.Shh信号通路阻断对人结肠癌细胞HT-29增殖、侵袭的影响及机制探讨[J].山东医药,2016,56(18):12-14.
[11]Fu J,Rodova M,Roy SK,et al.GANT-61 inhibits pancreatic cancer stem cell growth in vitro and in NOD/SCID/IL2R gamma null mice xenograft[J].Cancer Lett,2013,330(1):22-32.
[12]Abdel-Rahman O.Hedgehog pathway aberrations and gastric cancer; evaluation of prognostic impact and exploration of therapeutic potentials[J].Tumour Biol,2015,36(3):1367-1374.
[13]Dong LH,Wen JK,Miao SB,et al.Baicalin inhibits PDGF-BB-stimulated vascular smooth muscle cell proliferation through suppressing PDGFRβ-ERK signaling and increase in p27 accumulation and prevents injury-induced neointimal hyperplasia[J].Cell Res,2010,20(11):1252-1262.
[14]Xu H,Xu Y,Zhang W,et al.Aquaporin-3 positively regulates matrix metalloproteinases via PI3K/AKT signal pathway in human gastric carcinoma SGC7901 cells[J].J Exp Clin Cancer Res,2011,30:86.
[15]丁顺斌,王简勤,蔡明春,等.miR-630在胃癌组织中的表达变化及对胃癌细胞SGC-7901增殖、侵袭能力的影响[J].山东医药,2017,57(15):9-12.
[16]张志栋,李 勇,檀碧波,等.胃癌患者癌组织膜联蛋白A2的表达与血清膜联蛋白A2及癌胚抗原水平测定[J].郑州大学学报:医学版,2016,51(1):76-79.
[17]姜文静,张忠献,王尧河,等.腹水来源胃癌原代细胞的建立及鉴定[J].郑州大学学报:医学版,2016,51(4):498-502.

