柴胡皂苷D对骨肉瘤143B细胞增殖抑制作用研究
杨春艳,范文翔,欧学兰,袁斌
(川北医学院药物研究所·川北医学院药学院,四川南充637000)
骨肉瘤是儿童和青少年常见的骨恶性肿瘤,具有发病率高、转移早的特点。虽然目前采用联合化疗及手术综合治疗后患者的5年生存率提高到60%~70%,但仍有患者效果不佳,复发转移率仍达30%~40%[1]。可供选择的临床化疗药物有限,而且大多数都存在耐药性。柴胡是伞形科植物柴胡Bupleurum chinense DC.或狭叶柴胡Bupleurum scorzonerifolium Willd.的干燥根[2]。其最早收载于《神农本草经》,列为上品,味苦、辛,性微寒,归肝、胆经,具有退热解表、疏肝解郁、升举清气的功效,由柴胡组成的经典古方有数百首[3]。其主要化学成分和生物活性成分为柴胡皂苷(saikosaponins,SS)。柴胡皂苷属环氧醚型五环三萜类齐墩果烷型衍生物,对胃癌、肺癌、前列腺癌及肝癌具有抑制肿瘤增殖、诱导细胞凋亡等抗肿瘤作用[4-7],而柴胡皂苷应用于治疗骨肉瘤的研究报道极少。本研究中通过研究柴胡皂苷单体柴胡皂苷D(SS-d)对人骨肉瘤143B细胞增殖的影响,为柴胡皂苷单体今后用于骨肉瘤的临床治疗提供参考。
1 材料与方法
1.1 仪器与试药
仪器:荧光CKX41型倒置显微镜(日本Olympus公司);CO2细胞培养箱(美国Thermo公司);Spectramax 190型酶标仪(Molecular Devices公司);Micro17R型高速低温离心机(美国Thermo公司)。
细胞株及试药:143B细胞株(中桥新舟生物科技有限公司);柴胡皂苷D(中国科学院成都生物研究所);注射用盐酸多柔比星(海正辉瑞制药有限公司);DMEM培养基、胎牛血清(Hyclone公司);骨钙素(OCN)酶联免疫检测试剂盒、碱性磷酸酶(AKP)测试盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 主要试剂配置及分组
柴胡皂苷D浓度配置:取柴胡皂苷D 13 mg,分别加入166 μL二甲基亚砜(DMSO)溶解,充分混匀,制成终浓度为100 mmol/L的母药溶液,4℃保存备用,使用时加入DMEM培养基,将其稀释至相应浓度,备用。
分组:设置阴性对照组(A组,加入同体积培养液),阳性对照组(B组,加10 μg/mL多柔比星),药物组(C1,C2,C3,C4,C5,C6组,分别加6.25,12.50,25.00,50.00,100.00,200.00 μmol/L柴胡皂苷D)。
1.2.2 试验方法
细胞培养:143B细胞体外培养于含10%胎牛血清、100 U/L青霉素、100 μg/L链霉素的DMEM培养基中,置5%CO2及37℃条件下二氧化碳培养箱中培养。
MTT法测定细胞增殖活性:用培养基调整处于对数生长期的细胞悬液浓度为1×104个/mL,将处于对数生长期的143B细胞按1×105个/mL的密度接种在96孔培养板中,每孔100 μL;37℃培养24 h后加入柴胡皂苷D进行干预,分别设药物组(C1,C2,C3,C4,C5,C6组,柴胡皂苷D梯度浓度为6.25,12.5,25,50,100,200 μmol/L)和对照组(A组,不加药组),10 μg/mL多柔比星组(B组),每组设3个复孔,继续培养,并于6,12,24,48,72 h后用MTT法检测细胞增殖活性,绘制细胞增殖曲线。
143B细胞生长情况观察:在MTT试验中,加药前后分别用倒置相差显微镜观察不同浓度柴胡皂苷D(6.25,12.5,25,50,100,200 μmol/L)作用不同时间(6,12,24,48,72 h)后,各组培养孔内细胞生长的状况、形状、密度及凋亡的细胞等。
样本中AKP活力检测:将143B细胞以1×105个/mL密度接种于24孔板中,24 h后分别加入含不同药物、不同浓度柴胡皂苷D培养液继续培养,在6,12,24,48 h后吸取1 mL上清液置Ep管中,用离心机离心,吸取上清液保存。按AKP测试盒说明书进行操作,步骤见表1。轻轻振摇检测板,混匀孔板,在520 nm波长下用酶标仪检测各孔的光密度(OD)值。参照试剂说明书计算公式计算AKP活力。
样本中OCN表达检测:按上述操作培养143B细胞,加柴胡皂苷D(终浓度为50 μmol/L),在药物作用6,12,24,48 h后收集各孔中的培养液,以1 600 r/min的速率离心4 min,收集上清液,并封存于-80℃冰箱。参照骨钙素酶联免疫吸咐(ELISA)检测试剂盒说明,设置空白孔、标准品孔和检测样品孔,按清洗、显色、终止、检测步骤操作,依据标准品的浓度和OD值做标准曲线及其回归方程,计算样品的浓度。

表1 AKP活力检测步骤( L)
1.2.3 统计学处理
采用SPSS 19.0统计软件进行分析。计量资料用均数±标准差(表示,各组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 柴胡皂苷D对143B细胞增殖的抑制
柴胡皂苷D作用143B细胞6 h后,细胞活力显著降低,且随着浓度的增加其生存率逐渐降低,随着时间的增加其生存率有轻微下降。用药6,12,24,72 h后,除6.25 μmol/L浓度组以外,其他药物浓度组与对照组比较差异,均有统计学意义(P<0.05)。48 h后,所有药物浓度组间差距均有统计学意义(P<0.05)。24,48 h后,阳性对照药多柔比星也有明显抑制作用,与A组比较,差异有统计学意义(P<0.05)。48 h后的25 μmol/L浓度组与72 h后的50 μmol/L浓度组细胞活性最低。详见表2和图1。
2.2 柴胡皂苷D对143B细胞中AKP活力的影响
AKP是成骨分化的重要标志之一。由表3可见,柴胡皂苷D对AKP的表达并无明显影响,提示柴胡皂苷D对143B细胞的增殖抑制可能不是由促成骨分化作用造成的。而同一组药物随着时间的变化AKP活力改变也不明显,这可能与药物作用太强导致细胞在6 h时就大量死亡有关。
表2 柴胡皂苷D对143B细胞活力的影响(s,n=3)
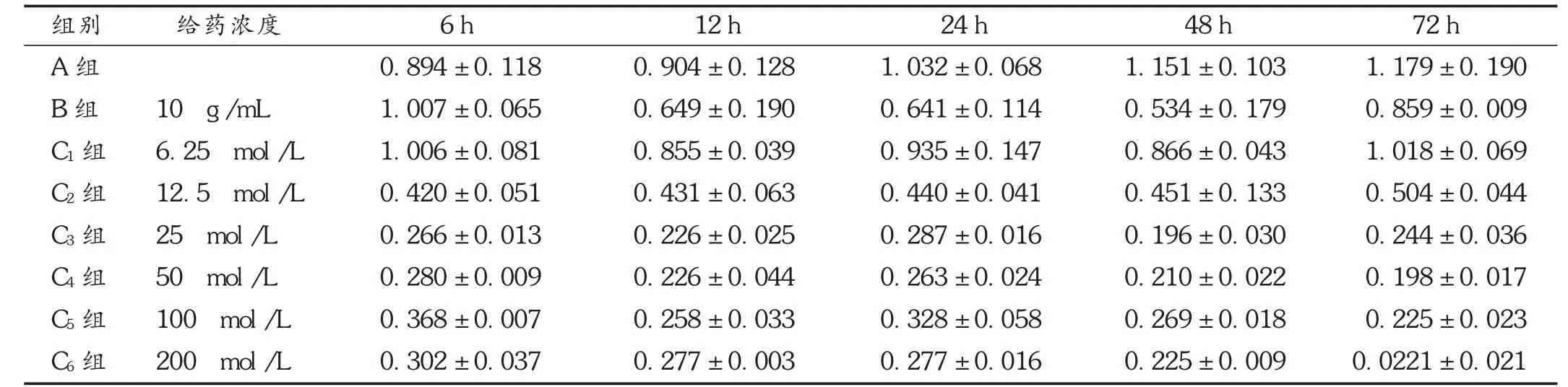
表2 柴胡皂苷D对143B细胞活力的影响(s,n=3)
注:与对照组相比, P<0.05。
?
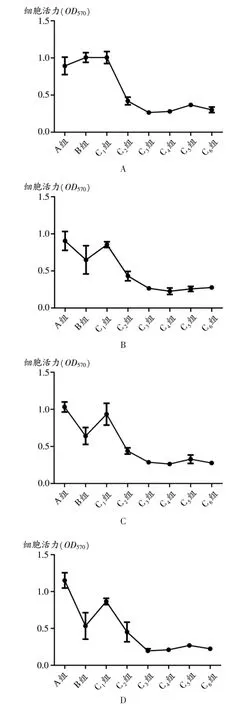
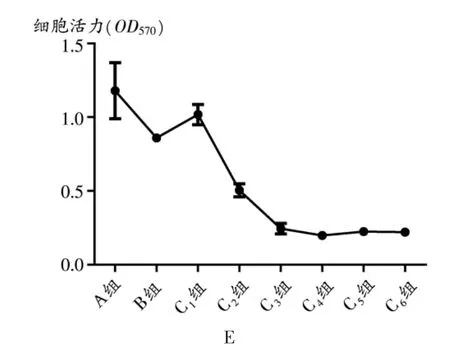
图1 柴胡皂苷D对143B细胞的抑制作用
2.3 柴胡皂苷D对143B细胞中OCN含量的影响
由表4可见,柴胡皂苷D作用于143B细胞后,人骨钙素含量均下降,50 μmol/L浓度的柴胡皂苷D作用24 h后人骨钙素含量最低,为(0.59±0.002)ng/mL(P<0.05)。同一药物组随着时间的变化人骨钙素含量差异较小,可能与细胞大量死亡有关。
2.4 柴胡皂苷D对143B细胞形态的影响
柴胡皂苷D作用于143B细胞后,随着作用时间的延长,浓度的增大,细胞体积明显变小,细胞核变小、固缩,全面皱缩,细胞膜破裂,由此可推断出,143B细胞的凋亡可能由柴胡皂苷D改变细胞膜的通透性而引起。详见图2。
3 讨论
近年来,国内外学者对柴胡皂苷的药理活性研究逐渐增多,已证实了柴胡皂苷在镇静、抗惊厥、解热、抗病毒、免疫调节、抗炎、保肝护肾,以及抗肿瘤等多方面具有良好的药理学作用[8]。研究还表明,柴胡皂苷D是活性最强的单体,其发挥抗肿瘤作用[9]可能与以下几种方式有关:免疫调节作用;抑制肿瘤细胞的分裂与生长;诱导细胞凋亡;抑制肿瘤转移;抑制环氧合酶。柴胡皂苷是柴胡的毒性成分,具有肝毒性,不同产地、不同炮制方法、不同提取方法都对其毒性有影响,这主要是因为其含量不一致造成的。相比于其他抗肿瘤药物的高毒性、耐药性,柴胡皂苷仍具有明显的优势。
表3 柴胡皂苷D对143B细胞AKP活力的影响(s,金氏单位/100 mL,n=3)

表3 柴胡皂苷D对143B细胞AKP活力的影响(s,金氏单位/100 mL,n=3)
注:与正常细胞组相比, P<0.05。
组别正常细胞组柴胡皂苷D(50 mol/L)组6 h 0.86±0.13 1.13±0.01 12 h 1.08±0.02 1.03±0.17 24 h 1.12±012 1.17±0.04 48 h 1.18±0.07 1.22±0.06
表4 柴胡皂苷D对143B细胞人OCN含量的影响[s,ng/mL,n=3]

表4 柴胡皂苷D对143B细胞人OCN含量的影响[s,ng/mL,n=3]
注:与正常细胞组相比, P<0.05。
组别正常细胞组柴胡皂苷D(50 mol/L)组6 h 0.99±0.03 0.73±0.71 12 h 1.34±0.08 0.61±0.08 24 h 1.23±0.001 0.59±0.002 48 h 1.20±0.07 0.66±0.21
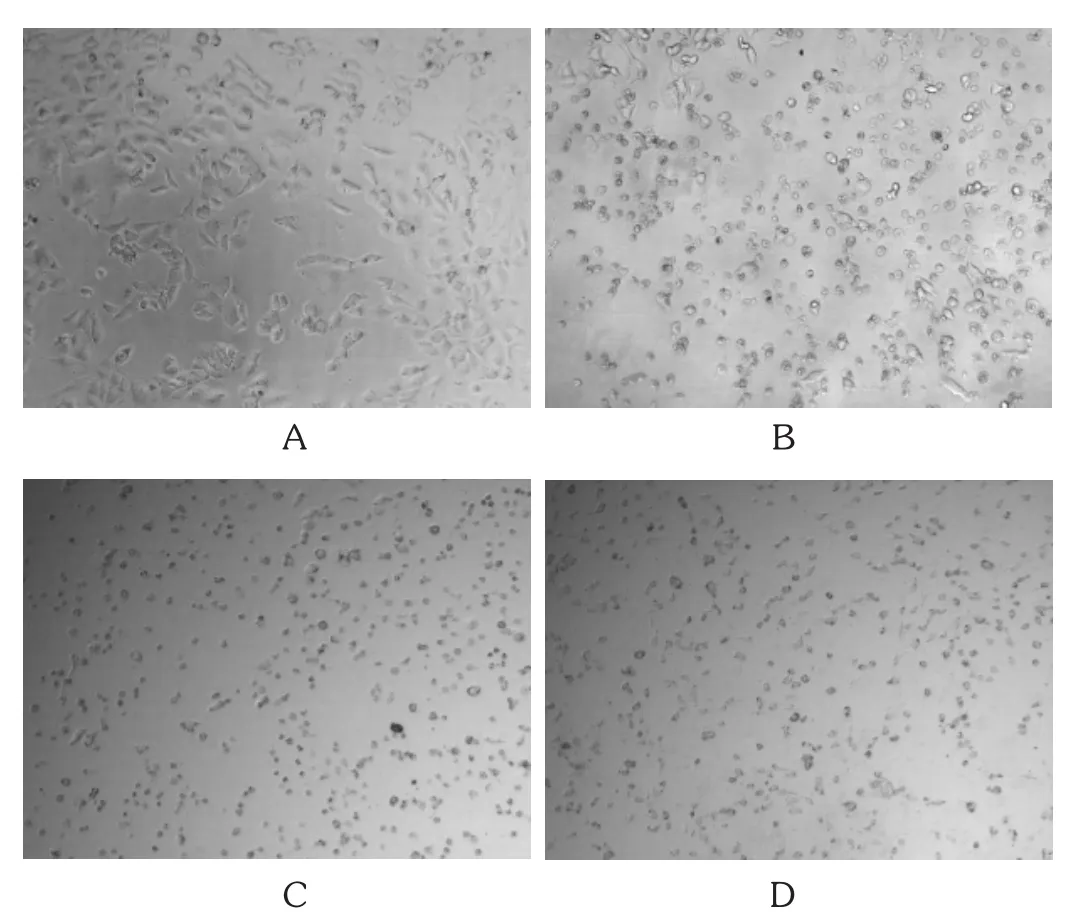
图2 加入柴胡皂苷D后的细胞形态变化
本研究中,采用不同浓度的柴胡皂苷D在体外作用于骨肉瘤143B细胞,通过MTT检测法发现柴胡皂苷D对细胞的生长抑制作用强,且呈一定的浓度相关性,但随着时间的变化,作用改变不太明显。显微镜下观察柴胡皂苷D引起细胞形态明显改变,细胞膜出现破裂。这可能与李涛等[10]通过体外研究发现柴胡皂苷D的肝毒性并非简单的诱导细胞凋亡,而是柴胡皂苷D诱导了细胞膜通透性的改变,从而导致细胞坏死这一结论有关。
皂苷类药物还具有较强的溶血作用,这可能与143B细胞快速凋亡有关。为了进一步探究其作用机制,采用流式细胞术检测细胞周期和细胞凋亡率,考察柴胡皂苷D是否有促凋亡作用及有影响细胞周期的作用,若不具有促凋亡作用,则可进一步进行乳酸脱氢酶释放率试验考察柴胡皂苷D对143B细胞膜的损伤作用。
试验结果显示,经柴胡皂苷D作用后AKP的活力变化较小,而人骨钙素的含量降低说明柴胡皂苷D抑制143B细胞增殖的机制可能与促分化作用关系不大,与肿瘤细胞的凋亡和基因的调控关系很大。已有研究表明,脂肪酸合成酶(FAS)在骨肉瘤组织中过表达,可以作为治疗骨肉瘤疾病的新靶位[11]。有许多体内和体外试验表明,FAS抑制剂能抑制肿瘤生长[12-14]。后续试验可以检测FAS基因的表达情况来验证其作用机制。有学者认为,bcl-2/bax的比值是促使肿瘤细胞凋亡的重要原因,其中bcl-2是抑制凋亡的基因,bax是促进凋亡的基因[15],可将其作为下一步考察的指标。
综上所述,虽然柴胡皂苷能显著抑制骨肉瘤细胞的增殖,但其主要作用机制还需要试验研究,其在体内的活性情况也有待研究。随着对皂苷抗癌作用研究的深入,有望在中医理论指导下,利用现代分子药理学及分子生物学提取筛选其有效成分,开发出新的抗肿瘤药物。
[1]柳剑.骨肉瘤患者化疗效果的综合评估[D].北京:北京大学,2008.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:263-264.
[3]黄伟,赵燕,孙蓉.基于柴胡皂苷类成分的保肝作用与肝毒性研究进展[J].中国药物警戒,2011,8(1):38-41.
[4]Fujioka T,Yoshida K,Fujii H,et al.Antiproliferative constituents from Umbelliferae plantsⅥ.New ursane-type saikosaponin analogs from the fruits of Bupleurum rotundifolium[J].Chemical&Pharmaceutical Bulletin,2003,51(4):365-372.
[5]Hsu YL,Kuo PL,Lin CC.The proliferative inhibition and apoptotic mechanism of Saikosaponin D in human non-small cell lung cancer A549 cells[J].Life Sciences,2004,75(10):1231.
[6]Zhong D,Zhang HJ,Jiang YD,et al.Saikosaponin-d:A potential chemotherapeutics in castration resistant prostate cancer by suppressing cancer metastases and cancer stem cell phenotypes[J].Biochemical&Biophysical Research Communications,2016,474(4):722.
[7]Jia X,Dang S,Cheng Y,et al.Effects of saikosaponin-d on syndecan-2,matrix metalloproteinases and tissue inhibitor of metalloproteinases-2 in rats with hepatocellular carcinoma[J].Journal of Traditional Chinese Medicine,2012,32(3):415-422.
[8]杨志刚,陈阿琴,孙红祥,等.柴胡皂苷药理作用研究进展[J].中国畜牧兽医文摘,2005,39(6):27-30.
[9]王艳丽,和水祥,罗金燕.柴胡皂苷抗肿瘤机制研究进展[J].结合医学学报,2006,4(1):98-100.
[10]李涛,江振洲,王涛,等.柴胡皂苷d对人肝细胞LO2体外毒性机制探讨[J].中国临床药理学与治疗学,2007,12(4):396-400.
[11]刘志礼,刘先明,罗,等.FAS在骨肉瘤组织中的表达研究[J].南昌大学学报医学版,2008,48(5):53-55.
[12]傅强,蔡文伟.抑制脂肪酸合成酶对大肠癌细胞生长的影响及其机制[J].胃肠病学,2002,7(4):202-205.
[13]Pizer ES,Thupari J,Han WF,et al.Malonyl-coenzyme-A is a potential mediator of cytotoxicity induced by fatty-acid synthase inhibition in human breast cancer cells and xenografts[J].Cancer Research,2000,60(2):213-218.
[14]Ho TS,Ho YP,Wong WY,et al.Fatty acid synthase inhibitors cerulenin and C75 retard growth and induce caspase-dependent apoptosis in human melanoma A-375 cells[J].Biomedicine&Pharmacotherapy,2007,61(9):578-587.
[15]Pettersson F,Dalgleish AG,Bissonnette RP,et al.Retinoids cause apoptosis in pancreatic cancer cells via activation of RAR- and altered expression of Bcl-2/Bax[J].British Journal of Cancer,2002,87(5):555-561.

