南极磷虾壳聚糖的提取及止血研究
刘 缘 潘浩波 赵晓丽
(中国科学院深圳先进技术研究院 深圳 518055)
1 引 言
南极磷虾属节肢动物门甲壳纲磷虾目,是生活在南冰洋的南极洲水域的无脊椎动物。南极磷虾的蕴藏量十分丰富,可达 6.5×108~10×108t[1,2],是最为丰富的一种海洋动物资源。在2010 年,中国水产品总产量近 6 000 万吨[3],不到南极磷虾资源总量的 10%。南极磷虾营养价值高,含有丰富的脂肪酸、蛋白质、维生素、微量元素及其他生物活性成分[4]。更为重要的是,从南极磷虾废弃的虾壳中可以提取甲壳素,再经过脱乙酰可以得到用途广泛的壳聚糖。与近海资源相比,以南极磷虾的虾壳作为壳聚糖的新型来源,其优势在于无污染,重金属含量低,巨大的生物质存量可以保证壳聚糖质量的稳定性,同时南极极端的自然环境可能赋予它特殊的理化性质。
壳聚糖,英文名 Chitosan,又名脱乙酰甲壳素,经甲壳素脱去乙酰基得到,是甲壳素的主要改性产物;化学名β-(1,4)-2-氨基-2-脱氧-D-葡萄糖[5](图1),是自然界中唯一存在的碱性多糖,被称为继蛋白质、糖、脂肪、维生素、矿物质以外的第六生命要素。壳聚糖具有很好的生物相容性[6]、生物降解性及安全性,其固有的优良性能使其在生物医药领域具有广泛的应用[7,8]。
近年来,南极磷虾作为壳聚糖的来源引起了国内外学者的关注。我们在前期研究中发现,南极磷虾壳聚糖具有优异的止血效果,在创伤和止血方面具有很好的应用前景[9]。目前临床应用的止血材料主要包括沸石、马铃薯淀粉、明胶和胶原等,在使用中都存在一定局限性。其中,明胶和胶原的组织黏附性能较差,它们的止血功能均依赖于血小板和凝血因子,应用受到限制[10]。沸石在吸收血液中的水分后会放出大量的热,可能会导致伤口炎症[11]。相比之下,无毒、无抗原性、抗菌性和生物相容性良好的壳聚糖在开发止血材料方面有着更大的优势,但提取壳聚糖的工艺还有待进一步优化。

图1 壳聚糖的化学结构Fig. 1 The molecular structure of chitosan
南极磷虾的虾壳中含有大量的甲壳素,其个体小,虾壳薄,处理工艺与传统的虾壳和蟹壳不同。因此,本研究将对南极磷虾壳聚糖的提取工艺进行探索与优化,对产物的各项性能进行表征,并对其凝血效果进行评价。
2 实验方法
2.1 实验试剂与仪器
氢氧化钠、盐酸、冰醋酸等购自上海凌峰化学试剂有限公司,G250 考马斯亮蓝染色剂、标准牛血清蛋白购自上海碧云天生物技术有限公司,氘带醋酸、重水购自 Aladdin(阿拉丁)公司。作为对照的壳聚糖分别购买于 Aladdin 公司(a-cs,脱乙酰度≥95%),J&K 百灵威(b-cs,平均分子量 100 000~300 000)。
红外光谱仪(Fourier Transform Infrared Spectroscopy,FTIR),VERTEX 70,德国BRUKER 公司。热重分析仪,TAQ600,赛默飞世尔科技公司。旋转黏度计,NJD-1,上海精纯仪器设备有限公司。乌氏粘度计,赛默飞世尔科技公司。全波长读数仪,Multiskan Go,赛默飞世尔科技公司。核磁共振波谱仪,AVANCE Ⅲ 400,赛默飞世尔科技公司。冷冻干燥机,FD-1D-80,北京博医康实验仪器有限公司。
2.2 南极磷虾壳聚糖的提取
首先通过两次酸碱交替,从南极磷虾的虾壳中提取甲壳素。具体方法如下,将干虾壳和1 mol/L HCl 按 1∶20 质量体积比(m/v)在室温下搅拌反应 1 h,过滤冲洗至中性,进行脱钙。然后加入 1 mol/L NaOH 溶液(m/v=1∶20),于100℃ 下搅拌反应 1 h 进行脱蛋白,过滤冲洗至中性。分别重复一次脱钙、脱蛋白的步骤,将得到的产物于 60℃ 烘箱中烘干得到甲壳素。
将得到的甲壳素脱乙酰制备壳聚糖,步骤如下:(1)将甲壳素与 50% 浓 NaOH 按 1∶50 质量/体积加入三口烧瓶,在油浴锅中 110℃ 回流反应 1 h,于室温搅拌 2 h;重复上述脱乙酰步骤后,将收集得到的产物冲洗至中性,干燥可得壳聚糖粗品。(2)将壳聚糖粗品溶解在 1% 的乙酸溶液中进行纯化,过滤除去不溶性杂质;然后用 1 mol/L NaOH 将溶液的 pH 调节至 8.5,待产生白色絮状沉淀,对溶液进行过滤收集沉淀物;(3)将沉淀物用双蒸水洗涤至中性并通过冷冻干燥,即得到亮白色的南极磷虾壳聚糖粉末(n-cs)。
2.3 壳聚糖的性质表征
2.3.1 红外光谱
采用溴化钾(KBr)压片法,将南极磷虾壳聚糖样品和 KBr 粉末混合,充分研磨制成压片,用BRUKER VERTEX 70 傅里叶变换红外光谱仪扫描,记录样品在 400~4 000 cm-1的红外吸收光谱。
2.3.2 核磁共振图谱
取 10 mg 壳聚糖粉末溶于 1 mL 2% 氘带醋酸的重水溶液,用 AVANCE Ⅲ 400 核磁共振波谱仪测定壳聚糖的1H NMR 图谱。
2.3.3 灰分含量测量
称取 5~10 mg 的壳聚糖,采用热重分析仪测量灰分含量。其中,天平和样品载气均为空气,流速 20 mL/min,设定温度从室温升至800℃(保持 20 min),由所得数据计算其灰分含量。
2.3.4 蛋白含量测量
用 Bradford 法[12]对壳聚糖蛋白质含量进行测定。首先,将标准蛋白配制成不同浓度梯度,加入 G250 染色剂,在 Multiskan Go 全波长读数仪上测定 595 nm 处吸光度,制成标准曲线。其次,将壳聚糖样品溶于 1% 的醋酸溶液中使其浓度为 10 mg/mL,G250 进行染色后,在 595 nm处测定其吸光值。最后,根据标准曲线计算出壳聚糖的蛋白含量。
2.3.5 分子量测量
采用乌氏粘度法测量其粘均分子量。首先,称取 0.015 g 壳聚糖溶于 20 mL 0.3 mol/L 醋酸/0.2 mol/L 醋酸钠溶剂中,充分溶解后用滤纸过滤除去微细不溶物。其次,调节恒温槽温度至(25.0±0.1)℃,将乌氏粘度计垂直放入恒温槽,使水面完全浸没 G 球,测得壳聚糖溶液流经毛细管所需时间t,重复 3 次(每次的差值不超过 0.2 s),计算平均值;测定纯溶剂流经毛细管所需时间t0。最后,相对粘度ηr=t/t0,增比粘度ηsp=ηr-1,根据一点法公式η=(ηsp+3㏑ηr)/4c(c为溶液浓度)计算出壳聚糖的粘度(η),再由粘度计算粘均分子量M=η/ka[13]。其中,k=0.007 9,a=0.796。
2.3.6 黏度测量
采用旋转黏度计测量壳聚糖溶液的黏度。称取 0.25 g 壳聚糖样品溶于 25 mL 1% 醋酸溶液中,搅拌 30 min 使其充分溶解。静置一段时间后,在 20℃ 左右条件下用 NJD-1 型旋转黏度计测试其黏度。
2.4 提取工艺对南极磷虾壳聚糖理化性质的影响
2.4.1 前处理对壳聚糖颜色的影响
将南极磷虾虾壳用 1 mol/L 的 NaOH 进行前处理:室温下搅拌浸泡 24 h,过滤水洗后重复一次,水洗至中性并干燥。之后与未做前处理的壳聚糖进行对比实验。
2.4.2 酸浓度对壳聚糖灰分含量的影响
首先,将南极磷虾虾壳分别用 1 mol/L 和2 mol/L 的盐酸进行脱钙处理,后续操作均相同。其次,采用热重分析仪测量灰分,并比较 2种产物的灰分含量。
2.4.3 反应时间对壳聚糖蛋白质含量的影响
将南极磷虾虾壳在 1 mol/L NaOH 溶液于100℃ 分别反应 1 h 和 1.5 h,其他操作均相同,用 Bradford 法,比较最终产物的蛋白质含量。
2.4.4 不同反应温度和时间对壳聚糖脱乙酰度的影响
为探讨不同反应温度和时间对壳聚糖脱乙酰度的影响,对甲壳素做 2 种处理,具体如下。
(1)将制备的甲壳素(6 g)平均分成 3 份,置于 220 mL 的三口烧瓶中,加入 100 mL 50% 的NaOH,分别在 100℃、110℃ 和 130℃ 的油浴锅加热搅拌回流 1 h 进行脱乙酰反应,水洗至中性;重复一次前述脱乙酰的操作,获得脱乙酰壳聚糖。
(2)将制备的甲壳素(6 g)平均分成 3 份,置于 220 mL 的三口烧瓶中,加入 100 mL 50% 的NaOH,在 110℃ 的油浴锅加热搅拌回流进行脱乙酰反应,反应时间分别为 1 h、2 h 和 3 h,水洗至中性;重复一次前述脱乙酰的操作,获得脱乙酰壳聚糖。
对上述 2 种方法处理获得的产物均采用核磁谱图检测其脱乙酰度。
2.5 凝血效果评价
采用试管法评价壳聚糖的凝血效果,具体步骤如下:(1)取最优条件制备的南极磷虾壳聚糖和从阿拉丁和百灵威购买的壳聚糖粉末(10 mg),分别放入玻璃管中并预热至 37℃;(2)通过 SD大鼠心脏取血实验获得实验用血液,存放于抗凝试管中备用;(3)取 1.0 mL 血液分别加入到不同的壳聚糖试管中,而未加壳聚糖的血液凝固时间作为对照;(4)加入 0.2 mol/L CaCl2达到 20mmol/L[14]恢复血液凝血能力并开始计时;(5)每隔 30 s 倾斜试管检查血液流动情况,直到血液完全停止流动,停止计时。所有实验组及对照组均同时做 3 份重复,最终取平均值。
3 结 果
3.1 南极磷虾壳聚糖外观颜色
本研究采用酸碱交替法提取南极磷虾壳聚糖,免去了传统的壳聚糖制备工艺过程中的脱色操作。与商品化的淡黄色壳聚糖相比,南极磷虾壳聚糖的颜色为亮白色(如图2)。

图2 南极磷虾壳聚糖产物形貌Fig. 2 The morphology of Antarctic krill shell fi sh
3.2 红外光谱
南极磷虾壳聚糖的化学结构由红外光谱确定,结果如图3 所示。在谱图中,壳聚糖的特征吸收峰在 1 653、1 570 和 1 077 cm-1处,分别属于 C=O 伸缩(酰胺 I 带)、N-H 变形(酰胺 II带)和 C-O 伸缩振动[15]。产物符合壳聚糖的特征峰。

图3 不同种类的壳聚糖红外谱图Fig. 3 The FTIR of the different kinds of chitosan
3.3 1H 核磁共振
目前可用来测定壳聚糖的脱乙酰度的方法有很多,但1H 核磁共振法是检测壳聚糖脱乙酰度最为准确、快速的方法,并且重复性好,其谱图结果如图4 所示。

图4 不同种类壳聚糖的核磁氢谱Fig. 4 The 1H NMR of the different kinds of chitosan
脱乙酰度按以下公式[16]计算:

由表1 可知,南极磷虾壳聚糖和购买于阿拉丁公司的壳聚糖的脱乙酰度都高于 90%,满足医用级壳聚糖的标准。而购买于百灵威公司的壳聚糖脱乙酰度较低,仅为 72.64%。
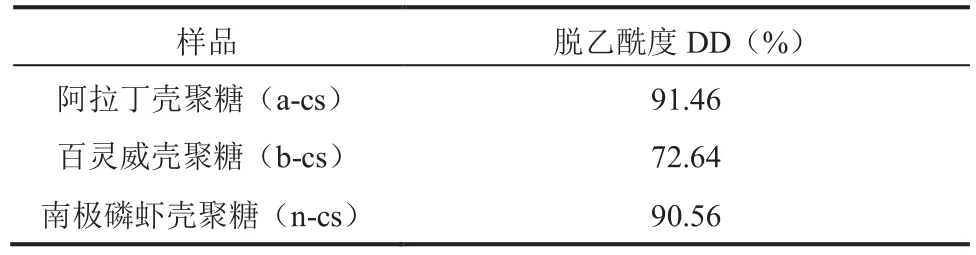
表1 不同来源的壳聚糖脱乙酰度Table 1 The degree of deacetylation of chitosan from different sources
3.4 南极磷虾壳聚糖理化性质
国家食品药品监督管理局在 2008 年制定了YY/T0606.7—2008《组织工程医疗产品第 7 部分:壳聚糖》[17]。其中,对壳聚糖的杂质标准做了规定:规定壳聚糖中灰分的质量分数≤0.5%,蛋白的质量分数≤0.2%。鉴于该步骤得到的壳聚糖蛋白含量(0.55%)及灰分含量(0.85%)都还比较高(见表2),将在纯化过程中进一步进行处理。
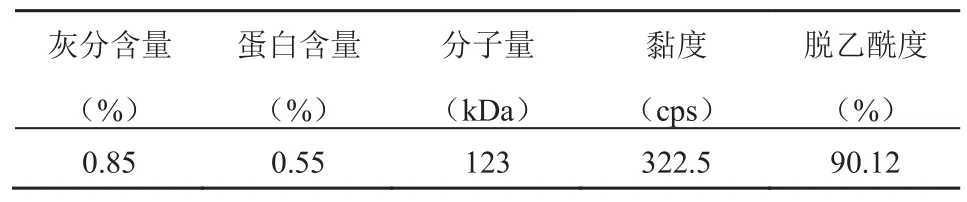
表2 南极磷虾壳聚糖的理化性质Table 2 The physiochemical properties of Antarctic krill chitosan
3.5 提取工艺对南极磷虾壳聚糖理化性质的影响
3.5.1 前处理对壳聚糖颜色的影响
在南极磷虾中,显色的物质为虾红素,它在高温、紫外光照射、酸碱等条件下易分解,同时在加热的条件下可以和蛋白质结合。虽然在脱蛋白的过程中可以去除部分虾红素,但一般仍有残留,最终以糖蛋白的结合形式残留在壳聚糖中。本研究通过增加碱浸泡的前处理工序,减少壳聚糖中虾红素的残留。通过对比可发现,未做前处理的壳聚糖颜色偏粉,而用增加碱液进行前处理工艺得到的壳聚糖颜色亮白(图5)。表明碱液前处理可以降低壳聚糖中虾红素的含量,获得更好的壳聚糖形貌。目前其他文献报道和商品化的壳聚糖多为淡粉色或淡黄色[18,19],而这一前处理工艺可以解决壳聚糖颜色偏黄的问题,从而具有更广泛的应用[20]。

图5 前处理工艺对壳聚糖的影响Fig. 5 Effects of pretreatment in NaOH solution on the color of chitosan
3.5.2 酸浓度对壳聚糖灰分含量的影响
通过不同酸浓度处理结果显示,用 1 mol/L的盐酸进行脱钙处理后得到的南极磷虾壳聚糖灰分含量为 0.85%,而用 2 mol/L 的盐酸进行脱钙处理得到的南极磷虾壳聚糖,其灰分含量降到0.095%,达到医用标准。这表明增加酸处理浓度可降低壳聚糖中的灰分含量。
3.5.3 反应时间对南极磷虾壳聚糖蛋白质含量的影响
在脱蛋白过程中,对南极磷虾虾壳分别用碱液反应 1 h 和 1.5 h,将得到的壳聚糖的蛋白含量进行对比。由结果(表3)可见,延长脱蛋白时间对南极磷虾壳聚糖中蛋白质的去除没有显著的影响。蛋白质去除困难的原因可能是甲壳动物外壳中的蛋白质与甲壳素通过共价、静电、疏水和氢键等作用方式形成甲壳素-蛋白质糖蛋白复合物[20]。这种较强的相互作用,给提取壳聚糖带来了难度。同时,由于壳聚糖在脱蛋白工艺中通过强碱已经去除了大部分的蛋白质,剩余蛋白含量极少,因而再增加碱处理时间对去除壳聚糖中剩余蛋白质作用不明显[21],完全去除壳聚糖的蛋白还需通过其他方式进一步研究。

表3 反应时间对南极磷虾壳聚糖蛋白含量的影响Table 3 The effects of different reaction time of alkali treatments on the protein content of Antarctic krill chitosan
3.5.4 不同脱乙酰处理条件对壳聚糖脱乙酰度的影响
通过脱乙酰过程中不同反应温度和时间,研究其对壳聚糖脱乙酰度的影响。由结果(表4)可见,当反应时间为 1 h 、温度为 100℃ 时,壳聚糖脱乙酰度为 83% 左右。当升高温度至 110℃后,脱乙酰度增加了约 7%,但继续升高温度对脱乙酰度的影响不大。在 110℃ 反应温度下研究增加脱乙酰反应时间对脱乙酰度的影响发现,不同反应时间下的壳聚糖脱乙酰度都约为 90%,没有显著性区别,说明增加反应时间对脱乙酰度的提高影响不大。可能是由于脱乙酰过程中,酰胺键的断裂主要发生在反应 1 h 内,由于空间结构和结合形式等原因,剩余少量的酰胺键在当前的反应条件下达不到断裂反应条件,而继续增加反应时间会发生壳聚糖主链的断裂,导致分子量的下降,黏度降低。因此,由以上结果可确定脱乙酰反应的最优条件为 110℃ 反应 1 h。
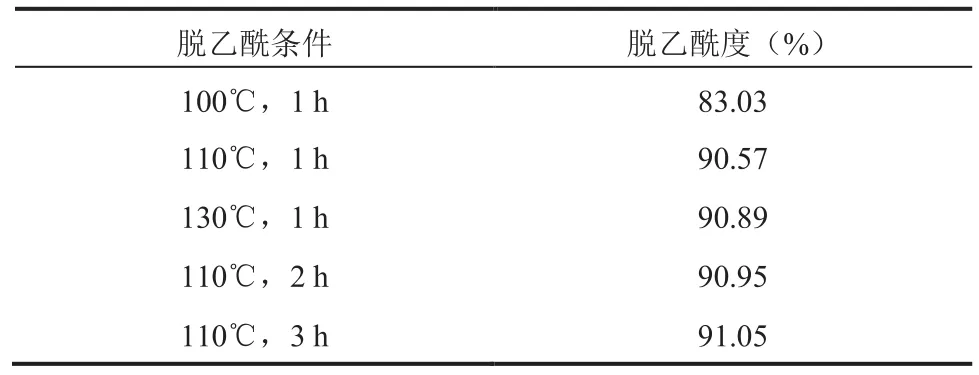
表4 不同脱乙酰处理条件对壳聚糖脱乙酰度的影响Table 4 The effects of different deacetylation conditions on the degree of deacetylation of chitosan
3.6 凝血效果评价

图6 不同壳聚糖的凝血效果Fig. 6 The effect of different chitosan on the blood coagulation
壳聚糖可以凝血的原因是由于它所携带的正电荷可以吸附带有负电的血小板及凝血蛋白等,并有激活血小板的凝血功能。本研究通过凝血实验对比提取的南极磷虾壳聚糖与商品化的壳聚糖的凝血效果。由图6 可见,复凝血液的自凝固时间需要约 1 000 s,而不同来源的壳聚糖均能够有效地降低血液凝固的时间。其中,阿拉丁壳聚糖(a-cs)和百灵威壳聚糖(b-cs)能够将凝血时间降低至对照组的约 40%,而南极磷虾壳聚糖(n-cs)具有更明显的凝血作用,能够进一步缩短 15% 的凝血时间。这说明南极磷虾壳聚糖的凝血效果更佳。
4 讨 论
南极磷虾生物蕴藏量十分丰富,其虾壳作为壳聚糖的新型来源,相对近海资源来说具有无污染的优势,而且南极磷虾个体小、虾壳薄,易于处理。对于从南极磷虾提取的壳聚糖,传统工艺多采用酸碱交替的实验方法,酸处理和碱处理都在 3 次以上[22],操作步骤较多,有些还需用到高锰酸钾来进行脱色[18]。本研究采用 2 次酸碱交替法,且每次处理仅需 1 h,相对地减少了操作步骤,缩短了实验时间;同时,南极磷虾壳聚糖为亮白色,无需再进行脱色处理,避免了造成环境污染的可能。得到南极磷虾壳聚糖的脱乙酰度高于 90%,分子量为 123 kDa,灰分含量为 0.095%,达到医药级的标准。但蛋白含量仍然较高,需要针对天然多糖的蛋白去除做进一步研究。
凝血实验表明,南极磷虾壳聚糖的凝血效果优于其他商品化的壳聚糖。壳聚糖的多种理化性质,如分子量、脱乙酰度、特性黏度、水合度、结晶度、蛋白含量和灰分等[23]对止血效果均有一定的影响。其中,脱乙酰度、分子量和水合度起主要作用,蛋白含量和灰分对于凝血作用的影响较小。提高脱乙酰度对壳聚糖促凝血效果具有促进作用,高分子量的壳聚糖凝血效果略优于低分子量的壳聚糖。据报道,南极磷虾壳聚糖结构内的自由羟基含量高[22]。而我们前期研究也发现这种壳聚糖的水化能力明显高于其他来源的壳聚糖[9],再加上结晶度、分子量等的差别,使得南极磷虾壳聚糖的凝血效果更好,这也从一定程度上表明其在止血材料方面具有极大的应用前景。
5 结 论
本研究以生活在南极水域的南极磷虾为来源,进行壳聚糖提取的工艺研究。通过脱蛋白、脱钙和脱乙酰得到的壳聚糖为亮白色,脱乙酰度达 90.6%,分子量为 123 kDa,灰分含量为0.095%。通过对提取工艺进行优化可以发现,碱液前处理能够改善壳聚糖表观颜色,提高酸浓度能够降低灰分,延长脱蛋白时间对降低蛋白含量作用较小,脱乙酰的最适温度在 110℃,而延长反应时间对提高脱乙酰度作用不大。将优化制备工艺后的壳聚糖进行止血效果评价发现,南极磷虾壳聚糖的凝血效果优于其他壳聚糖。应用南极磷虾作为壳聚糖的提取来源,将提高现有壳聚糖止血产品的止血效果,具有重要的应用前景。
[1]张倩. 南极磷虾虾油脱氟提取的工艺研究与设计[D]. 济南: 山东师范大学, 2013.
[2]张霖保. 南极磷虾鱼类资源量估算 [J]. 现代渔业信息, 1987(12): 22.
[3]周雨思, 阮雯, 王茜, 等. 文莱渔业近况与发展趋势 [J]. 渔业信息与战略, 2013, 28(4): 312-316.
[4]杨洋, 刘晓芳. 南极磷虾主要营养成分及保健机能研究进展 [J]. 大连医科大学学报, 2014(2): 186-189, 194.
[5]Mach RL, Peterbauer CK, Payer K, et al.Expression of two major chitinase genes of trichoderma atroviride (T. harzianum P1) is triggered by different regulatory signals [J]. Applied& Environmental Microbiology, 1999, 65(5): 1858-1863.
[6]Pillai CKS, Paul W, Sharma CP. Chitin and chitosan polymers: chemistry, solubility and fi ber formation[J]. Progress in Polymer Science, 2009, 34(7): 641-678.
[7]Bautista-Baños S, Hernández-Lauzardo AN,Velázquez-del Valle MG, et al. Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities[J]. Crop Protection (Guildford, Surrey), 2006,25(2): 108-118.
[8]Hamidi M, Ra fi ei P, Azadi A, et al. Encapsulation of valproate-loaded hydrogel nanoparticles in intact human erythrocytes: a novel nano-cell composite for drug delivery [J]. Journal of Pharmaceutical Sciences, 2011, 100(5): 1702-1711.
[9]Wu S, Huang ZY, Yue JH, et al. The efficient hemostatic effect of antarctic krill chitosan is related to its hydration property [J]. Carbohydrate Polymers, 2015, 132: 295-303.
[10]马军阳, 陈亦平, 李俊杰, 等. 甲壳素/壳聚糖止血机理及应用 [J]. 北京生物医学工程, 2007, 26(4):442-445.
[11]李保强, 方一帆, 杨传瑞, 等. 新型快速止血材料的止血评价与止血机制 [J]. 实验技术与管理,2007, 24(7): 51-54.
[12]国家药典委员会. 中华人民共和国药典(2015 年版一部) [M]. 北京: 中国医药科技出版社, 2015.
[13]Brugnerotto J, Desbrières J, Roberts G, et al.Characterization of chitosan by steric exclusion chromatography [J]. Polymer, 2001, 42(25): 09921-09927.
[14]Behrens AM, Sikorski MJ, Li T, et al. Bloodaggregating hydrogel particles for use as a hemostatic agent [J]. Acta Biomaterialia, 2014,10(2): 701-708.
[15]Kang ML, Kim JE, Ko JY, et al. Intra-articular delivery of kartogenin-conjugated chitosan nano/microparticles for cartilage regeneration [J].Biomaterials, 2014, 35(37): 9984-9994.
[16]Hirai A, Odani H, Nakajima A. Determination of degree of deacetylation of chitosan by1H NMR spectroscopy [J]. Polymer Bulletin, 1991, 26(1):87-94.
[17]国家食品药品监督管理局. 中华人民共和国医药行业标准(YY/T0606.7-2008)——组织工程医疗产品 第7部分: 壳聚糖 [S]. 2008.
[18]姚宏亮. 南极磷虾虾壳制备甲壳素/壳聚糖的工艺研究 [J]. 水产科学, 2004, 23(5): 34-36.
[19]梁玉佳. 南极磷虾虾壳中甲壳素的制取与应用[D]. 大连: 大连工业大学, 2013.
[20]Kurita K. Chitin and chitosan: functional biopolymers from marine crustaceans [J]. Marine Biotechnology, 2006, 8(3): 203-226.
[21]杨久林, 谢红国, 于炜婷, 等. 组织工程用壳聚糖研究进展 [J]. 功能材料, 2013, 44(11): 1521-1525.
[22]Wang YC, Chang YG, Yu L, et al. Crystalline structure and thermal property characterization of chitin from Antarctic krill (Euphausiasuperba) [J].Carbohydrate Polymers, 2013, 92(1): 90-97.
[23]Rhazi M, Desbrières J, Tolaimate A, et al.Investigation of different natural sources of chitin:in fl uence of the source and deacetylation process on the physicochemical characteristics of chitosan [J].Polymer International, 2000, 49(4): 337-344.

