利用紫苏粕和豆粕发酵生产紫苏酱的制曲工艺研究
张昕,徐连爽,王雪莹,许宏源
(1.吉林工商学院 粮油食品深加工吉林省高校重点实验室,长春 130507;2.吉林工商学院 粮食学院,长春 130507)
紫苏Perillafrutescens(L.)Britt是传统的药食同源植物,富含α-亚麻酸、花青素、甾醇、紫苏酮、紫苏醛和丁香油酚等特殊的营养和活性成分[1]。其果实紫苏籽冷榨紫苏油剩余的紫苏粕中,含有高达40%左右的蛋白质[2],内含18种氨基酸,含有人体所必需的8种氨基酸,其中赖氨酸、蛋氨酸的含量较高[3]。此外紫苏粕中还含有粗纤维17.3%、粗脂肪8.7%和紫苏特殊的活性成分,具有很高的营养价值[4]。目前,大量的紫苏粕经简单加工添加到饲料中,紫苏粕资源未得到充分利用[5]。我们研究利用紫苏粕和豆粕共发酵生产紫苏酱,有效利用紫苏粕的营养价值和保健价值,紫苏粕特殊的营养成分、活性成分和风味物质保留在酱中,比传统豆酱的调味、增香和保健功能更胜一筹。本研究探索发酵生产风味紫苏酱产品的制曲工艺条件。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
L-酪氨酸 上海荔达生物科技有限公司;Folin-酚试剂 上海分子免疫生化实验室有限公司;干酪素、其他试剂(分析纯) 上海国药集团化学试剂有限公司;紫苏粕、豆粕、面粉(标准粉) 产地吉林省洮南市;食盐 市售。
1.1.2 菌种
高大毛霉F3.06(Mucormucedo):吉林工商学院微生物实验室从自然发酵的紫苏粕中分离的菌种。
1.1.3 培养基
制曲培养基:紫苏粕35 g、豆粕65 g、面粉18 g、料水比10∶8。pH自然,121 ℃灭菌25 min[6,7]。
1.2 仪器与设备
DHG-9023A台式电热恒温鼓风干燥箱 北京神泰伟业仪器设备有限公司;LDZX-40BI立式自动电热压力蒸汽灭菌器 上海申安医疗器械厂;SPX-250B-Z型生化培养箱 上海博迅实验有限公司医疗设备厂;SPH-2102C温度培养振荡器 上海世平实验设备有限公司;755B紫外可见分光光度计 上海精密科学仪器有限公司;DFY-1000C实验室万能粉碎机 上海豫明仪器有限公司。
1.3 方法
1.3.1 成曲制备工艺流程
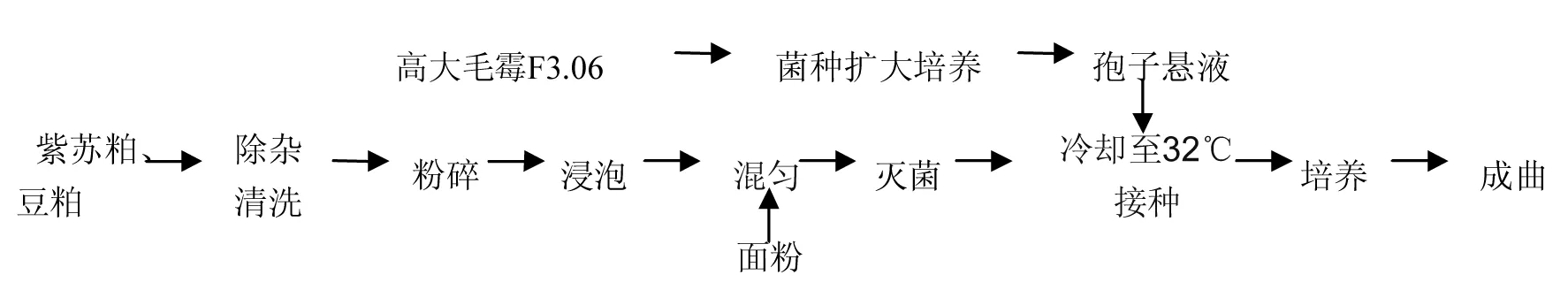
1.3.1.1 孢子悬液制备
采用培养120 h的高大毛霉斜面菌种。用含有0.1%吐温80的无菌水10 mL洗脱孢子,移入三角瓶中,加入蜗牛酶和已灭菌的玻璃珠振荡20 min左右,过滤除去菌丝和成团的孢子。用血球计数板测定孢子浓度并用无菌生理盐水稀释孢子浓度约为1×106cfu/mL[8]。
1.3.1.2 制曲方法
紫苏粕、豆粕粉碎为2.8 mm颗粒,料水比10∶8,添加40 ℃温水浸润8 h后,加入面粉混匀,121 ℃灭菌25 min,料温自然降到32 ℃时,接种1×106cfu/mL高大毛霉F3.06孢子悬液,混合均匀后装入曲盘培养,控制曲室温度,按照实验设计时间定时翻曲1 min,曲料由白色转为灰褐色时,制得成曲[9]。
1.3.2 中性蛋白酶活力测定方法
中性蛋白酶活力测定采用Folin-酚试剂比色法。
1.3.2.1 标准曲线的绘制
取18支试管分成6组,每组3个平行样,其中第1组的3支试管不加标准酪氨酸溶液做空白对照,其余5组试管中分别吸取100 μg/mL标准酪氨酸溶液0.2,0.4,0.6,0.8,1.0 mL;6组试管中分别加入去离子水定容至1 mL,各加入0.4 mol/L的Na2CO3溶液5 mL和已稀释的Folin-酚试剂1 mL,摇匀,置40 ℃水浴锅中保温发色20 min,用分光光度计在660 nm处测定吸光度值[10,11]。
1.3.2.2 成曲粗酶液的制备
称取成曲1.00 g放入研钵中,逐渐加入pH 7.0的磷酸缓冲液50 mL研碎,置于40 ℃恒温振荡器中,以100 r/min浸提30 min,4层纱布过滤,滤液在4 ℃,4000 r/min离心15 min去除固形物,上清液用pH 7.0的磷酸缓冲液定容到100 mL即为粗酶液[12]。
1.3.2.3 成曲酶活力的测定
取4支试管,1号为空白,其余3支为样品,分别加入成曲粗酶液1 mL,1号管立即加入0.4 mol/L的TCA溶液2 mL使酶失活,另3支样品试管分别加入pH 7.0浓度为2%的酪蛋白缓冲液1 mL迅速混匀,放入40 ℃水浴保温10 min后,立即加入0.4 mol/L的TCA溶液2 mL终止反应,然后向1号管中加入1 mL的pH 7.0酪蛋白缓冲液,继续保温20 min,取出,在4 ℃,8000 r/min离心15 min去除固形物。分别移取上清液1 mL,加入0.4 mol/L的Na2CO3溶液5 mL和已稀释的Folin-酚试剂1 mL,摇匀,置40 ℃水浴浸锅中保温发色20 min,用分光光度计在660 nm处测定吸光度值,以1号管做空白对照,样品每次做3个平行,取平均值[13]。
1.3.2.4 酶活力定义
1 g成曲在40 ℃和pH值7.0条件下,1 min分解酪蛋白产生1 μg酪氨酸所需的酶量为1个中性蛋白酶活力单位(U)。
1.3.2.5 计算公式
中性蛋白酶活力(U)=A×K×N×4/10。
式中:A为样品平行试验的平均吸光度值;K为吸光常数;N为稀释倍数;4为反应试剂的总体积;10为反应时间10 min。
2 结果与分析
2.1 高大毛霉接种量对成曲中性蛋白酶活力影响的试验结果
采用制曲培养基紫苏粕35 g、豆粕65 g、面粉18 g、料水比10∶8。pH自然,121 ℃灭菌25 min。曲料温度自然降到32 ℃时,分别设定接菌量为2,3,4,5,6,7,8 mL/100 g接种高大毛霉1×106cfu/mL孢子悬液,在制曲温度(28±1 )℃,制曲时间48 h,每12 h定时翻曲1 min条件下进行单因素试验[14],探究高大毛霉接种量对成曲中性蛋白酶活力的影响,结果见图1。

图1 高大毛霉接种量对成曲中性蛋白酶活力影响的试验结果Fig.1 The experimental result for the impact of additive amount of Mucor mucedo on activity of neutral proteinase
由图1可知,高大毛霉的接种量在2~5 mL/100 g时,随着高大毛霉接种量的增加,成曲中性蛋白酶活力明显提高,高大毛霉的接种量为5 mL/100 g时,中性蛋白酶活力达到 593.7 U/g,高大毛霉的接种量在5~8 mL/100 g时,随着高大毛霉接种量的增加,成曲中性蛋白酶活力变化不明显。因此,综合考虑经济效益,选择成曲蛋白酶活力较高的高大毛霉接种量5,6,7 mL/100 g进行正交试验。
2.2 制曲温度对成曲中性蛋白酶活力影响的试验结果
采用制曲培养基和单因素优化的接种量5 mL/100 g接种高大毛霉孢子悬液。分别设定制曲温度为25,26,27,28,29,30,31 ℃[15],制曲时间48 h,每12 h定时翻曲1 min条件下,探究制曲温度对成曲中性蛋白酶活力的影响,结果见图2。
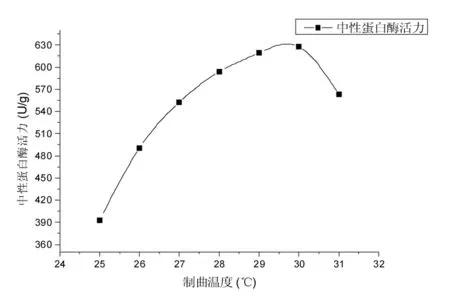
图2 制曲温度对成曲中性蛋白酶活力影响的试验结果Fig.2 The experimental result for the impact of koji-making temperature on activity of neutral proteinase
由图2可知,制曲温度在25~30 ℃时,随着温度的升高,成曲中性蛋白酶活力明显提高,制曲温度在30~31 ℃时,随着温度的升高,成曲中性蛋白酶活力明显下降,因此,选择成曲蛋白酶活力较高的3个制曲温度28,29,30 ℃进行正交试验。
2.3 制曲时间对成曲中性蛋白酶活力影响的试验结果
在高大毛霉接种量5 mL/100 g,制曲温度(30±1) ℃,每12 h定时翻曲1 min条件下,分别设定制曲时间为36,42,48,54,60,66,72 h时[16],测定成曲的中性蛋白酶活力,探究制曲时间对成曲中性蛋白酶活力的影响,结果见图3。
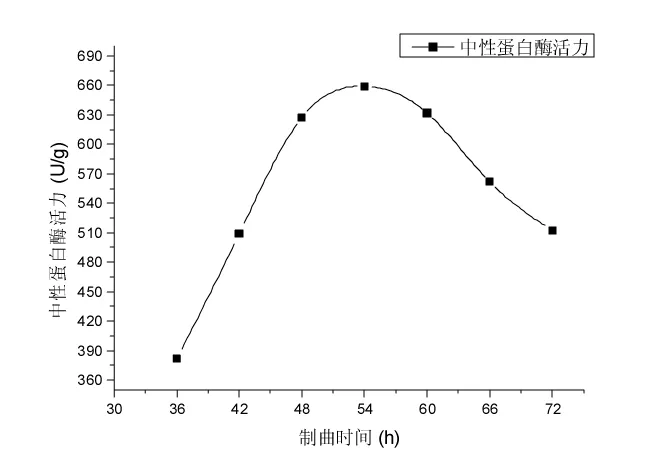
图3 制曲时间对成曲中性蛋白酶活力影响的试验结果Fig.3 The experimental result for the impact of koji-making time on activity of neutral proteinase
由图3可知,中性蛋白酶活力随制曲时间的变化规律,制曲时间在36~54 h时,随着温度的升高,成曲中性蛋白酶活力快速增加,制曲时间为54 h时,中性蛋白酶活力达到峰值659.1 U/g。制曲时间在54~72 h时,酶活力较高但缓慢下降,因此,选择成曲中性蛋白酶活力较高3个制曲时间48,54,60 h进行正交试验。
2.4 翻曲间隔时间对成曲中性蛋白酶活力影响的试验结果
在相邻2次翻曲时间间隔分别为3,6,9,12,15,18,21 h条件下制曲[17],高大毛霉接种量5 mL/100 g、制曲温度(30±1) ℃条件下,制曲时间为54 h,测定成曲的中性蛋白酶活力,探究翻曲间隔时间对成曲中性蛋白酶活力的影响,结果见图4。
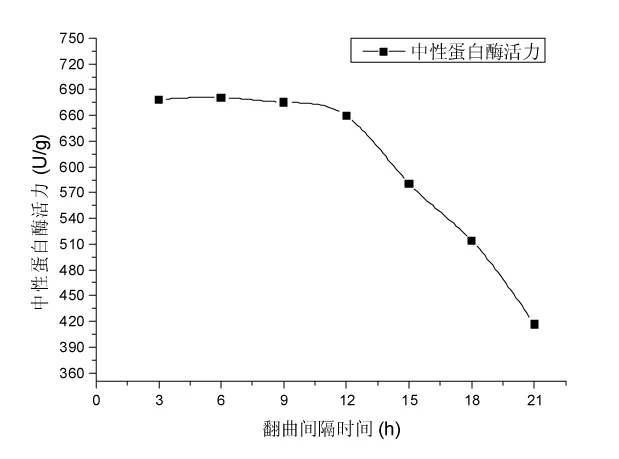
图4 翻曲间隔时间对成曲中性蛋白酶活力影响的试验结果Fig.4 The experimental result for the impact of koji-stirring interval time on activity of neutral proteinase
由图4可知,翻曲间隔时间在3~12 h时,成曲中性蛋白酶活力变化不明显,呈缓慢下降趋势,翻曲间隔时间在12~21 h时,成曲中性蛋白酶活力迅速下降。选择成曲中性蛋白酶活力较高的3个翻曲间隔时间6,9,12 h进行正交试验。
2.5 优化制曲工艺条件的L9(34)正交试验结果
选择接种量、制曲温度、制曲时间、翻曲间隔时间四因素的三水平设计正交试验,测定成曲的中性蛋白酶活力,优化发酵生产风味紫苏酱的制曲工艺条件,结果见表1。
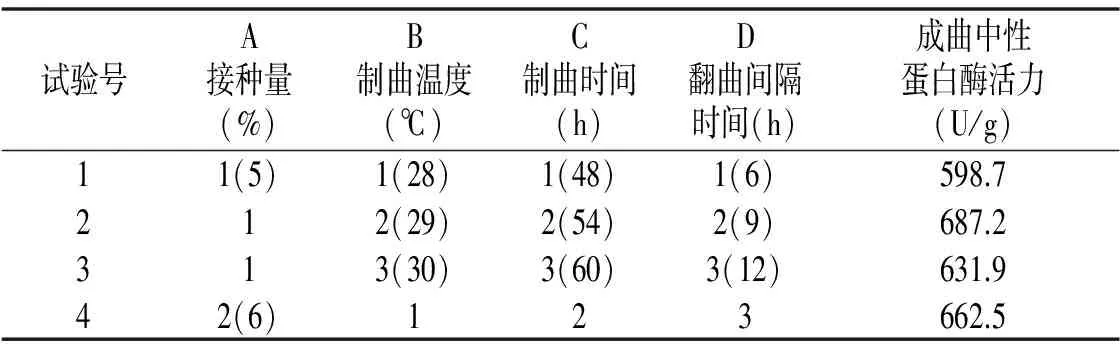
表1 优化制曲工艺条件的L9(34)正交试验结果Table 1 L9(34) orthogonal test results for optimization of koji-making conditions
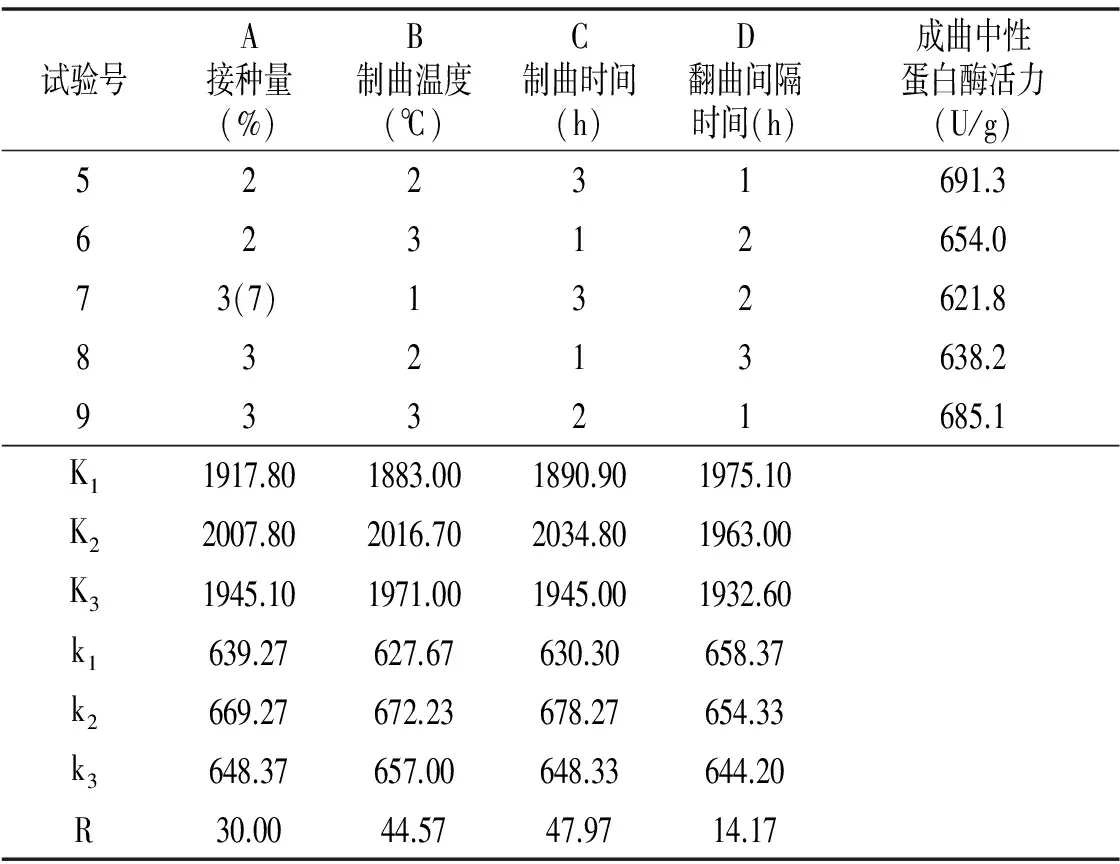
续 表
由表1可知,各因素对成曲中性蛋白酶活力的影响大小顺序依次为C>B>A>D,即制曲时间>制曲温度>接种量>翻曲间隔时间。最佳方案为A2B2C2D1,即1×106cfu/mL高大毛霉孢子悬液接种量6 mL/100 g,制曲温度29 ℃,制曲时间54 h,2次翻曲间隔时间6 h。
2.6 试验验证
为了验证L9(34)正交试验方法优化紫苏粕和豆粕发酵生产紫苏酱的制曲工艺的可行性,运用2.5正交试验优化得到的制曲工艺参数,以中性蛋白酶活力为考察指标,试验做3个平行。测得的中性蛋白酶活力为698.3 U/g,比优化前提高了17.62%,这说明采用L9(34)正交试验方法优化紫苏粕和豆粕发酵生产紫苏酱的制曲工艺条件合理可行。
3 结论
采用单因素试验设计和L9(34)正交试验设计进行紫苏粕和豆粕发酵生产紫苏酱的制曲工艺条件优化,得到最优的工艺条件:1×106cfu/mL高大毛霉孢子悬液的接菌量6 mL/100 g,制曲温度29 ℃,制曲时间54 h,翻曲间隔时间6 h。按照最优工艺条件进行紫苏粕和豆粕发酵生产紫苏酱的制曲,得到中性蛋白酶活力最高为698.3 U/g,比优化前提高了17.62%。
本研究采用正交试验设计方法,与响应面优化方法相比具有一定的局限性[18]。下一步拟采用响应面优化法对制曲工艺进行优化,以便于得到更高的中性蛋白酶活力,为工业化生产提供工艺参数。
[1]李鹏,朱建飞,唐春红,等.紫苏的研究动态[J].重庆工商大学学报,2010,27(3):272-275.
[2]张洪,黄建韶,赵东海.紫苏营养成分的研究[J].湖南文理学院学报(自然科学版),2006,18(1):49-51.
[3]郑君.紫苏子的研究[J].中国中医药资讯,2011(19):44-45.
[4]汤鸣强,郑挺,曾小芳,等.酿造酱油米曲霉产中性蛋白酶的提取及酶学性质研究[J].中国调味品,2008(2):38-40.
[5]丁行勇,高庆华,葛飞.米曲霉固态发酵苹果渣与棉粕生产中性蛋白酶的工艺优化研究[J].安徽工程科技学院学报,2010,25(2):18-21.
[6]刘莹莹,刘颖,张光.毛霉高产中性蛋白酶发酵培养基的优化[J].食品工业科技,2014,35(6):166-170.
[7]张昕,金铭,朱珠.响应面分析法优化风味紫苏酱的制曲培养基[J].中国调味品,2016,41(1):19-22.
[8]钟世荣,冯治平.黄豆甜面酱生产工艺研究[J].食品工业,2011(1):43-45.
[9]田海娟,冷进松.新型紫苏调味豆酱的研究[J].食品科学,2010,31(23):331-334.
[10]林亲录,赵谋明,邓靖,等.毛霉产蛋白酶的特性研究[J].食品科学,2005,26(5):44-46.
[11]潘进权.毛霉蛋白酶的催化特性及动力学研究[J].食品科技,2010,35(11):36-40.
[12]陈红梅,潘力.米曲霉3.042种曲蛋白酶特性研究[J].中国调味品,2009,34(3):63-65.
[13]杨世平,邱徳全.米曲霉中性蛋白酶特性的研究[J].湛江海洋大学学报,2006,26(4):22-25
[14]杨世平,邱徳全.米曲霉产中性蛋白酶的适宜条件[J].湛江海洋大学学报,2005,25(3):47-51.
[15]吴建生,杜林,陈祖,等.影响豆酱制曲质量的因素及其优化控制[J].中国酿造,2008(4):50-52.
[16]何国庆,贾英民,丁立孝.食品微生物学[M].北京:中国农业大学出版社,2009.
[17]杜连祥,路福平.微生物学实验技术[M].北京:中国轻工业出版社,2006.
[18]乔鑫,黄红霞,乔羽,等.响应面分析法优化HS-SPME萃取黄豆酱挥发性成分工艺研究[J].食品科学,2010,31(22):69-73.

