黄水生物发酵技术研究
杨 艳 ,张宿义 ,秦 辉 ,李德林 ,罗 杰 ,蔡小波
(1.泸州老窖股份有限公司,四川泸州646000; 2.泸州保诺生物科技有限公司,四川泸州646000; 3.国家固态酿造工程技术研究中心,四川泸州646000)
黄水是固态白酒酿造过程中的副产物,又名黄浆水,为棕黄色黏稠液体[1]。在浓香型白酒的生产中,含水量为52%~55%的入窖酒醅经过厌氧发酵,其中的淀粉在酶、细菌和酵母菌等微生物的作用下,由糖转变为酒,并生成二氧化碳。随着发酵的进行,微生物代谢所生成的水与酒醅中尚未被微生物利用的水分逐渐沉降,从而将酒醅中的有机酸、酵母溶出物、可溶性淀粉、单宁、还原糖、香味前体物质等溶于其中,并沉积到窖底而形成黄水。因而,黄水中含丰富的有机酸(尤其是己酸、乳酸、丁酸、乙酸等羧酸含量最高)、醇、醛、酯等呈香呈味物质,同时还含有氨基酸、糖类、酒精、腐殖质、酵母菌体自溶物、微生物菌体以及活细胞等。许多学者和厂家对黄水的处理与利用进行了一系列的研究与探讨[2-16],但在其资源化利用和实用性技术方面的研究相对较少。目前我国大部分酒厂对黄水的处理都是采用将其拌糟回窖发酵或养窖、培养人工窖泥、回底锅蒸馏等方法加以利用,不仅不能有效利用资源,而且无法从根本上解决发酵黄水的最佳综合利用问题。
开展清洁生产以及产业内循环发展是21世纪可持续发展的主要目标。黄水的pH值为3.0~3.5,其BOD:25000~30000 mg/L,COD:25000~40000 mg/L,远超过国家允许的废水排放标准,因此如何综合利用黄水资源,彻底解决黄水的最佳综合利用问题,已经成为白酒行业面临的重大课题。本实验以黄水为原料,利用己酸菌进行生香发酵,提高发酵液中己酸等有机酸香味物质成分的含量,为后期的酯化、生香和老熟做好充分准备,最终得到生物发酵液产品,并将其应用于传统白酒酿造,促进糟醅发酵生香,增加己酸乙酯含量,提高基础酒产质量水平。
1 材料与方法
1.1 材料、试剂及仪器
黄水:由泸州老窖罗汉酿酒基地提供,优质己酸菌是从百年以上老窖池中分离富集所得。
试剂:无水乙醇(分析纯),2-乙基丁酸(色谱纯)。
仪器设备:Agilent 6890 GC仪,FID检测器;数据处理采用Agilent 6890工作站;检测器与进样口的温度均为250℃。Agilent 5975I GC-MS,EI源,离子源温度180℃,接口温度200℃,电离电压70 eV。
1.2 色谱条件
交联石英毛细管柱DM-WAX30 m×0.25 mm×0.25µm,起始柱温40℃,恒温2 min后以5℃/min升至80℃,再以10℃/min升至260℃,继续保持恒温约10 min。载气均为高纯氮,全部采取分流进样,分流比约为1∶30,色谱进样1 µL。
1.3 样品预处理
生物发酵液发酵结束后,取发酵液100 mL,加入50 mL无水乙醇后蒸馏,取馏出液100 mL进行理化和色谱分析。
定量分析时以60%vol乙醇为基体,2%2-乙基正丁酸的内标混合液,然后准确移取10 mL蒸馏样,添加0.1 mL内标液混匀即可供进样。
1.4 最佳工艺条件的确定
1.4.1 单因素试验
以发酵温度、接种量、乙醇添加量和发酵时间为因素进行单因素试验,确定正交试验各因素的水平。
1.4.2 正交试验设计
所谓正交试验设计,是以概率论和数理统计为理论基础,用正交试验表安排多因素试验顺序,把各因素均衡分布、因素之间均衡搭配,使各因素在试验中对测试结果的影响基本上相同或相近,最大限度地排除了其他因素的干扰,突出了被考察因素的效应,基本上能够反映试验的全面情况[17-20]。
2 结果与讨论
2.1 生物发酵液培养单因素考察
2.1.1 不同发酵温度对生物发酵过程己酸生成量的影响
己酸菌液接种量10%,乙醇浓度5%,发酵时间10 d,发酵温度设置为20℃、25℃、30℃、35℃和40℃,另设置1个不添加己酸菌液的空白对照样,发酵结束后进行色谱检测分析。不同发酵温度下的己酸含量见图1。

图1 不同发酵温度对己酸生成量的影响
由图1可知,空白对照样,不同温度条件几乎都没有己酸的生成;随着发酵温度的升高,试验样的己酸含量呈上升趋势,发酵温度为35℃时,己酸的生成量最高,达到1.34 g/L,当发酵温度为40℃时,试验样中己酸含量大幅下降。这是因为温度较低或较高都不利于微生物的生长繁殖,同时过高的温度对微生物酶的酶活也产生一定抑制作用,影响己酸的生成。根据图1,本研究正交试验发酵温度的3个水平选择为30℃、35℃和40℃。
2.1.2 不同接种量对生物发酵过程己酸生成量的影响
乙醇浓度5%,发酵时间10 d,发酵温度设置为35℃,己酸菌液接种量分别设置为发酵液体积的0%、5%、8%、10%、12%和15%。发酵结束后进行色谱检测分析。不同接种量条件下的己酸含量见图2。

图2 不同接种量对己酸生成量的影响
由图2可知,随着接种量的增加,己酸含量呈上升趋势,当接种量达到10%时,己酸生成量达到最大值1.22 g/L,而接种量超过10%后,己酸生成量没有增加,反而有小幅下降。可能是发酵体系中底物浓度有限,随着接种量的增加,发酵底物不能满足微生物的生长所需,导致己酸菌的生长繁殖受到抑制,造成己酸生成量逐渐下降。根据图2,本研究正交试验接种量因素的3个水平选择为8%、10%和12%。
2.1.3 不同乙醇浓度对生物发酵过程中己酸生成量的影响
发酵时间10 d,发酵温度设置为35℃,己酸菌液接种量为10%,乙醇添加量分别设置为发酵液体积的0%、2%、5%、8%和10%。另设置1个不添加己酸菌液的空白对照样。发酵结束后进行色谱检测分析。不同乙醇添加量条件下的己酸含量见图3。

图3 不同乙醇添加量对己酸生成量的影响
由图3可知,空白对照样,不同乙醇浓度下几乎都没有己酸的生成;随着乙醇添加量的增加,发酵液己酸含量呈上升趋势,乙醇添加量为5%时,己酸含量达到最大值1.22 g/L,而乙醇添加量超过5%后,己酸含量随乙醇添加量的增加而降低。适宜的乙醇含量能为微生物的生长繁殖提供碳源,乙醇浓度超过一定量后,会对己酸菌的生长繁殖产生一定的抑制作用,使生成的己酸含量减少,所以最佳乙醇添加量为5%。根据图3,本研究正交试验乙醇因素的3个水平选择为2%、5%和8%。
2.1.4 不同发酵时间对生物发酵过程己酸生成量的影响
发酵温度设置为35℃,己酸菌液接种量为10%,乙醇添加量为5%,发酵时间分别设置为5 d、8 d、10 d、12 d和15 d。设置空白对照发酵结束后进行色谱检测分析。不同发酵时间条件下的己酸含量见图4。

图4 不同发酵时间对己酸生成量的影响
由图4可知,空白对照样,不同时间段几乎都没有己酸的生成;随着发酵时间的延长,发酵液己酸含量呈上升趋势,发酵时间为10 d时己酸含量达到最大值1.26 g/L,而发酵时间超过10 d后,己酸含量随发酵时间的延长基本保持稳定。根据图4,本研究正交试验发酵时间因素的3个水平选择为8 d、10 d和12 d。
2.2 生物发酵液生成己酸培养条件的优选
2.2.1 正交试验设计
采用正交试验法对生物发酵液的培养工艺进行优选,以生成的己酸含量为评定标准,本试验选取4个因素:A(发酵温度)、B(接种量)、C(乙醇添加量)、D(发酵时间)。每个因素设3个水平,选用L9(34)正交表,以生成的己酸含量为指标进行试验,结果见表1。

表1 生物发酵液培养条件的因素-水平表L9(34)
2.2.2 生物发酵液最佳发酵工艺确定
正交试验设计结果见表2,方差分析见表3。

表2 L9(34)正交试验结果

表3 正交试验方差分析表
从统计分析结果可以看出,FA=117.874,FC=19.975,FD=5.534,P值均小于0.05。按α=0.05检验水准,可认为因素A、C、D有显著性,为主要影响因素;FB=2.865,P值大于0.05,因素B无显著性,为次要因素。根据对己酸生成量的极差R分析中可以看出,各影响因素作用的主次顺序为A>C>D>B,结合表2数据,各因素取均数估计最高者,确定最佳培养条件为:A2B3C2D1,即生物发酵液的培养条件为发酵温度35℃,接种量12%,乙醇添加量5%,发酵时间为8 d。
2.2.3 重复性试验
准确量取6份供试样品溶液各100 mL,添加50 mL无水乙醇,按上述测定方法测定己酸含量。结果RSD=1.75%,表明样品测定符合技术要求,重复性良好。
2.2.4 加样回收率试验
准确量取已知含量的供试品溶液(己酸含量为0.625 g/L)100 mL6份,置于150 mL容量瓶中,分别加入40 mg、40 mg、40 mg、60 mg、60 mg、60 mg的己酸,加无水乙醇定容至刻度,摇匀,按上述方法测定并计算加样回收率。平均回收率为96.57%,RSD为1.16%,结果见表4。
2.2.5 最佳工艺验证试验
根据所筛选的最佳工艺条件应用于生物发酵液的培养,进行3次平行试验,同法测得的己酸含量分别为 1.64 g/L、1.68 g/L和 1.65 g/L,RSD 为0.020817%,说明该工艺条件稳定、可行。
3 结论
利用黄水、己酸菌液进行生物发酵,增加了己酸含量,为下一步酯化生香奠定了重要基础。由以上研究可知,适宜的发酵温度为35℃,接种量为12%,乙醇添加量为5%,发酵时间为8 d。
正交试验的极差分析结果表明,各因素影响生物发酵液产己酸的主次顺序为发酵温度>乙醇添加量>发酵时间>接种量;正交试验方差分析结果表明,发酵温度、乙醇浓度和发酵时间变化对生物发酵液己酸的生成量影响显著,接种量对生物发酵液己酸的生成量影响不显著。在优化己酸的生成条件后,后期将进一步进行酯化、老熟、生香等研究,并将其应用于浓香型白酒的酿造生产过程中,以达到提高白酒产量和质量的目的。
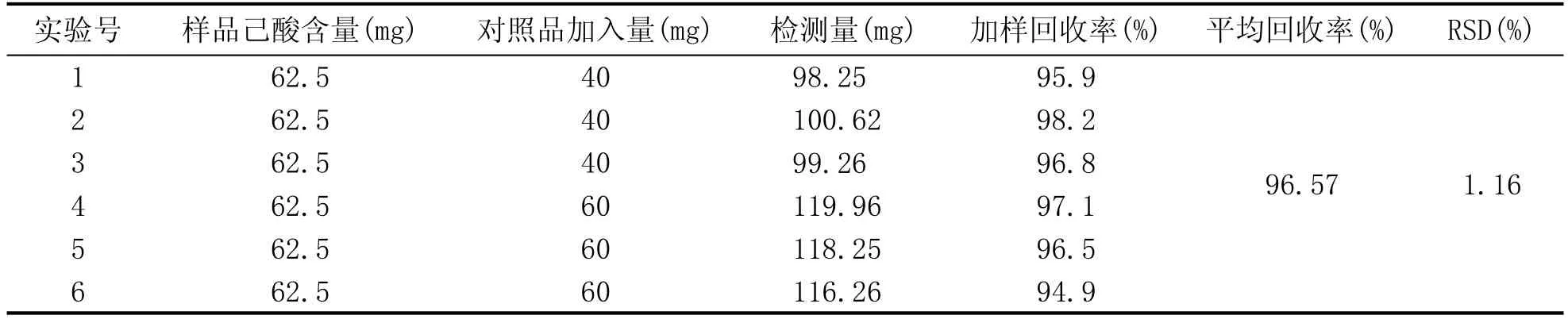
表4 加样回收率实验结果(n=6)
[1]袁春红,宋菲菲,林凯,等.白酒发酵副产物黄水中两株产纤维素酶芽孢杆菌的分离鉴定[J].中国酿造,2014,33(11):90-93.
[2]沈丽尧,冷云伟,何环,等.酿造废水处理系统中微生物多样性的分析[J].中国酿造,2012,31(10):162-165.
[3]宋杰书,钱丽华,刘宏杰.白酒酿造废水处理工艺[J].中国设备工程,2005(5):50-51.
[4]谢宜辉,钟雨.生物氧化沟工艺处理大曲酒酿造废水运行控制探讨[J].酿酒科技,2008(1):39.
[5]罗惠波,张宿义,卢中明.浓香型白酒黄水的应用探索[J].酿酒科技,2004(1):40-41.
[6]杨瑞,周江.白酒生产副产物黄水及其开发利用现状[J].酿酒科技,2008(3):90-92.
[7]宋柯,杜岗,刘念.白酒发酵副产物丢糟,黄水,底锅水中提取香味成分在酒用香料中的应用[J].酿酒科技,2008(6):82-84.
[8]吴延东,卜春文.黄水的酯化与脱色处理[J].酿酒科技,1999(1):39-40.
[9]伍显兵,卓忠惠,张庆国,等.黄水,滴窖水,己酸菌液酯化效果对比试验[J].酿酒,2004,31(1):33-35.
[10]张宿义,卢中明,周军.黄水调味液在白酒调味中的应用[J].酿酒科技,2002(3):45-46.
[11]刘琼,张跃廷.酿酒副产物黄水的综合利用[J].酿酒,2001,28(4):39-42.
[12]曹新莉,王明山.白酒生产中黄水和酒尾的应用[J].酿酒科技,2008(10):96-99.
[13]赫江华.黄水调味液在新型白酒中的应用[J].酿酒科技,2005(1):52-53.
[14]刘兴禹,张为民.浓香型白酒生产中黄水的应用[J].酿酒,2000(3):43-44.
[15]罗惠波,左勇.TH-AADY和酯化酶对黄水酯化作用的条件优化[J].四川食品与发酵,2002,38(2):24-26.
[16]杨小柏,沈才洪,赵元森.黄水功能调酒液的研制开发[J].酿酒科技,2001(6):89-90.
[17]陆鸿.正交试验设计[J].河南预防医学杂志,1999,10(2):124-126.
[18]刘瑞江,张业旺,闻崇炜,等.正交试验设计和分析方法研究[J].实验技术与管理,2010,27(9):52-55.
[19]徐仲安,王天保,李常英,等.正交试验设计法简介[J].科技情报开发与经济,2002,12(5):148-150.
[20]董如何,肖必华,方永水.正交试验设计的理论分析方法及应用[J].安徽建筑工业学院学报:自然科学版,2004,12(6):103-106.

