ZFPM2基因的低频变异通过影响GATA4转录调控参与圆锥动脉干畸形的发生
郭 晓 钱琰琰 肖德勇 陈洪波 马晓静 黄国英, 王慧君
圆锥动脉干畸形(CTA)在活产婴儿中的发生率约1/1 000[1],主要包括法洛四联症(TOF)、大动脉转位、右室双出口和肺动脉闭锁,其病因仍不明确。
心脏的发育需要多种转录因子和转录调节因子在时空上的相互作用[2~4],果蝇、斑马鱼和小鼠中的研究表明GATA4、MEF2、Nkx2.5、Tbx5和ZFPM2/FOG2蛋白在心脏发育过程中起重要作用[5]。GATA4是转录激活因子GATA家族的一员,可激活心钠素(ANF)、脑钠肽、心肌肌钙蛋白C和肌球蛋白重链等多种心脏特异性启动子的表达[6]。GATA4在胚胎期和成年心肌细胞中均呈高水平表达,Gata4敲除小鼠在早期心脏形态发生时即可出现严重缺陷而死亡[7]。ZFPM2基因含8个外显子,编码含1 151个氨基酸的转录辅因子ZFPM2/FOG2,包括8个锌指结构域、N端转录抑制结构域、核定位信号和C端结合蛋白的结合位点。ZFPM2可与GATA4的N端锌指特异性结合,激活或抑制GATA4调控的转录激活[8];ZFPM2还可以招募核小体重塑脱乙酰酶(NuRD),调节心肌细胞增殖及GATA4调控的基因表达[9]。已有研究表明,破坏ZFPM2与GATA4结合的ZFPM2突变会导致CTA[10]。Zfpm2敲除小鼠可在妊娠中期死于多种复杂的心脏畸形,包括房间隔缺损(ASD)、室间隔缺损、心室肌薄、主动脉骑跨、肺动脉狭窄、无法形成正常的冠状血管[11,12]。本研究通过对复旦大学附属儿科医院(我院)近年来收治的CTA患儿进行Sanger测序,检测ZFPM2基因的突变情况,并通过实验研究探讨突变与CTA发生的相关性及分子机制。
1 方法
1.1 研究对象 我院2012至2016年收治基于超声心动图诊断的非综合征型CTA患儿的心肌组织标本,由右室流出道梗阻手术获取。本研究经我院科研伦理委员会批准,患儿监护人均签署知情同意书。
1.2 Sanger测序法检测ZFPM2基因 ①从心肌组织中提取RNA,经反转录获得组织cDNA。 ②根据人ZFPM2基因(hZFPM2)序列(NM_012082.3)用在线引物设计软件Primer 3.0设计引物(序列见表1ZFPM2-1~5)扩增ZFPM2基因的编码外显子序列。③PCR产物经虾碱性磷酸酶(SAP)-Exonuclease I[宝生物工程(大连)有限公司]纯化后,用BigDye Terminator v3.1 cycle测序试剂盒(美国Applied Biosystems公司)和ABI 3730测序仪(美国Applied Biosystems公司)进行测序。④如发现突变,将该样本再次扩增和测序,以确认突变。⑤经公共数据库,如人类单核苷酸多态性数据库(dbSNP)和Exome Aggregation Consortium(ExAC)数据库对所发现突变进行比对。用PolyPhen-2、SIFT和Mutation Taster软件评估和预测突变体可能对ZFPM2蛋白结构和功能造成的影响。
1.3ZFPM2、GATA4表达载体和ANF启动子载体的构建及ZFPM2突变体的构建 ①分别以pDONR223-ZFPM2和pDONR223-GATA4(人的ZFPM2、GATA4基因的cDNA克隆,中国优宝生物科技有限公司)以及健康人的基因组DNA为模板经PCR(引物见表1)得到含Flag标签(DYKDDDDK)的ZFPM2编码区(长3.5 kb)、含HA标签(YPYDVPDYA)的GATA4编码区(长1.4 kb)和ANF启动子区(长2.9 kb);②将扩增得到的ZFPM2和GATA4片段分别克隆到哺乳动物表达载体pCDH质粒(美国Clontech)的NheI/NotI、NheI/EcoR位点,得到PCDH-ZFPM2(WT)和pCDH-GATA4质粒;③将ANF片段克隆到pGL3-Basic质粒(美国Promega公司),得到荧光素酶报告基因质粒pGL3-ANF;④用KOD-Plus突变试剂盒(日本TOYOBO公司)将待研究突变引入到pCDH-ZFPM2(WT),得到突变型载体pCDH-ZFPM2(Mut);④所有质粒均进行测序验证,确认序列正确。
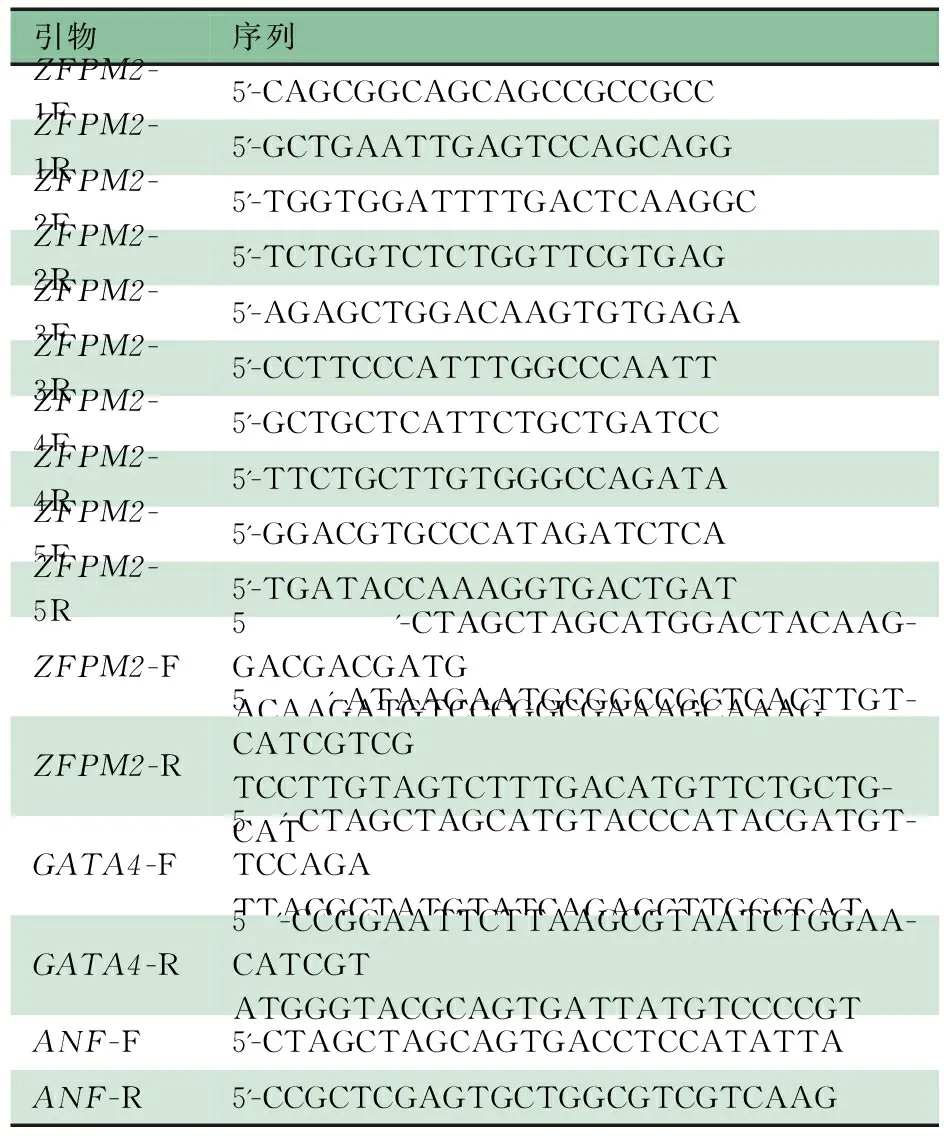
表1 Sanger测序及质粒构建的相关引物序列
1.4 野生型或突变型ZFPM2与GATA4的相互作用 采用免疫共沉淀(Co-IP)结合Western blotting的方法。 ①用含10% FBS和1%双抗的DMEM培养基(美国Gibco公司)培养人胚肾细胞株HEK293T(ATCC)和小鼠心肌细胞HL-1(广州吉妮欧生物科技有限公司),经传代后种细胞于6孔板,用ViaFect转染试剂(美国Promega公司)在细胞中共同转染pCDH-GATA4和PCDH-ZFPM2(WT)或PCDH-ZFPM2(Mut)各1μg,将转染所需质粒与Opti-MEM 200μL(美国Gibco公司)、ViaFect 12μL混匀后静置20 min,然后加到细胞中,6~8 h后每孔加入10%的FBS(美国Gibco公司)。同时设立转染pCDH-GATA4的对照组,转染方法同上;②转染48 h后,于每孔加入100 μL 1×RIPA裂解液(美国Thermo Fisher Scientific公司),收取细胞沉淀置于冰上裂解30 min,裂解结束后离心,取上清液用BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司)定量;③各组取300 ng蛋白与15μL anti-HA亲和凝胶(美国Biotool公司)于4°C旋转仪孵育过夜;④Western blotting,离心收取结合后的蛋白上清,用anti-Flag一抗(中国Abmart公司)和anti-HA一抗(中国Abmart公司)及羊抗鼠二抗(美国Invitrogen公司)以1∶3 000的工作浓度检测各组中的ZFPM2和GATA4蛋白水平,并用ECL试剂(美国Amersham公司)进行化学发光观察。经3次的独立重复实验后用Photoshop对图片进行灰度扫描,明确谱带强度和差异。
1.5 野生型或突变型ZFPM2对ANF启动子活性的影响 采用荧光素酶报告基因系统,在24孔板中种HEK293T及HL-1细胞,分为4组(每组3复孔),根据ViaFect转染试剂说明书进行质粒的共同转染,对照组转染pRL(Renilla荧光素酶报告载体,美国Promega公司)和pGL3-ANF,1组在对照组的基础上增加pCDH-GATA4表达质粒,另两组在此基础上增加pCDH-ZFPM2(WT)或pCDH-ZFPM2(Mut)表达载体。转染48 h后收集细胞裂解物,用荧光素酶检测试剂盒(美国Promega公司)检测。进行3次的独立重复实验,计算每组平均荧光素酶活性。
1.6 通过mRNA注射研究hZFPM2突变对斑马鱼心脏表型的影响 本次实验所用到的斑马鱼是野生型TU斑马鱼以及心脏特异表达GFP的转基因斑马鱼。成年斑马鱼养殖在28.5°C的标准条件下。①以pCDH-ZFPM2(WT)和pCDH-ZFPM2(Mut)为模板将野生型和突变型hZFPM2基因的编码区经PCR扩增后分别插入pGEM-T Easy载体(美国Promega公司)。随后用mMESSAGE mMACHINE SP6转录试剂盒(美国Ambion公司)在体外合成hZFPM2的加帽mRNA。②斑马鱼交配后所产的胚胎(单细胞时期)分3组,其中2组分别注射约600 pg野生型和突变型hZFPM2基因的加帽mRNA和酚红,注射成功则可以在单细胞中看到红色,另1组为对照组(不注射)。③在注射后48 h和72 h,用Leica M205C倒置显微镜仔细观察每组存活胚胎的心脏表型,包括环化,心房、心室的结构及相对位置等。④统计注射后72 h内斑马鱼胚胎的死亡数量,计算死亡率。进行3次的独立重复实验,计算每组斑马鱼心脏发育异常率。
1.7 统计学方法 用GraphPad Prism 5.0软件分析数据、绘图。Co-IP灰度扫描结果,荧光素酶报告基因实验及斑马鱼胚胎mRNA注射中的组间比较均采用t检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 共107例非综合征型CTA患儿纳入本研究,男64例,女43例,年龄1月至14岁(中位年龄8个月);包括单纯型TOF39例, TOF合并卵圆孔未闭(PFO)29例, TOF合并ASD6例, TOF合并PFO和动脉导管未闭(PDA)8例,25例为复杂表型,如房室间隔缺损(AVSD)和左位上腔静脉(LSVC)等。
2.2 CTA患儿心肌组织中ZFPM2基因的Sanger测序 图1显示,在1例TOF合并PFO的患儿中发现位于ZFPM2基因外显子4的1个杂合错义变异:c.397A>G(p.M133V),是一种罕见的仅出现在东亚人群的多态性位点(rs77117583),突变频率为0.3‰(ExAC数据库)。经Vector NTI软件分析,p.M133V位于ZFPM2蛋白的N端转录抑制结构域,该结构域对于ZFPM2调控的GATA4依赖性转录是必需的,推测该变异可能影响该基因的功能。
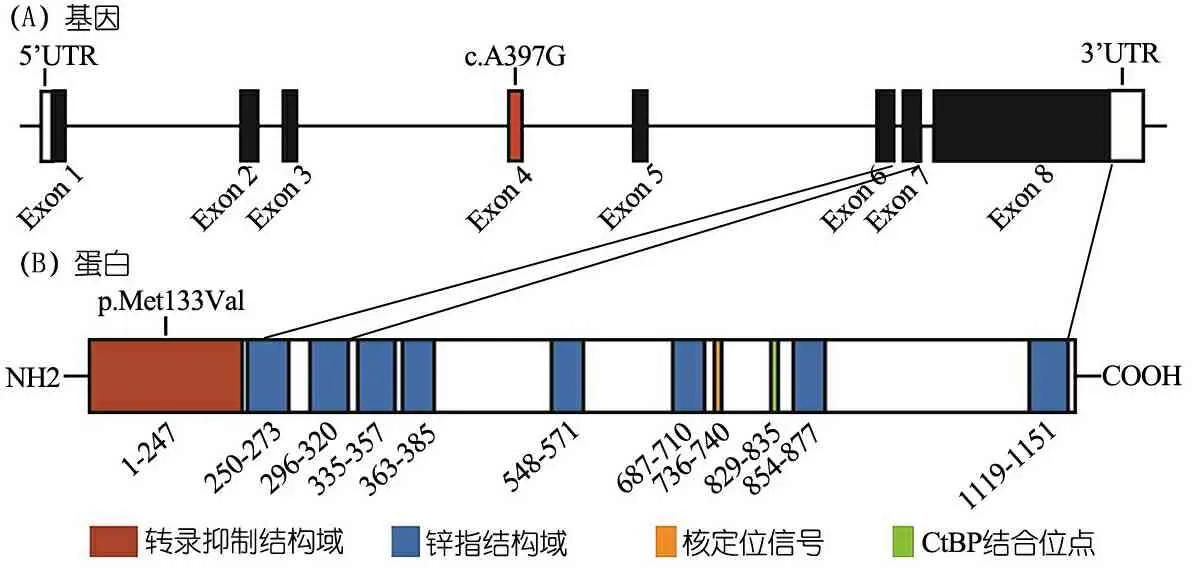
图1M133V在ZFPM2基因外显子和蛋白结构域的分布图
注 (A)c.A397G(p.M133V)位于外显子4;(B)M133V位于ZFPM2蛋白转录抑制结构域(p.Met133Val),结构域下方的数字区间代表每个功能域的氨基酸位置
2.3ZFPM2的M133V突变型与GATA4的结合能力增强并抑制ANF的GATA4依赖性转录激活 构建ZFPM2突变型载体pCDH-ZFPM2(M133V),引物序列为F:5'-GTGGACTTGAATAATAATTCTTTGAAG,R:5'-CTTCCCAGGAAACGGCCCCCAGGTTGT。
2.3.1 Co-IP 图2A显示,HEK293T细胞和HL-1细胞中结果一致,仅转染pCDH-GATA4质粒的对照组均检测不到Flag标签,同时转染PCDH-ZFPM2(WT)或PCDH-ZFPM2(M133V)质粒组均可检测到Flag标签,且后者水平高于前者(P<0.05),表明ZFPM2发生M133V突变后与GATA4的结合增强。
2.3.2 荧光素酶报告基因实验 图2B显示,HEK293T细胞和HL-1细胞中结果一致,与对照组(仅转染pRL和pGL3-ANF)相比,共同转染pCDH-GATA4质粒后平均荧光素酶活性升高3倍左右,说明GATA4是ANF启动子的转录激活因子;在此基础上增加pCDH-ZFPM2(WT)或pCDH-ZFPM2(M133V)表达质粒的转染,平均荧光素酶活性均下降(P<0.01),pCDH-ZFPM2(M133V)的抑制作用强于pCDH-ZFPM2(WT)(P<0.05),说明ZFPM2 基因可抑制GATA4对ANF的转录激活,且ZFPM2(M133V)的抑制作用较WT更强。
2.4ZFPM2的M133V突变型mRNA过表达导致斑马鱼心脏发育畸形 正常情况下,受精后48 h(48hpf)时斑马鱼胚胎心房和心室已形成有功能的心脏;从腹面观,心房与心室分别位于左右两侧且左右不对称。表2显示,对照组、 hZFPM2(WT)组和hZFPM2(M133V)组斑马鱼心脏发育异常发生率分别为11.3%、15.0%和27.5%,M133V组高于对照组和WT组(P<0.05),对照组和WT组差异无统计学意义。图3显示,对照组和WT组48和72 hpf心脏发育正常,而M133V突变体组的斑马鱼心脏发育异常,表现为48 hpf心房和心室与正常心脏呈镜像即表现为房室反位,72 hpf心房与心室近乎在同一条线上即心脏的环化发生异常。72 hpf时,M133V突变体组心脏环化异常最为明显。

图2hZFPM2M133V可与GATA4结合并抑制GATA4依赖性转录激活
注 A:HEK293T和HL-1中的Co-IP实验(lysate表示细胞总蛋白);B:HEK293T和HL-1中的ANF-荧光素酶报告基因实验;*:P<0.05,**:P<0.01
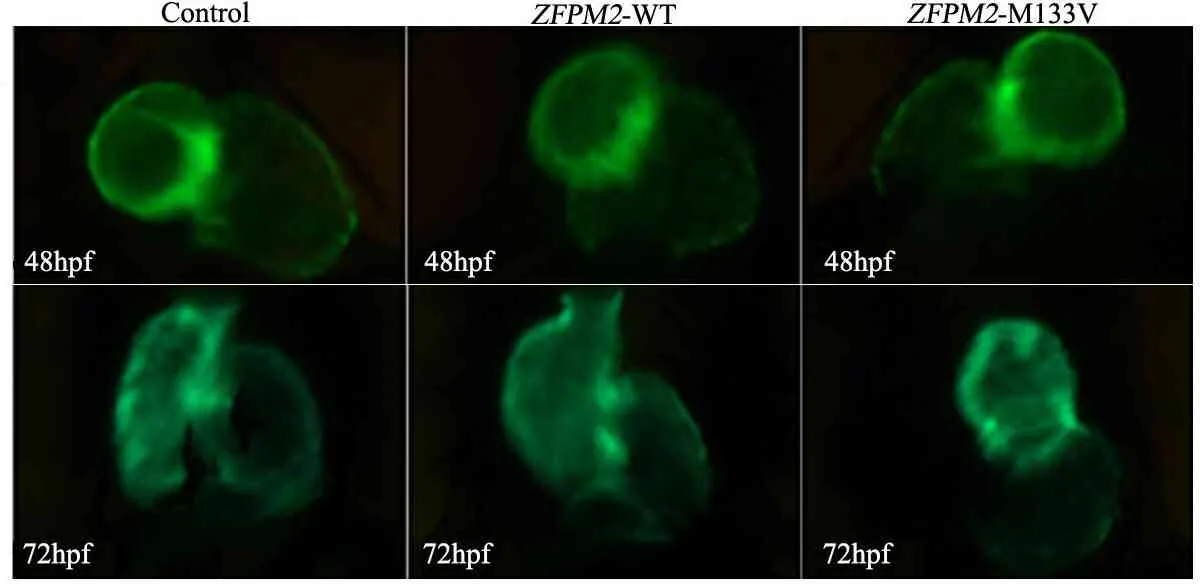
图3ZFPM2M133VmRNA过表达导致斑马鱼心脏发育畸形
注 M133V突变体注射组在48hpf房室反位,72hpf心脏环化异常
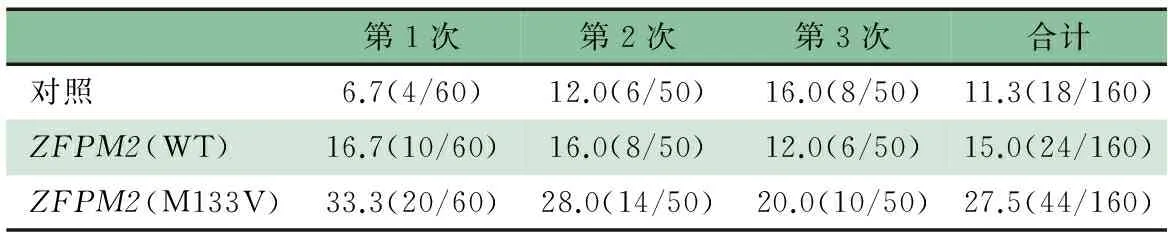
表2 斑马鱼胚胎注射hZFPM2野生型或 其M133V突变体mRNA后心脏发育异常率[%(n/N)]
此外,hZFPM2(M133V)组M133V组还有2.5%的斑马鱼表现出更加严重的畸形,包括眼睛畸形、脊柱弯曲等,其他两组并未出现类似畸形。
3 讨论
参与心脏发育与形态发生的基因主要分为3类,分别编码转录因子、信号分子和结构蛋白,这些基因突变可导致心脏畸形[13]。虽然近年来不断发现与CTA有关的新的候选基因或这些基因的致病突变,但大多数CTA的病因仍不是很清楚。
本研究对107例散发CTA患儿心肌组织中ZFPM2基因的编码区进行Sanger测序,在1例TOF合并PFO患儿中发现了1个杂合错义变异c.397A>G p.M133V(rs77117583),此突变为东亚人群所特有,突变频率为0.3‰。在我院13 000人的临床检测数据中,有6人携带此突变,其中3人有心脏超声记录,均有异常表现,包括PFO、动脉导管未闭和肺动脉流速增快。ZFPM2是心脏发育中重要的转录调控因子。此前报道的ZFPM2突变主要见于TOF和右室双出口患儿[10, 14~17]。而ZFPM2在先天性膈疝及性腺发育障碍的发生、发展中同样发挥作用,在这些患者中也发现了ZFPM2的错义突变、插入、缺失及大片段缺失等[18~22]。
由于先心病是一种微效多基因的复杂疾病,因此,在CTA患儿中检测到的基因变异在先心病中的作用机制并不清楚。一些错义突变,即使是数据库收录的致病突变,也可能出现在没有心脏畸形的人群中。因此,对于一些罕见变异或数据库收录的致病变异,有必要进行进一步的研究,分析其在先心病发病中作用。故本研究进一步开展了针对ZFPM2 M133V突变型的实验研究。
作为转录辅因子,ZFPM2主要是通过锌指1和锌指6与GATA4形成复合物来调控心脏发育[6]。锌指8上的突变也可通过影响ZFPM2与GATA4的结合参与先天性心脏病的发生[23]。小鼠实验发现,Gata4中单个氨基酸改变(V217G)后破坏了Gata4与Zfpm2的结合,小鼠表现出与敲除Zfpm2相似的心脏表型,此外还有半月瓣畸形及右室双出口,提示了ZFPM2发挥功能依赖于与GATA4的结合[11,12,24]。GATA4可以激活多种心脏特异性启动子,如ANF基因的启动子。考虑到M133V突变位于ZFPM2的N端转录抑制结构域,因此我们推测该变异会影响ZFPM2基因的功能。
Co-IP结果显示,ZFPM2基因的M133V突变体不但未破坏ZFPM2与GATA4的结合,且明显增强了二者的结合。荧光素酶报告基因实验表明,单独表达GATA4时对ANF启动子产生约3倍的转录激活;等量的GATA4与ZFPM2 野生型表达载体共同转染时会抑制GATA4的这种激活效应;等量的GATA4与ZFPM2 M133V突变体载体共同转染时,对GATA4的转录激活作用的抑制更加明显。提示M133V变异为功能获得性突变,该基因对GATA4依赖性转录激活有重要影响。
为了明确在ZFPM2基因的M133V突变是否为有害突变,本研究在斑马鱼胚胎中注射hZFPM2(M133V突变型) mRNA,发现斑马鱼心脏发育畸形率增加,而且可出现环化异常、房室反位等明显的心脏发育畸形,这一结果为M133V变异在CTA患儿中的致病性提供了支持。
[1]Zhao QM, Ma XJ, Jia B, et al. Prevalence of congenital heart disease at live birth: an accurate assessment by echocardiographic screening. Acta Paediatr, 2013, 102(4): 397-402
[2]Brand T. Heart development: molecular insights into cardiac specification and early morphogenesis. Dev Biol, 2003, 258(1): 1-19
[3]Bruneau BG. Transcriptional regulation of vertebrate cardiac morphogenesis. Circ Res, 2002, 90(5): 509-519
[4]Cripps RM, Olson EN. Control of cardiac development by an evolutionarily conserved transcriptionalnetwork. Dev Biol, 2002, 246(1): 14-28
[5]Walton RZ, Bruce AE, Olivey HE, et al. Fog1 is required for cardiac looping in zebrafish. Dev Biol, 2006, 289(2): 482-493
[6]Svensson EC, Huggins GS, Dardik FB, et al. A functionally conserved N-terminal domain of the friend of GATA-2 (FOG-2) protein represses GATA4-dependent transcription. J Biol Chem, 2000, 275(27): 20762-20769
[7]Kuo CT, Morrisey EE, Anandappa R, et al. GATA4 transcription factor is required for ventral morphogenesis and heart tube formation. Genes Dev, 1997, 11(8): 1048-1060
[8]Svensson EC, Tufts RL, Polk CE, et al. Molecular cloning of FOG-2: a modulator of transcription factor GATA-4 in cardiomyocytes. Proc Natl Acad Sci U S A, 1999, 96(3): 956-961
[9]Garnatz AS, Gao Z, Broman M, et al. FOG-2 mediated recruitment of the NuRD complex regulates cardiomyocyte proliferation during heart development. Dev Biol, 2014, 395(1): 50-61
[10]Pizzuti A, Sarkozy A, Newton AL, et al. Mutations of ZFPM2/FOG2 gene in sporadic cases of tetralogy of Fallot. Hum Mutat, 2003, 22(5): 372-377
[11]Svensson EC, Huggins GS, Lin H, et al. Asyndrome of tricuspid atresia in mice with a targeted mutation of the geneencoding Fog-2. Nat Genet, 2000, 25(3): 353-356
[12]Tevosian SG, Deconinck AE, Tanaka M, et al. FOG-2, a cofactor for GATA transcription factors, is essential for heart morphogenesis and development of coronary vessels from epicardium. Cell, 2000, 101(7): 729-739
[13]Fahed AC, Gelb BD, Seidman JG, et al. Genetics of congenital heart disease: the glass half empty. Circ Res, 2013, 112(4): 707-720
[14]De Luca A, Sarkozy A, Ferese R, et al. New mutations in ZFPM2/FOG2 gene in tetralogy of Fallot and double outlet right ventricle. Clin Genet, 2011, 80(2): 184-190
[15]Tan ZP, Huang C, Xu ZB, et al. Novel ZFPM2/FOG2 variants in patients with double outlet right ventricle. Clin Genet, 2012, 82(5): 466-471
[16]Huang X, Niu W, Zhang Z, et al. Identification of novel significant variants of ZFPM2/FOG2 in non-syndromic Tetralogy of Fallot and double outlet right ventricle in a Chinese Han population. Mol Biol Rep, 2014, 41(4): 2671-2677
[17]Zhang W, Shen L, Deng Z, et al. Novel missense variants of ZFPM2/FOG2 identified in conotruncal heart defect patients do not impair interaction with GATA4. PLoS One, 2014, 9(7): e102379[18]Ackerman KG, Herron BJ, Vargas SO, et al. Fog2 is required for normal diaphragm and lung development in mice and humans. PLoS Genet, 2005, 1(1): 58-GA
[19]Bleyl SB, Moshrefi A, Shaw GM, et al. Candidate genes for congenital diaphragmatic hernia from animal models: sequencing of FOG2 and PDGFRalpha reveals rare variants in diaphragmatic hernia patients. Eur J Hum Genet, 2007, 15(9): 950-958
[20]Wat MJ, Veenma D, Hogue J, et al. Genomic alterations that contribute to the development of isolated and non-isolated congenital diaphragmatic hernia. J Med Genet, 2011, 48(5): 299-307
[21]Bashamboo A, Brauner R, Bignon-Topalovic J, et al. Mutations in the FOG2/ZFPM2 gene are associated with anomalies of human testis determination. Hum Mol Genet, 2014, 23(14): 3657-3665
[22]Longoni M, Russell MK, High FA, et al. Prevalence and penetrance of ZFPM2 mutations and deletions causing congenital diaphragmatic hernia. Clin Genet, 2015, 87(4): 362-367
[23]Qian Y, Xiao D, Guo X, et al. Hypomethylation and decreased expression of BRG1 in the myocardium of patients with congenital heart disease. Birth Defects Res, 2017, 109(15): 1183-1195
[24]Crispino JD, Lodish MB, Thurberg BL, et al. Proper coronary vascular development and heart morphogenesis depend on interaction of GATA-4 with FOG cofactors. Genes Dev, 2001, 15(7): 839-844

