结肠癌患者SIRT6表达与病理特征的相关性
耿长辉 张春玲 曹珍珍 衣洪天 何苗 黄树民 菅晶晶 高萍
结肠癌是临床常见的消化道恶性肿瘤,发病率高,随着手术、化疗、分子靶向治疗的发展,结肠癌患者近期生存质量得到一定程度改善,但5年远期生存率仍不理想[1]。转录因子和信号通路在结肠癌病理进程中发挥重要作用,Sirtuin蛋白属NAD+依赖性组蛋白去乙酰化酶,既往报道证实Sirtuin蛋白可通过调控转录因子和信号通路,参与肿瘤细胞DNA修复、细胞增殖及凋亡过程[2]。去乙酰化酶(Sirtuin6,SIRT6)是Sirtuin蛋白的重要成员,有研究显示SIRT6蛋白与肝癌发生发展密切相关,但有关其在结肠癌中的报道尚属少见[3]。本研究纳入60例结肠癌患者作为研究对象,分析SIRT6表达与结肠癌病理特征的相关性,并对其可能的机制做初步探讨,为临床分子靶向治疗提供参考。报道如下。
资料与方法
一、一般资料
纳入2015年4月至2017年4月哈尔滨医科大学附属第五医院普外科60例结肠癌患者作为研究对象。纳入标准:(1)均经组织病理活检和结肠癌根治术确诊;(2)入院前未接受放化疗、内分泌、手术干预及其他治疗;(3)均获得患者同意并签署知情同意书。排除标准:(1)病历资料缺失者;(2)合并有其他恶性肿瘤者。60例患者中男32例,女28例;平均年龄(54.31±12.86)岁;肿瘤位置:乙状结肠17例,降结肠27例,升结肠16例;肿瘤直径(4.27±1.82)cm;分期Ⅰ期17例,Ⅱ期28例,Ⅲ期15例;高分化16例,中分化25例,低分化19例。
二、研究方法
1.Western blot法检测 SIRT6和HIF-1α:(1)设备试剂:显微镜为日本Olympus公司提供的SZ51/SZ61型光学显微镜,MK3酶标仪由上海赛摩科技生物发展有限公司提供。考马斯亮兰蛋白试剂盒由上海斯信生物科技有限公司提供,兔抗人SIRT6和缺 氧 诱 导 因 子 1α(hypoxia inducible factor-1α,HIF-1α)多克隆抗体均由英国Abcam公司提供,超敏ECL化学发光试剂盒由北京科宇深蓝科技有限公司提供;(2)标本采集:均取手术切除的结肠癌组织和癌旁组织标本,癌旁组织标本应距病灶边界5 cm以上,将标本浸泡于10%甲醛溶液12 h后,石蜡包埋切片,4 ℃保存;(3)检测方法:取0.3 cm3样本,以1:5比例依次加入适量Trizol试剂和氯仿。离心后取上层含RNA的水相层,再次离心,去上清液,室温下风干,于-80 ℃保存。采用考马斯亮兰蛋白试剂盒,并利用标准曲线计算蛋白含量。根据蛋白分子量大小配制聚丙烯酰胺分离胶和基层胶,加入适量Marker蛋白,给予80 V/h电泳电压,待样品溴酚蓝指示剂进入分离胶后,将电泳增至110 V/h,当溴酚蓝的蓝色至分离胶底部时,结束电泳。参照跑胶大小,对滤纸和聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜进行裁剪,并将PVDF膜和滤纸浸泡于缓冲液中,将凝胶、PVDF膜置于滤纸间,使各层间无气泡,在65 V/h电流条件下进行电转,2 h后停止。将PVDF膜封闭于5%牛奶封闭液中,孵育1 h后去封闭液,洗涤。将洗涤后的PVDF膜移至一抗溶液,4 ℃孵育过夜。去孵育抗体,用TBST漂洗液洗涤滤膜3次,5~10 min/次。取洗涤后的PVDF膜,再次进行二抗,操作同上。完成后将PDVF膜置于ECL中,曝光显影。
2.免疫组化法检测SIRT6:取结肠癌组织石蜡切片,依次取二甲苯、无水乙醇、乙醇及PBS溶液进行脱蜡处理,用3% H2O2灭活内源性氧化酶后,取出切片,再用PBS溶液洗涤3次,5 min/次,采用微波修复法修复抗原,将切片移至枸橼酸钠缓冲液中,微波加热至沸腾后冷却,重复1次后用PBS洗涤,取切片,封闭10 min。在切片组织中加一抗,4 ℃条件下孵育12 h,洗涤取出后加入二抗,4 ℃下孵育20 min,洗涤后在切片上加适量二氨基联苯胺显色液,在显微镜下取高倍视野(×200)观察切片组织颜色。
三、观察指标
根据Western blot法检测结果记录结肠癌组织和癌旁组织中SIRT6和HIF-1α蛋白表达水平,入院时收集患者性别、年龄基本病例资料,根据手术结果纳入肿瘤位置、直径、TNM分期及分化程度等病理资料,分析SIRT6和病理特征、HIF-1α的关系。根据免疫组化显色结果判断SIRT6蛋白性质[4],定位于细胞核,阴性:视野内棕黄色肿瘤细胞<20%,阳性:视野内棕黄色肿瘤细胞≥20%。
四、统计学分析
选用SPSS19.0统计学软件对数据进行处理,计量资料以(x±s)表示,组间比较行t检验,计数资料以(%)表示,组间比较行χ2检验,多因素采用Logistic分析,相关性采用直线线性回归分析,以P<0.05为差异有统计学意义。
结 果
一、Western blot法检测SIRT6蛋白和HIF-1α表达情况
结肠癌组织中SIRT6和HIF-1α分别为(1.87±0.65)和(1.72±0.59),癌旁组织中SIRT6和HIF-1α分别为(2.34±1.13)和(0.84±0.36),两组间比较差异显著(t=2.793,9.862;P=0.006,0.000)。见图 1~4。
二、不同病理特征患者SIRT6蛋白表达差异
60例患者结肠癌组织经免疫组化检测SIRT6蛋白阳性13例,阴性47例,SIRT6不同表达水平患者间肿瘤分期和分化程度差异显著(χ2=7.651,9.346;P=0.022,0.009)。见表 1,图 5~6。
三、SIRT6蛋白表达多因素分析
将差异有统计学意义的指标赋值并纳入多因素分析模型,赋值如下:分期(Ⅰ期=0,Ⅱ期=1,Ⅲ期=2),分化(高分化=0,中分化=1,低分化=2)。经多因素分析显示肿瘤分期是影响SIRT6蛋白表达水平的独立因素(P<0.05)。见表2。
四、Western blot法检测SIRT6和HIF-1α蛋白表达相关性分析
结肠癌患者癌组织中SIRT6蛋白表达与HIF-1α水平呈显著负相关性(r=-0.819,P=0.000),见图7。
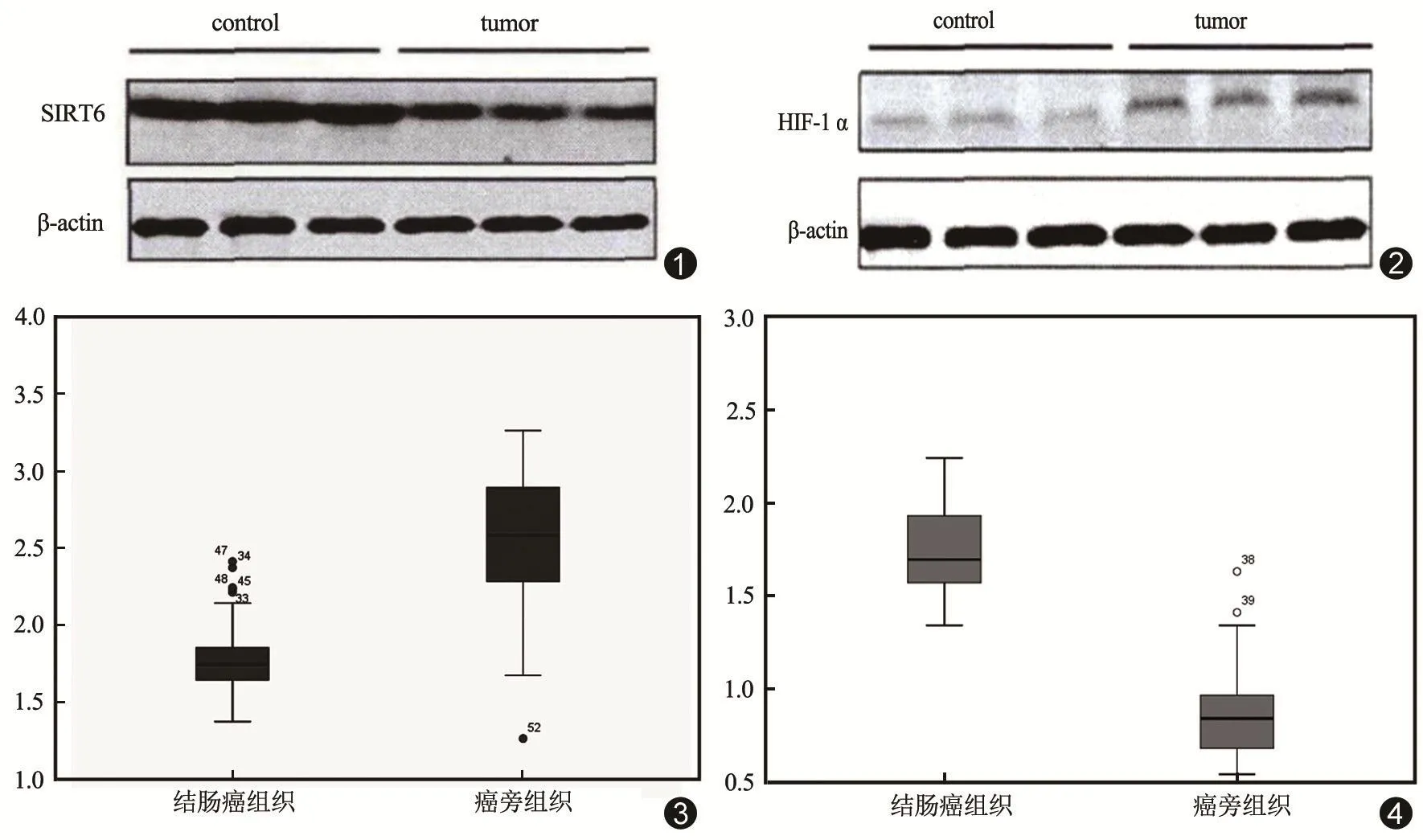
图1 Western blot法检测SIRT6/β-action 图2 Western blot法检测HIF-1α/β-action 图3 SIRT6在结肠癌和癌旁组织中表达 图4 HIF-1α在结肠癌和癌旁组织中表达
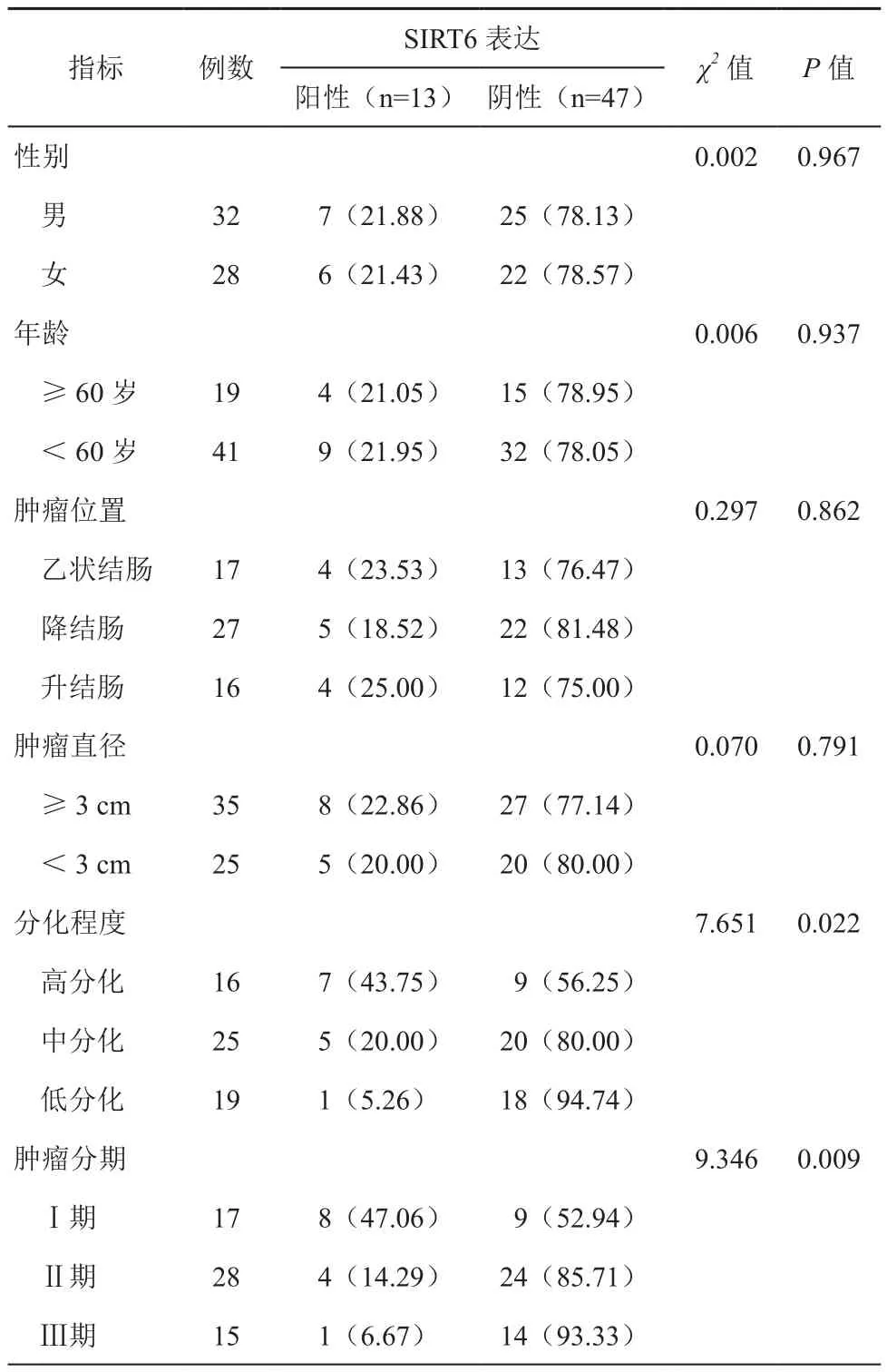
表1 不同病理特征患者SIRT6表达差异(例,%)
讨 论
国内有报道显示结肠癌发病率居恶性肿瘤第4位,且呈年轻化趋势[5],既往报道显示癌胚抗原、癌抗原125、基质金属蛋白酶-2及磷脂酰肌醇激酶-3等分子标志物与结肠癌关系密切,但上述标志物缺乏特异性,均不能用于指导结肠癌分子靶向治疗[6-8]。SIRT6是Sirtuin蛋白的重要成员,具有去乙酰环酶和ADP-核糖基转移酶催化活性作用,可与抑癌因子泛素特异性蛋白酶10协同作用,抑制肿瘤细胞增殖分化,对肿瘤细胞的基因表达、DNA修复及生产代谢过程均具有重要的调节作用[9-11]。

图5 SIRT6在结肠癌组织中阴性表达(×10)图6 SIRT6在结肠癌癌旁组织中阳性表达(×10)
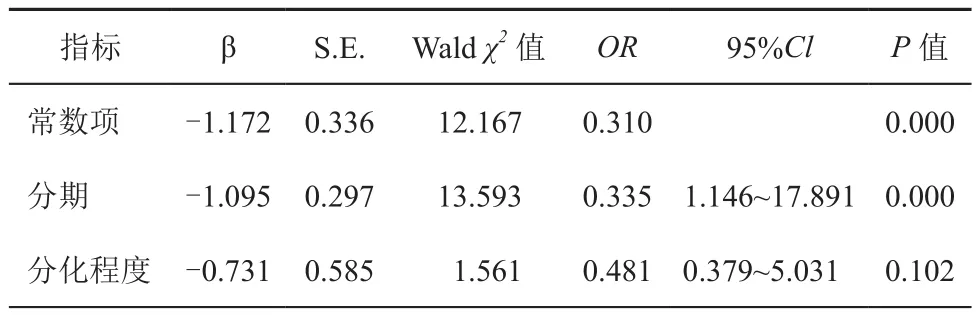
表2 SIRT6蛋白表达多因素分析
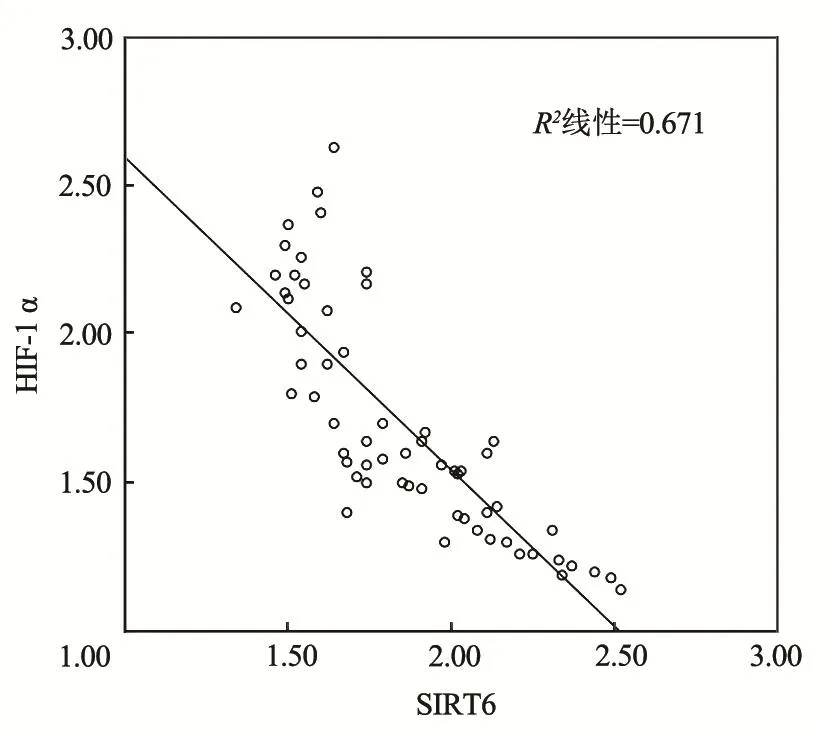
图7 SIRT6和HIF-1α相关性分析
本研究采用Western blot法检测结肠癌和癌旁组织中的表达,发现癌组织中SIRT6蛋白表达水平显著低于癌旁正常组织,提示结肠组织中SIRT6蛋白表达水平降低可能存在癌变风险,动物实验显示敲除SIRT6蛋白后小鼠肿瘤数量和大小增加,侵袭性增强[12],提示SIRT6蛋白对结肠癌进展可能存在保护作用,说明SIRT6蛋白在结肠癌病理进程中发挥重要作用。为此,本研究采用免疫组化法调查结肠癌患者SIRT6蛋白性质,分析SIRT6蛋白和结肠癌病理特征的关系,结果发现结肠癌TNM分期是影响SIRT6蛋白表达水平的独立因素,提示随着肿瘤分期的进展和浸润深度的恶化,SIRT6蛋白表达被抑制,齐佳等[13]还认为SIRT6蛋白在结肠癌基因转录阶段便出现缺失,提示SIRT6蛋白不仅参与结肠癌病理进程,其表达缺失还可能作为结肠癌变的标记物,但这有待进一步大样本证实。另外,糖酵解能力增强是结肠癌患者典型的能量代谢特点[14],SIRT6高表达能降低皮下脂肪和甘油三酯含量,纠正葡萄糖和胰岛素水平,改善代谢障碍状态。蒲诗云等[15]研究也认为SIRT6能促进氧化磷酸化,这对延缓肿瘤进展具有重要意义,与本文结论一致。
HIF-1α是细胞代谢过程中重要的调控因子,与HIF-1β形成复合物,参与相关信号通路的转录活化,A Prigione等[16]研究发现HIF-1α能上调己糖激酶2和丙酮酸脱氢酶激酶-I表达水平,参与结肠癌发生发展。本研究也显示SIRT6与HIF-1α具有显著负相关性,说明SIRT6可通过调节HIF-1α表达,参与结肠癌病理进展。另有报道显示SIRT6能调节HIF-1α水平,进而启动H3K9去乙酰化,下调其表达水平,抑制肿瘤细胞代谢途径[17],这可能是SIRT6发挥保护结肠癌进展的作用机制之一。但临床也有报道显示SIRT6可能具有促进肿瘤进展的作用,提示SIRT6可能具有异质性[18],此外本研究样本量小,研究结果有待大样本证实。
综上,结肠癌SIRT6表达水平与患者临床病理分期具有显著相关性,SIRT6高表达有助于抑制肿瘤进展,这可能与SIRT6蛋白调控HIF-1α水平有关。
[ 1 ] 刘清华, 陈依红.结肠癌根治术后5年无病生存率影响因素分析 [J]. 结直肠肛门外科, 2017, 23(1): 27-31.
[ 2 ] Ueno T, Endo S, Saito R, et al. The sirtuin inhibitor tenovin-6 upregulates death receptor 5 and enhances cytotoxic effects of 5-fluorouracil and oxaliplatin in colon cancer cells [J]. Oncology Research, 2013,21(3): 155.
[ 3 ] 陶娜娜, 周洪钟, 任吉华, 等.Sirtuin 6对肝癌细胞增殖的影响 [J].中国病理生理杂志, 2016, 32(6): 1031-1036.
[ 4 ] 张子杰.结肠癌组织VEGF表达与树突状细胞浸润的临床意义及与血清VEGF浓度及其活化水平的相关性 [J]. 中国免疫学杂志, 2015, 31(9): 1257-1261.
[ 5 ] 张玥, 石菊芳, 黄慧瑶, 等.中国人群结直肠癌疾病负担分析 [J].中华流行病学杂志, 2015, 36(7): 709-714.
[ 6 ] 卢灿荣, 张士武, 张勇, 等.联合检测癌胚抗原、糖链抗原19-9和C反应蛋白对结肠癌的诊断价值 [J]. 标记免疫分析与临床,2012, 19(1): 3-6.
[ 7 ] 陈伟, 王贵玉, 陈瑛罡, 等.1810例左、右半结肠癌临床病理分析 [J]. 中华结直肠疾病电子杂志, 2013, 2(4): 162-165.
[ 8 ] Banday MZ, Sameer AS, Mir AH, et al. Matrix metalloproteinase(MMP) -2, -7 and -9 promoter polymorphisms in colorectal cancer in ethnic Kashmiri population -- A case–control study and a mini review [J]. Gene, 2016, 589(1): 81-89.
[ 9 ] Bakiri L. Liver cancer initiation is controlled by AP-1 through SIRT6-dependent inhibition of survivin [J]. Nature Cell Biology,2012, 14(11): 1203.
[ 10 ] Rizzo A, Iachettini S, Salvati E, et al. SIRT6 interacts with TRF2 and promotes its degradation in response to DNA damage [J]. Nucleic Acids Research, 2016, 45(4): 1820.
[ 11 ] 井浩人, 周毅.miR-33a通过抑制SIRT6的表达促进结直肠癌细胞的增殖 [J]. 临床医学研究与实践, 2017, 2(25): 5-8.
[ 12 ] 周玥, 王亚平, 王建伟, 等.三丁基过氧化氢体外诱导造血干/祖细胞衰老中的SIRT6/NF-κB信号轴 [J]. 中国组织工程研究,2014, 18(37): 5967-5971.
[ 13 ] 齐佳, 崔春晖, 陈日红, 等.SIRT6在结直肠癌组织中的表达及其临床意义 [J]. 安徽医科大学学报, 2017, 52(2): 281-285.
[ 14 ] 来伟, 施景龙, 林显敢, 等.肿瘤抑制基因N-myc下游调节基因2调节结肠癌细胞糖代谢 [J]. 中华实验外科杂志, 2016, 33(11):2533-2534.
[ 15 ] 蒲诗云, 邝江莹, 何金汗.SIRT6在能量代谢中的作用 [J]. 生理科学进展, 2014, 45(6): 448-452.
[ 16 ] Prigione A, Rohwer N, Hoffmann S, et al. HIF1 modulates cell fate reprogramming through early glycolytic shift and upregulation of PDK1-3 and PKM2. [J]. Stem Cells, 2014, 32(2): 364.
[ 17 ] Liu C, Huang Z, Jiang H, et al. The sirtuin 3 expression profile is associated with pathological and clinical outcomes in colon cancer patients [J]. Biomed Research International, 2014, 2014(5795):871263.
[ 18 ] 董振, 雷倩, 刘力超, 等.长寿蛋白SIRT6在肿瘤发生发展中的作用 [J]. 生物工程学报, 2016, 32(7): 870-879.

