婴幼儿配方食品和成人营养品中脂溶性维生素A和维生素E标准测定方法的比较
, , , , ,
(1. 江南大学 食品科学与技术国家重点实验室, 无锡 214122; 2. 上海市疾病预防控制中心, 上海 200336; 3. 雅培营养中国研发中心, 上海 201203)
维生素A(VA)是视黄醇及其衍生物,如视黄醛、视黄酸、视黄醇乙酸酯、视黄醇棕榈酸酯等一系列化合物的总称[1],具有维持视觉等多种生理功能,通常用于防治夜盲症、干眼病等[1-2]。然而,大量摄入VA会产生副作用,成人的摄入量不超过3 mg·d-1,儿童不能超过2 mg·d-1[3]。维生素E(VE)又名抗不育维生素或生育酚,是生育酚、生育三烯酚及其能够显示d-α-生育酚生物活性的衍生物的总称[4],具有抗不育功能和抗氧化作用[5]。
目前VA和VE的测定通常采用高效液相色谱法(分为反相色谱法和正相色谱法)。反相色谱法通常用碱性乙醇-水溶液对样品进行皂化,水解除去脂肪并将VA和VE从酯的形式分别转化为视黄醇和生育酚的形式[6-21],然后用大量有机溶剂(如石油醚、乙醚或正己烷等)提取皂化后的VA和VE,提取液经过水洗、脱水干燥、溶剂蒸发、吹干和复溶等实现目标化合物的浓缩和溶剂的转换,这些操作和转移不仅降低了工作效率,而且可能造成VA和VE的损失,而且研究表明皂化会对VE造成破坏[22-24]。油脂可以直接进入正相色谱[25],因此正相色谱法不需要对样品进行皂化,通常用乙醇[25]或甲醇[26-27]沉淀蛋白后,直接用有机溶剂提取原始形式的VA和VE。与皂化-反相色谱法相比,直接提取-正相色谱法预处理条件温和,提取过程简单方便、工作效率高,可以区分视黄醇棕榈酸酯、视黄醇乙酸酯、α-生育酚乙酸酯和α-生育酚等4种化合物。
国家标准方法GB/T 5009.82-2003[9]和GB 5413.9-2010[10]属于皂化-反相色谱法,可以较彻底地除去脂类干扰物,适用于食品中VA和VE的测定。国际标准方法AOAC Offcial Method 2012.10[27](AOAC法)属于直接提取-正相色谱法,是针对目前强化食品中通常添加的视黄醇棕榈酸酯、视黄醇乙酸酯、α-生育酚乙酸酯和α-生育酚而建立的。国家标准方法预处理繁琐冗杂、效率低下;AOAC法简单方便、工作效率高,可以在婴幼儿配方食品和成人营养品批量日常检测中对国家标准方法进行补充和替代。为了将AOAC法应用于日常检测,有必要对两种方法进行比对,但是目前还没有相关的研究。本工作基于现有试验条件,对国家标准方法和AOAC法进行了适用性改变,并比较了两种方法对多种配方食品的测定结果。
1 试验部分
1.1 仪器与试剂
Agilent 1100型高效液相色谱仪,配四元泵、在线真空脱气机、柱温箱、自动进样器、二极管阵列检测器(DAD)和Chemstation色谱工作站;岛津LC 20A型高效液相色谱仪,配低压四元泵、在线真空脱气机、柱温箱、自动进样器、光电二极管阵列检测器(PDA)和LC solution色谱工作站;普析TU-1950型紫外分光光度计;DK-S16型电热恒温水浴锅;VORTEX-GENIE 2型涡旋振荡器;IKA RV10型旋转蒸发仪;IKA KS 501型圆周振荡摇床;DJ-TDL-50A型台式低速大容量离心机。
视黄醇、α-生育酚标准储备溶液:分别称取视黄醇10 mg、α-生育酚50 mg于100 mL棕色容量瓶中,用乙醇溶解并稀释至刻度,于-20 ℃保存。并按照GB 5413.9-2010方法进行标定。
视黄醇棕榈酸酯、视黄醇乙酸酯、α-生育酚乙酸酯、α-生育酚标准储备溶液:分别称取视黄醇棕榈酸酯20 mg、视黄醇乙酸酯20 mg、α-生育酚乙酸酯40 mg和α-生育酚40 mg于10 mL棕色容量瓶中,用异辛烷溶解并稀释至刻度,于-20 ℃保存。并按照AOAC Official Method 2012.10进行标定。
木瓜蛋白酶溶液:20 g·L-1,称取对苯二酚100 mg和无水乙酸钠4 g溶解于80 mL水中,用23%(体积分数)盐酸溶液调节其pH至5.0,加入木瓜蛋白酶2 g,溶解后用水定容至100 mL。临用前配制。
乙醇、甲醇、叔丁基甲醚、正己烷、异辛烷为色谱纯;盐酸、冰乙酸、氢氧化钾、无水硫酸钠和无水乙酸钠为分析纯;试验用水为超纯水。
1.2 色谱条件
1) 岛津LC 20A型高效液相色谱仪 用Venusil XBP NH2色谱柱(2.1 mm×150 mm,5 μm)代替原方法中的Zorbax NH2色谱柱(4.6 mm×150 mm,5 μm);柱温为30 ℃;进样体积为10 μL。在检测α-生育酚乙酸酯和α-生育酚时用PDA检测器代替原方法中的荧光检测器,视黄醇棕榈酸酯和视黄醇乙酸酯的检测波长为325 nm,α-生育酚乙酸酯和α-生育酚的检测波长为284 nm。流动相:A为正己烷,B为正己烷-叔丁基甲醚(75+25)混合液(含体积分数为0.3%的甲醇作为改良剂)。在原方法的基础上,通过改变流量和平衡时间得到最终的洗脱程序:0~6.0 min,A为100%,流量为0.15 mL·min-1;6.0~8.0 min,A由100%降为75%,流量保持不变;8.0~8.1 min时,A由75%降为0,流量由0.15 mL·min-1增加至0.5 mL·min-1,并保持6.9 min;15.0~15.1 min时,A由0增加至100%,流量不变,并保持14.9 min。
2) Agilent 1100型高效液相色谱仪 Diamonsil C18色谱柱(150 mm×4.6 mm,5 μm);柱温为35 ℃;流动相为甲醇,等度洗脱;流量1.0 mL·min-1;进样体积为20 μL;α-生育酚和视黄醇的检测波长分别为292,325 nm。
1.3 试验方法
1) AOAC法 参考AOAC Offcial Method 2012.10,操作如下:称取粉末试样0.50~0.55 g于50 mL离心管中,加入约40 ℃的水5 mL溶解,或移取液态试样5.00 mL于50 mL离心管中。向离心管中加入20 g·L-1木瓜蛋白酶溶液5 mL,于(37±2) ℃的水浴中酶解约20 min,4 ℃冷却约20 min。加入冰乙酸-甲醇(2+98)混合液20 mL,混匀,加入异辛烷10 mL,用机械摇床剧烈振摇提取10 min,以4 000 r·min-1转速离心10 min,取上清液直接进样。整个分析过程要避光。
2) 国家标准方法 参考GB/T 5009.82-2003和GB 5413.9-2010,操作如下:称取粉末试样1.00 g或移取液态试样10.00 mL于100 mL皂化瓶中,加入无水乙醇30 mL、100 g·L-1维生素C溶液5 mL和500 g·L-1氢氧化钾溶液10 mL,沸水浴中回流皂化约30 min。皂化液迅速用冷水冷却,转移至250 mL分液漏斗中,依次用25 mL水、50 mL石油醚各洗涤皂化瓶两次后,并入分液漏斗,剧烈振摇提取约1 min,静置分层,弃去下层水相。石油醚提取液水洗至近中性,用无水硫酸钠过滤脱水,并转移至旋转蒸发瓶中,于40 ℃、3×104Pa下旋转蒸发至约2 mL,氮气吹干,用2 mL乙醇复溶,过0.22 μm聚偏氟乙烯(PVDF)滤膜后进样。按照GB 5413.9-2010,采用外标法定量。整个分析过程要避光。
2 结果与讨论
2.1 AOAC法检测器的改变
在测定α-生育酚乙酸酯和α-生育酚时用PDA检测器代替原方法中的荧光检测器。由于婴幼儿配方食品和成人营养品中上述两种化合物的含量较高,PDA的灵敏度能够满足它们的检测要求。实际样品中α-生育酚乙酸酯和α-生育酚在190~400 nm下所有波长扫描点的色谱图见图1。
由图1可知:实际样品中α-生育酚乙酸酯和α-生育酚在190~400 nm下所有波长扫描点的色谱图形状对称、一致,表明改变检测器后两种化合物的检测不受杂峰干扰。

(a) α-生育酚乙酸酯

(b) α-生育酚图1 样品中α-生育酚乙酸酯和α-生育酚在190~400 nm下所有波长扫描点的色谱图Fig. 1 Chromatograms of α-tocopherol acetate and α-tocopherol in the samples of all wavelength scan points from 190 to 400 nm
2.2 色谱图
采用AOAC法对视黄醇棕榈酸酯、视黄醇乙酸酯、α-生育酚乙酸酯、α-生育酚混合标准溶液(其中含6.5 mg·L-1视黄醇棕榈酸酯,2.5 mg·L-1视黄醇乙酸酯,84 mg·L-1α-生育酚乙酸酯,145 mg·L-1α-生育酚)和质控样SRM 1849a(婴幼儿/成人营养食品标准品)进行分析,色谱图依次见图2和图3。
由图2和图3可知:VA和VE的4种化合物能够很好地分离,视黄醇棕榈酸酯和视黄醇乙酸酯的13-顺式和全反式异构体能够实现基线分离,且4种化合物峰形尖锐、对称性好。视黄醇棕榈酸酯在混合标准溶液中只有全反式的异构体,在样品中有13-顺式和全反式两种异构体;质控样SRM 1849a中VA只有视黄醇棕榈酸酯一种化合物,没有视黄醇乙酸酯。
采用国家标准方法对视黄醇、α-生育酚混合标准溶液(其中含4.75 mg·L-1视黄醇,185 mg·L-1α-生育酚)和质控样SRM 1849a(婴幼儿/成人营养食品标准品)进行分析,色谱图依次见图4和图5。

(a) 325 nm (b) 284 nm2-全反式视黄醇棕榈酸酯;3-13-顺-视黄醇乙酸酯;4-全反式视黄醇乙酸酯;5-α-生育酚乙酸酯;6-α-生育酚图2 AOAC法分析混合标准溶液的色谱图Fig. 2 Chromatograms of mixed standard solution with AOAC method

(a) 325 nm (b) 284 nm1-13-顺-视黄醇棕榈酸酯,其余各峰号对应的化合物同图2图3 AOAC法分析质控样的色谱图Fig. 3 Chromatograms of quality control sample with AOAC method

(a) 325 nm (b) 292 nm1-视黄醇;2-α-生育酚图4 国家标准方法分析混合标准溶液的色谱图Fig. 4 Chromatograms of mixed standard solution with the GB method
由图4和图5可知:皂化后视黄醇棕榈酸酯和视黄醇乙酸酯都转化为视黄醇,α-生育酚乙酸酯转化为α-生育酚,没有杂峰干扰。
2.3 样品分析
11种市售婴幼儿配方食品和成人营养品,随机编为1~11号,除了4,6,8号为液体外其余为固体粉末。
采用AOAC法和国家标准方法对质控样SRM 1849a和11种婴幼儿配方食品和成人营养品样品进行分析,其中质控样SRM 1849a平行测定3次。AOAC法测定视黄醇棕榈酸酯、视黄醇乙酸酯、α-生育酚乙酸酯以及α-生育酚等4种化合物,国家标准方法测定皂化后的视黄醇和α-生育酚,为了方便比较两种方法的测定结果,将VA和VE测定结果折算为视黄醇和α-生育酚。

(a) 325 nm (b) 292 nm1-视黄醇;2-α-生育酚图5 国家标准方法分析质控样的色谱图Fig. 5 Chromatograms of quality control sample with the GB method
质控样SRM 1849a的分析结果见表1。
由表1可知:两种方法都可以准确测定VA含量,VE的测定值基本处于认定值范围内,但是AOAC法测定VE更准确。11种乳粉(液)样品测定结果见表2,表2中粉末样品的测定值单位是mg·kg-1,液体产品测定值的单位是mg·L-1。

表1 质控样SRM 1849a的分析结果Tab. 1 Analytical results of quality control sample SRM 1849a mg·kg-1
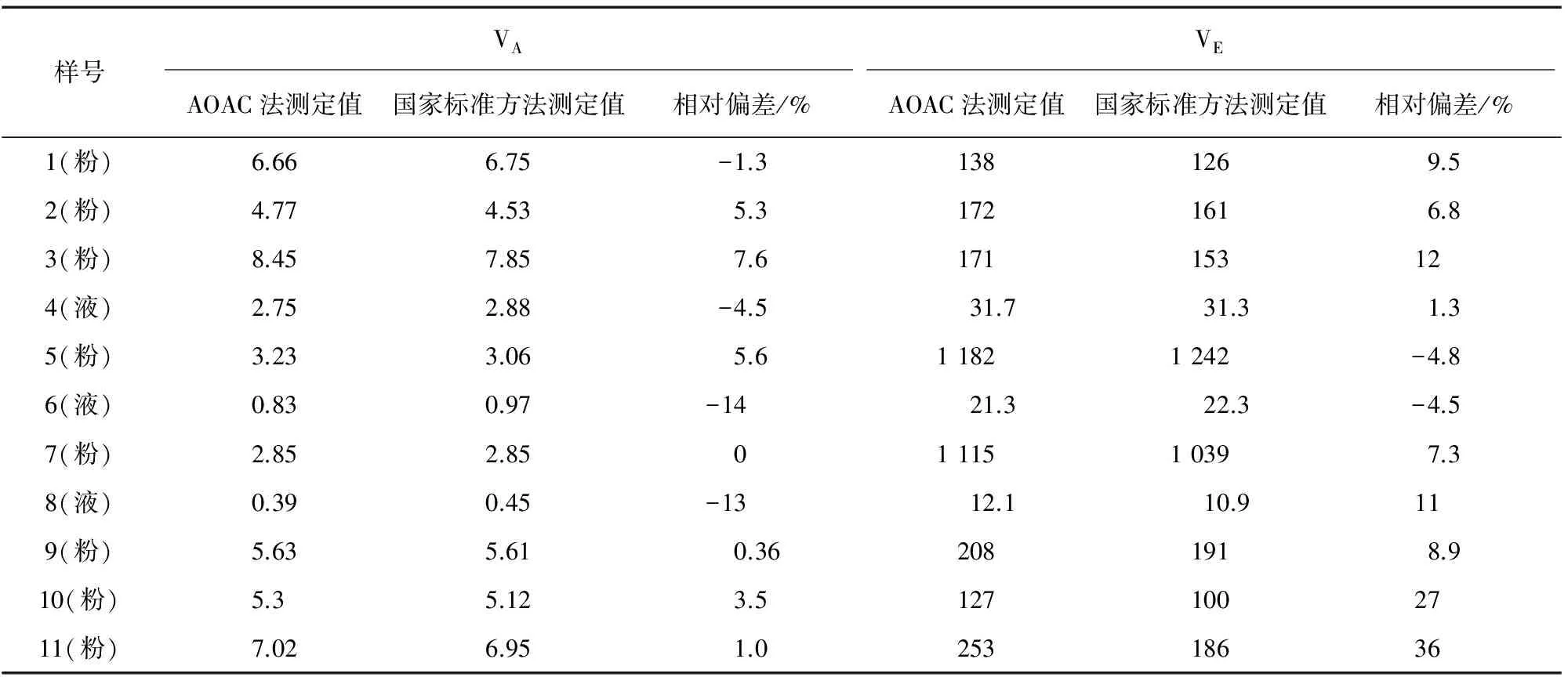
表2 11种样品的分析结果Tab. 2 Analytical results of the 11 samples
由表2可知:两种方法对VA和VE的测定结果基本是一致的,但是国家标准方法对VE的测定结果比AOAC法的测定结果稍低。由试验结果还可知:11种样品中只有一种含有视黄醇乙酸酯,说明配方食品生产中VA的添加形式通常是视黄醇棕榈酸酯。
2.4 国家标准方法的准确度试验
移取适量视黄醇棕榈酸酯、视黄醇乙酸酯、α-生育酚乙酸酯和α-生育酚的标准储备溶液,按照国家标准方法进行皂化处理和测定,其准确度试验结果见表3。
由表3可知:视黄醇棕榈酸酯和视黄醇乙酸酯的相对误差分别为0,1.6%,α-生育酚乙酸酯的相对误差为-5.1%,α-生育酚的相对误差为-14%,进一步证明了国家标准方法对VE的测定结果稍微偏低。VE作为天然的抗氧化剂,性质不稳定、极易氧化破坏,因此对操作过程的保护要求较高,试验条件不足,操作不慎均会导致结果偏低。
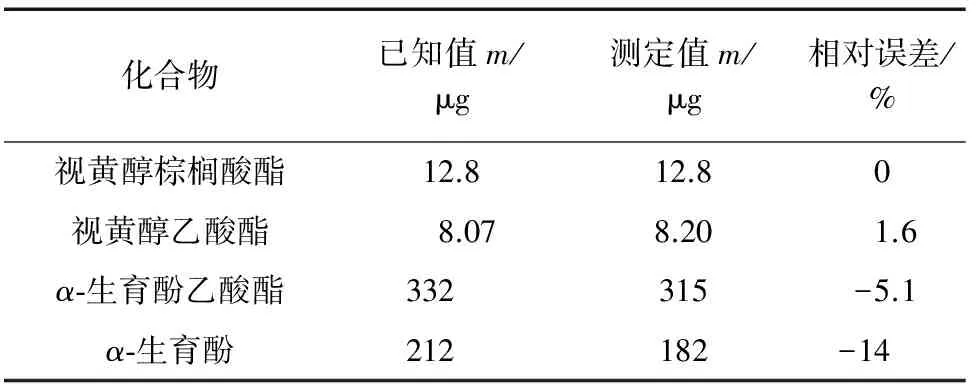
表3 国家标准方法的准确度试验结果Tab. 3 Results of test for accuracy of the GB method
本工作通过AOAC法、国家标准方法对质控样SRM 1849a和多种配方食品进行分析,从测定结果可知,AOAC法、国家标准方法对VA和VE的测定结果基本一致,并且AOAC法对VE的测定更加准确。AOAC法的预处理简单方便、条件温和、工作效率高。将AOAC法应用于婴幼儿配方食品和成人营养品中VA和VE的日常检测是切实可行的,但能否实现这一目标还需要多实验室进行国家标准方法与AOAC法的比对。
[1] 朱志伟.最早被发现的维生素——维生素A[J].大学化学, 2010,25(增1):54-56.
[2] 李专成.维生素A合成工艺评述[J].化学工程与装备, 2009(2):95-100.
[3] 刘亚军.维生素A缺乏症的预防与治疗[J].中外健康文摘, 2009,6(5):73-74.
[4] 宋晓燕,杨天奎.天然维生素E的功能及应用[J].中国油脂, 2000,25(6):45-47.
[5] 尤新.天然维生素E的功能和开发前景[J].食品工业科技, 2000,21(4):5-6.
[6] 黄挺,张伟,刘军,等.高效液相色谱法-同位素稀释质谱联用法对奶粉中维生素A含量的检测[J].分析测试学报, 2008,27(1):195-196.
[7] 张艳海,朱晓艳,曹国洲,等.在线二维柱切换-高效液相色谱法同时测定婴幼儿强化奶粉中维生素A,D3和E的含量[J].分析化学, 2013,41(5):771-775.
[8] 黄诚,林胜军.直接皂化-高效液相色谱法测定奶粉中维生素A和E[J].生命科学仪器, 2012,10(2):3-5.
[9] GB/T 5009.82-2003 食品中维生素A和维生素E的测定[S].
[10] GB 5413.9-2010 婴幼儿食品和乳品中维生素A、D、E的测定[S].
[11] DEVRIES J W, SLIVERA K R, MCSHERRY E, et al. Determination of vitamin A (retinol) in infant formula and adult nutritionals by liquid chromatography: First action 2011.15[J]. Journal of AOAC International, 2012,95(2):322-328.
[12] TURNER C, MATHIASSON L. Determination of vitamins A and E in milk powder using supercritical fluid extraction for sample clean-up[J]. Journal of Chromatography A, 2000,874(2):275-283.
[13] 孙亚兰,李帮锐,黎冠,等.反相高效液相色谱法测定奶粉中维生素A和维生素E异构体[J].中国卫生检验杂志, 2013,23(3):612-615.
[14] 陈万勤,王瑾,黄丽英,等.高效液相色谱法同时测定配方乳粉中7种脂溶性维生素[J].分析科学学报, 2013,29(1):109-112.
[15] 郑菲菲,赖世云,陶保华,等.高效液相色谱法同时测定人乳中视黄醇、α-生育酚和类胡萝卜素[J].食品安全质量检测学报, 2014,5(7):2066-2072.
[16] 李颂群,陈胜楠,李征.冷皂化-HPLC法测定乳及乳制品中的维生素[J].中国乳品工业, 2013,41(10):40-42.
[17] 钱疆,余孔捷,杨方.液相色谱电化学安培检测乳粉中的脂溶性维生素A,E和D3[J].分析测试技术与仪器, 2006,12(3):176-180.
[18] 谢玉珊,林海丹,官咏仪,等.液相色谱法测定婴幼儿配方食品中维生素A和E质量分数[J].中国乳品工业, 2014,42(3):59-61.
[19] 甘露,黄明元.液相色谱法同时测定乳制品中的胆固醇和维生素A[J].科技信息, 2010(22):14-15.
[20] 王玉堂,池涛,胡本涛,等.婴儿配方粉中维生素A、D、E测定的关键影响因素研究[J].中国食品学报, 2013,13(12):232-236.
[21] 张艳海,其布勒哈斯,金燕,等.在线二维液相色谱法同时测定婴幼儿和成人配方营养品中的维生素A、D3和E[J].色谱, 2015,33(3):291-297.
[23] GIMENO E, CASTELLOTE A I, LAMUELA-RAVENTOS R M, et al. Rapid determination of vitamin E in vegetable oils by reversed-phase high-performance liquid chromatography[J]. Journal of Chromatography A, 2000,881(1/2):251-254.
[24] RAMMELL COLIN G, HOOGENBOOM JACOBUS J L. Separation of tocols by HPLC on an amino-cyano polar phase column[J]. Journal of Liquid Chromatography, 2006,8(4):707-717.
[26] THOMPSON L B, SCHIMPF K, BAUGH S. Determination of vitamins A and E in infant formula and adult/pediatric nutritional formula by HPLC with UV and fluorescence detection: First action 2012.09[J]. Journal of AOAC International, 2013,96(6):1407-1413.
[27] MCMAHON A, CHRISTIANSEN S, SHINE L, et al. Simultaneous determination of 13-cis and all-trans vitamin A palmitate (retinyl palmitate), vitamin A acetate (retinyl acetate), and total vitamin E (α-tocopherol and DL-α-tocopherol acetate) in infant formula and adult nutritionals by normal phase HPLC: First action 2012.10[J]. Journal of AOAC International, 2013,96(5):1073-1081.

