槲皮素对慢性酒精暴露小鼠肝脏自噬的调控
李艳艳,于 微,冯里茹,郭小萍,姚 平,王 俊
(1. 深圳市慢性病防治中心理化检验科,广东 深圳 518020;2. 华中科技大学同济医学院公共卫生学院营养与食品卫生学系,湖北 武汉 430030)
酒精性肝病(alcoholic liver disease,ALD)是由于摄入过量酒精而导致肝脏损害的一系列病变, ALD 已成为世界范围内导致慢性肝病的重要原因[1]。ALD发病早期尚可逆转,因此,研究ALD的早期发病机制及干预靶点,对于ALD的预防及治疗具有非常重要的意义[2]。
研究表明,在ALD的发生发展过程中,自噬作用扮演着重要的角色[3]。在自噬过程中,溶酶体与自噬体融合以及自噬性降解是自噬流(autophagic flux)顺利进行的重要保证。然而,由于溶酶体脆弱的抗氧化系统,溶酶体对氧化应激异常敏感。酒精代谢过程中会导致肝脏产生严重的氧化应激,推测酒精暴露可能导致溶酶体膜损伤,进而影响自噬作用。研究也发现,溶酶体损伤所致的自噬损害在酒精相关性疾病中发挥重要的作用。长期酒精暴露会引起心肌细胞溶酶体损伤,从而导致自噬体异常积累,加重酒精性心脏损伤[4]。因此,缓解溶酶体的损伤,恢复溶酶体的自噬功能可能是ALD防治的新靶点。
槲皮素是分布于红洋葱、苹果、茶叶等植物性食物中一种黄酮类物质,具有抗氧化、抗炎、保护ALD等广泛的生物学效应[5]。虽然槲皮素的生物利用度较低,但其可通过参与生物体内多种生理功能的调控而放大并发挥其强大的生物学效应。研究发现,槲皮素可通过调节自噬作用发挥对多种疾病的保护作用[6]。但目前尚没有在溶酶体自噬水平上探讨槲皮素缓解ALD的潜在机制。因此,本文旨在探讨长期酒精暴露对肝脏溶酶体自噬的影响及槲皮素拮抗效应的相关机制。
1 材料
1.1实验动物及饲料SPF级成年♂ C57BL/6J小鼠(18~20 g)购自北京维通利华实验动物技术有限公司(合格证号:No.11400700212179)。Lieber De Carli liquid液体饲料购自北京华阜康生物科技股份有限公司。
1.2试剂槲皮素(≥0.95,Sigma);质量分数为0.025戊二醛固定液(谷歌生物);血清ALT、AST检测试剂盒(深圳迈瑞);MDA、GSH测定试剂盒(南京建成);Lyso-Tracker Red、RIPA裂解液(碧云天);组织蛋白酶B(cathepsin B)活性测定试剂盒(BioVision);LC3-II抗体(Sigma);p62抗体、HRP标记抗大鼠IgG抗体、HRP标记抗兔IgG抗体(CST);溶酶体膜相关蛋白2A(lysosome associated membrane protein 2A, LAMP2A)抗体(Santa Cruz);ECL化学发光剂(Millipore)。
1.3仪器透射电子显微镜TEM(日本日立);倒置荧光显微镜(日本Olympus);电泳仪(美国Bio-Rad);凝胶成像分析仪(美国Bio-Rad)。
2 方法
2.1动物模型的建立[7]C57BL/6J小鼠适应性喂养1周后,按照体质量随机分为4组,即正常对照组(Con,Lieber De Carli液体饲料)、酒精组(Eth,含乙醇供能30%的Lieber De Carli液体饲料,每1 000 mL饲料中含67.3 mL体积分数为0.95的乙醇)、酒精+槲皮素组(Eth+Qu,槲皮素100 mg·kg-1)、槲皮素对照组(Qu)。各组小鼠等能量配对喂养15周,记录每天小鼠的摄食量,并做相应的调整以保证等能量喂养;按照体质量确定每只小鼠槲皮素的灌胃量。慢性酒精暴露小鼠模型建立成功后,眼眶取血,迅速剥离肝脏固定于戊二醛或冻存于-80℃冰箱。
2.2肝脏损伤基础指标检测用电子显微镜观察肝细胞超微结构的变化;全自动生化分析仪检测血清ALT、AST水平;硫代巴比妥酸(TBA)比色法测定肝脏MDA水平、二硫代二硝基苯甲酸(DTNB)比色法测定肝脏GSH水平。
2.3溶酶体膜透性的检测Lyso-Tracker Red探针荧光显微镜法检测溶酶体膜透性。小鼠模型建立成功后,每组选取3只,用二步胶原酶法提取原代肝细胞,高糖培养基培养6 h贴壁后,去除培养基,加入Lyso-Tracker Red探针(100 nmol·L-1)孵育15 min后,用PBS冲洗3遍,荧光显微镜观察红色荧光强度,拍照,用IPP 6.0图像处理软件定量分析红色荧光强度。
2.4cathepsinB活性检测蔗糖梯度离心法分离胞质及溶酶体,按照cathepsin B活性测定试剂盒操作步骤检测其活性。
2.5自噬相关蛋白的检测Western blot检测肝脏自噬泡标志物LC3-II、自噬底物p62、溶酶体膜相关蛋白LAMP2A的表达量。称量100 mg左右肝脏组织,加入1 mL RIPA裂解液提取总蛋白。蛋白浓度用BCA试剂盒测定。利用SDS-PAGE电泳分离蛋白后,通过湿转法将蛋白转移到PVDF膜上,并用质量分数为0.05的脱脂牛奶进行封闭。根据抗体说明书进行一抗和经HRP标记的二抗孵育。最后,加入ECL化学发光试剂进行显色,利用化学发光成像系统进行拍照和灰度统计。
3 结果
3.1槲皮素减轻长期酒精暴露引起的肝脏损伤如Fig 1所示,正常对照组小鼠肝脏线粒体结构完整,内质网排列整齐。而长期酒精喂养小鼠肝脏出现了大量的脂滴、线粒体电子密度变大,肝糖原明显减少。槲皮素的干预后,小鼠肝脏脂滴明显减少,线粒体及内质网损伤也明显改善。血清ALT、AST是反应肝损伤的敏感指标,结果显示,与对照组相比,长期酒精喂养导致小鼠血清ALT、AST明显升高,肝细胞损伤明显,槲皮素干预减轻了酒精喂养小鼠肝脏ALT、AST的释放;丙二醛(MDA)是脂质过氧化的产物,其水平反映了脂质氧化损伤的程度。与对照组相比,长期酒精暴露小鼠肝脏MDA明显上升,槲皮素干预后MDA降低了43%。肝脏中GSH含量则反映机体抗氧化水平,长期酒精暴露小鼠肝脏GSH水平明显降低,抗氧化能力随之减弱,槲皮素缓解了小鼠肝脏的氧化损伤。槲皮素对正常小鼠肝细胞无明显影响(Tab 1)。
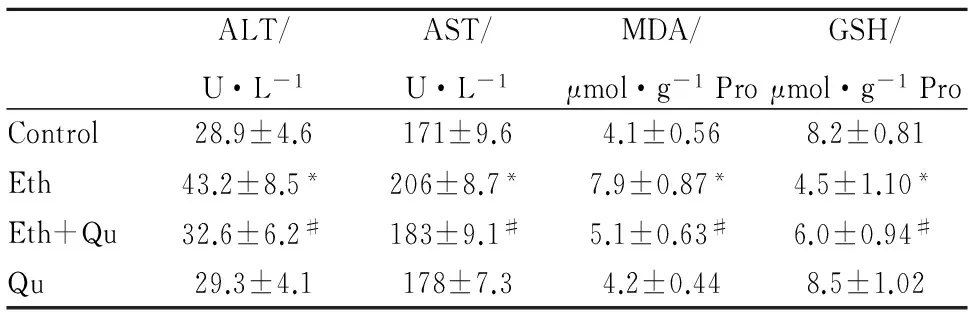
Tab 1 Effect of quercetin on serum transaminases and liver oxidative damage delivered by chronic alcohol consumption
*P<0.05vscontrol;#P<0.05vsethanol
3.2槲皮素对长期酒精喂养小鼠肝脏自噬的影响Western blot检测小鼠肝脏中自噬体标志蛋白LC3-II的含量,如Fig 2A所示,与对照组相比,长期酒精暴露引起小鼠LC3-II明显升高,LC3-II 的升高可能有两方面的原因,一是酒精刺激了自噬,二是酒精阻碍了自噬体与溶酶体的融合而抑制自噬。为了进一步分析酒精导致LC3-II蓄积的原因,检测自噬底物蛋白p62的含量,以衡量自噬流是否顺利进行。结果发现,长期酒精喂养导致小鼠肝脏中p62明显累积,说明酒精损害了自噬体与溶酶体的融合,从而抑制自噬作用(Fig 2B)。槲皮素干预后,LC3-II及p62的异常累积均得到不同程度的缓解。

Fig 1 Effect of quercetin on liver ultrastructural injury induced by alcohol
Endoplasmic reticulum (black arrowheads indicated), glycogen (hollow arrowheads indicated), mitochondria (black arrows indicated) and lipid droplets (hollow arrows indicated) were observed from transmission electron microscope (TEM) images. Eth: ethanol; Eth+Qu: ethanol plus quercetin; Q: quercetin.

Fig 2 Effect of quercetin on mouse liver autophagy
LC3-Ⅱ and p62 expression was measured by Western blot and quantified by Image J software. GAPDH was used as a protein loading control.*P<0.05vscontrol group;#P<0.05vsethanol group.
3.3槲皮素对长期酒精喂养小鼠肝脏溶酶体损伤的保护作用为进一步探讨长期酒精抑制自噬的潜在机制,检测在自噬中发挥核心作用的溶酶体的损伤,及自噬体与溶酶体融合起关键作用的蛋白LAMP2A的表达情况。结果显示,慢性酒精暴露导致小鼠肝脏溶酶体膜明显损伤,Lyso-Tracker Red染色后,与对照组相比,荧光强度明显降低(Fig 3A、3B)。溶酶体膜损伤后,cathepsin B释放到胞质中并被激活,如Fig 3C所示,与对照组比较,长期酒精摄入导致胞质中cathepsin B的活性明显升高;槲皮素干预后,红色荧光强度明显回升,同时,cathepsin B的活性也明显降低;槲皮素本身对溶酶体红色荧光强度以及cathepsin B活性无明显影响。LAMP2A被证明是自噬体与溶酶体融合的关键分子,与对照组相比,酒精引起小鼠肝脏LAMP2A表达明显降低;槲皮素干预后,LAMP2A表达增加了46%;槲皮素对正常小鼠肝脏LAMP2A的表达无明显影响(Fig 3D)。
4 讨论
肝脏是酒精代谢的主要场所,代谢过程中会引起肝脏一系列的损伤[8],与以往的研究结果一致,慢性酒精暴露引起小鼠肝脏出现严重的脂肪沉积、线粒体损伤等病变。血清ALT及AST在一定的程度上反映肝细胞损伤,长期酒精摄入引起小鼠血清ALT及AST水平明显升高。此外,长期酒精喂养导致小鼠肝脏脂质过氧化产物MDA含量升高,GSH耗竭。

Fig 3 Quercetin ameliorates autophagy impairment induced by chronic alcohol exposure
The hepatocytes were incubated with Lyso-Tracker Red and observed by microscopy. All photos were taken at ×200 (A) and quantified by IPP6.0 (B). C: The cathepsin B activity; D: LAMP2A was measured by Western blot and quantified by Image J software.*P<0.05vscontrol;#P<0.05vsethanol group.
近年来,许多研究表明长期酒精摄入会抑制肝细胞自噬作用,加重肝脏病变[9-10]。本研究中,长期酒精暴露引起小鼠肝脏自噬体标志蛋白LC3-II及自噬底物蛋白p62的含量同时明显升高。LC3-Ⅱ的升高可能是代表自噬水平的增强,也可能是由于自噬体与溶酶体不能顺利融合而导致自噬体累积[11]。大鼠摄入酒精并注射脂多糖后,胰腺LC3-II的明显增加不是因为自噬作用的增强,而是由于自噬体与溶酶体融合障碍[12]。p62是目前已知最好的自噬特异性底物和评价“自噬流”最有效的标记物,能与LC3结合并在自噬溶酶体中降解,LC3-II与p62同时增加表明自噬体与溶酶体融合过程受阻,自噬作用抑制[13]。本实验中,LC3-II与p62异常累积同时发生,提示长期酒精暴露抑制小鼠肝脏自噬作用。LAMP2A是溶酶体重要的膜蛋白,在自噬体与溶酶体融合中发挥着主要作用[14]。酒精与内毒素引起LAMP2A的严重耗竭,导致自噬体与溶酶体融合受阻,从而引起胰腺细胞凋亡甚至坏死[12]。本研究发现,长期酒精摄入引起小鼠肝脏溶酶体膜受到了严重的损伤,通透性增加,cathepsin B释放到胞质并激活,此外,LAMP2A蛋白水平明显降低。因而有理由认为溶酶体损伤、LAMP2A的耗竭可能是慢性酒精影响肝脏自噬体与溶酶体融合、引起自噬抑制的重要原因。
槲皮素是食物中最为常见的黄酮类植物化学物,因其广泛的生物活性而备受关注。除了直接的抗氧化作用外,槲皮素还可调节多种通路中的关键分子,发挥生物学效应,在多种疾病模型中亦可通过调节自噬而减轻组织损伤[6, 15]。本实验中,槲皮素干预缓解了LC3-II及p62的异常积累,增强肝细胞的自噬作用,从而降低了长期酒精摄入引起的小鼠肝脏脂滴沉积及氧化损伤。更重要的是,槲皮素减轻了酒精引起的溶酶体损伤,逆转酒精所致自噬体与溶酶体融合关键蛋白LAMP2A水平的严重下降。这是首次在溶酶体水平上探讨槲皮素对ALD的保护效应。
综上所述,槲皮素可能通过减轻溶酶体损伤、上调LAMP2A的表达,促进自噬体与溶酶体的融合,改善慢性酒精暴露所致肝脏自噬抑制,从而减轻酒精性肝损伤,槲皮素调控LAMP2A表达的潜在机制有待进一步深入探讨。
(致谢: C57BL/6J小鼠在华中科技大学同济医学院营养与食品卫生学系动物房饲养,相关指标测定在深圳市慢性病防治中心理化检验科完成,感谢科室领导、同事的关心与大力帮助。)
[1] Dey A, Cederbaum A I. Alcohol and oxidative liver injury[J].Hepatology, 2006,43(2 Suppl 1): S63-74.
[2] 邱 萍,李 相,孔德松,等. 酒精性肝病发病机制研究的新进展[J].中国药理学通报,2014,30(2): 160-3.
[2] Qiu P, Li X, Kong D S, et al. Research progress on pathogenesis of alcoholic liver disease[J].ChinPharmacolBull, 2014,30(2): 160-3.
[3] Ding W X, Manley S, Ni H M. The emerging role of autophagy in alcoholic liver disease[J].ExpBiolMed, 2011,236(5): 546-56.
[4] Guo R, Hu N, Kandadi M R, et al. Facilitated ethanol metabolism promotes cardiomyocyte contractile dysfunction through autophagy in murine hearts [J].Autophagy, 2012,8(4): 593-608.
[5] Cai X, Fang Z, Dou J, et al. Bioavailability of quercetin: problems and promises [J].CurrMedChem, 2013,20(20): 2572-82.
[6] Wang K, Liu R, Li J, et al. Quercetin induces protective autophagy in gastric cancer cells: involvement of Akt-mTOR- and hypoxia-induced factor 1alpha-mediated signaling [J].Autophagy, 2011,7(9): 966-78.
[7] 周 恒,李 俊, 王 华. 酒精性肝病动物模型研究进展[J]. 中国药理学通报, 2016,32( 4) : 468-72.
[7] Zhou H, Li J, Wang H. Animal models of alcohol liver diseases [J].ChinPharmacolBull, 2016,32(4): 468-72.
[8] 臧 月,王 生,刘 楠,等. 肠道菌群失调介导酒精性肝病发生发展的机制研究进展[J]. 中国药理学通报, 2016,32(4) : 451-5
[8] Zang Y, Wang S, Liu N, et al. Alcoholic liver disease: gut microbiota and therapeutic perspectives [J].ChinPharmacolBull, 2016,32(4): 451-5.
[9] Osna N A, Thomes P G, Jr T M. Involvement of autophagy in alcoholic liver injuryand hepatitis C pathogenesis [J].WorldJGastroenterol, 2011,17(20): 2507-14.
[10] Wu D, Wang X, Zhou R, et al. Alcohol steatosis and cytotoxicity: the role of cytochrome P4502E1 and autophagy [J].FreeRadicBiolMed, 2012,53(6): 1346-57.
[11] Mizushima N, Yoshimori T, Levine B. Methods in mammalian autophagy research [J].Cell, 2010,140(3): 313-26.
[12] Fortunato F, Burgers H, Bergmann F, et al. Impaired autolysosome formation correlates with Lamp-2 depletion: role of apoptosis, autophagy, and necrosis in pancreatitis [J].Gastroenterology, 2009,137(1): 350-60.
[13] Lippai M, Low P. The role of the selective adaptor p62 and ubiquitin-like proteins in autophagy [J].BiomedResInt, 2014,2014: 832704.
[14] Eskelinen E L. Roles of LAMP-1 and LAMP-2 in lysosome biogenesis and autophagy [J].MolAspectsMed, 2006,27(5-6): 495-502.
[15] Klappan A K, Hones S, Mylonas I, et al. Proteasome inhibition by quercetin triggers macroautophagy and blocks mTOR activity [J].HistochemCellBiol, 2012,137(1): 25-36.