模拟高原不同时间缺氧暴露对大鼠红细胞结构与功能的影响*
易元月, 刘 宝, 官立彬, 高钰琪
(第三军医大学高原军事医学系高原特需药品与卫生装备研究室,高原环境医学教育部重点实验室,全军高原医学重点实验室, 重庆 400038)
高原红细胞增多症(high-altitude polycythemia,HAPC)是久居高原人群中最常见的慢性高原病,其本质是在长期低氧作用下红细胞过度增多,导致血液黏滞度增大和微循环障碍,加重组织和细胞缺氧,引起头痛、头晕、气促、胸闷和乏力等症状,病情严重者甚至丧失劳动能力及生活能力[1-6]。由于对HAPC的发生机制认识尚不完全清楚,目前临床上尚缺乏对HAPC的有效防治措施。研究结果显示,高原缺氧可显著上调缺氧诱导因子(hypoxia-inducible factor,HIF)的表达,刺激肝、肾等器官大量分泌促红细胞生成素(erythropoietin,EPO),其与骨髓等造血器官的EPO受体结合后可上调膜蛋白、细胞骨架及血红蛋白(hemoglobin,Hb)等的表达,诱导骨髓红系增生增加,导致血液中红细胞的数量增多[7]。以往关于HAPC病理生理机制的研究大多在于探讨缺氧如何引起红细胞过度增生,而对于过度增多的红细胞的结构和功能的改变关注不多[8]。为此,本研究建立连续低压缺氧动物模型,观察研究缺氧暴露不同时间后红细胞结构与功能的改变,期望为深入揭示HAPC的病理生理学机制及防治提供实验依据。
材 料 和 方 法
1 仪器与试剂
低压缺氧模拟舱(贵州风雷航空机械制造公司);全自动血液分析仪(XT-2000i,Sysmex);全自动血流变检测仪(SH-212D,中国重庆赛航科技发展有限公司);HEMOX-ANALYZER血氧分析仪(TCS Scientific);BD FACS Verse流式细胞仪(BD)。Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术研究所)等。
2 方法
2.1实验动物与分组 40只雄性SD大鼠(8周龄,体重200~220 g)由第三军医大学大坪医院实验动物中心提供,许可证号为SCXK(渝)2012-0005和SCXK(渝)2012-0010。适应性喂养3 d后,随机分成5组:常氧(normal control,C)组、缺氧1周(1-week hypoxia,H1)组、缺氧2周(2-week hypoxia,H2)组、缺氧3周(3-week hypoxia,H3)组和缺氧4周(4-week hypoxia,H4)组,每组各8只。
2.2低压舱模拟5 800 m高原慢性缺氧大鼠模型的建立 常氧组大鼠置于常氧环境下饲养。各缺氧组大鼠置于模拟海拔5 800 m的低压舱内,持续不间断缺氧暴露,分别于缺氧暴露1、2、3及4周时以14%氨基甲酸乙酯(10 mg/kg)麻醉大鼠,取材并检测相关指标。
2.3血常规检测 收集腹主动脉全血,EDTA-K2抗凝,用全自动血液分析仪测定红细胞计数值(red blood cell count,RBC)、血红蛋白含量(Hb)、平均红细胞体积(mean corpuscular volume,MCV)和平均血红蛋白含量(mean corpuscular hemoglobin,MCH)等指标。
2.4红细胞变形指数检测 收集腹主动脉全血,肝素钠抗凝,用全自动血流变检测仪测定红细胞变形指数。
2.5红细胞渗透脆性观察 收集腹主动脉全血,肝素钠抗凝,依次滴入不同浓度梯度的氯化钠溶液中,静置30 min,观察并记录红细胞开始发生溶血时的盐水浓度。
2.6血红蛋白氧解离曲线检测 收集腹主动脉全血,以EDTA-K2抗凝,用HEMOX-ANALYZER血氧分析仪测定血红蛋白氧饱和度为50%时对应的血氧分压(oxygen half-saturation of hemoglobin,P50),并绘制血红蛋白氧解离曲线。
2.7红细胞凋亡率检测 收集腹腔动脉全血,肝素钠抗凝,离心,去除白细胞和血浆,于红细胞沉淀中加入Annexin V-FITC结合液及Annexin V-FITC染液,用流式细胞分析仪检测凋亡红细胞的百分比,即磷脂酰丝氨酸(phosphatidylserine,PS)外翻阳性率。
2.8骨髓病理切片 取大鼠股骨, 4%多聚甲醛固定,脱钙,石蜡包埋、切片,行HE染色观察。另取切片,分别以抗α-血红蛋白稳定蛋白(α-hemoglobin-stabilizing protein,AHSP)和转铁蛋白受体(transferrin receptor,CD71)抗体为 I 抗、抗SP抗体为 II 抗行免疫组化观察。
3 统计学处理
采用SPSS 13.0统计学软件进行数据处理和统计分析。计量资料用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 血常规
与C组相比,各缺氧组RBC均显著增加(P<0.01);分别与H1、H2和H3组相比,H4组RBC显著增加(P<0.01),见图1。
与C组相比,各缺氧组Hb均显著增加(P<0.01);与H1组相比,H2、H3和H4组Hb均显著增加(P<0.05);分别与H2和H3组相比,H4组Hb显著增加(P<0.05),见图1。
与C组相比,各缺氧组MCV均显著增加(P<0.01);各缺氧组间差异无统计学显著性,见图1。
与C组相比,各缺氧组MCH均显著增加(P<0.01);与H1组相比,H3组MCH显著增加(P<0.01),见图1。
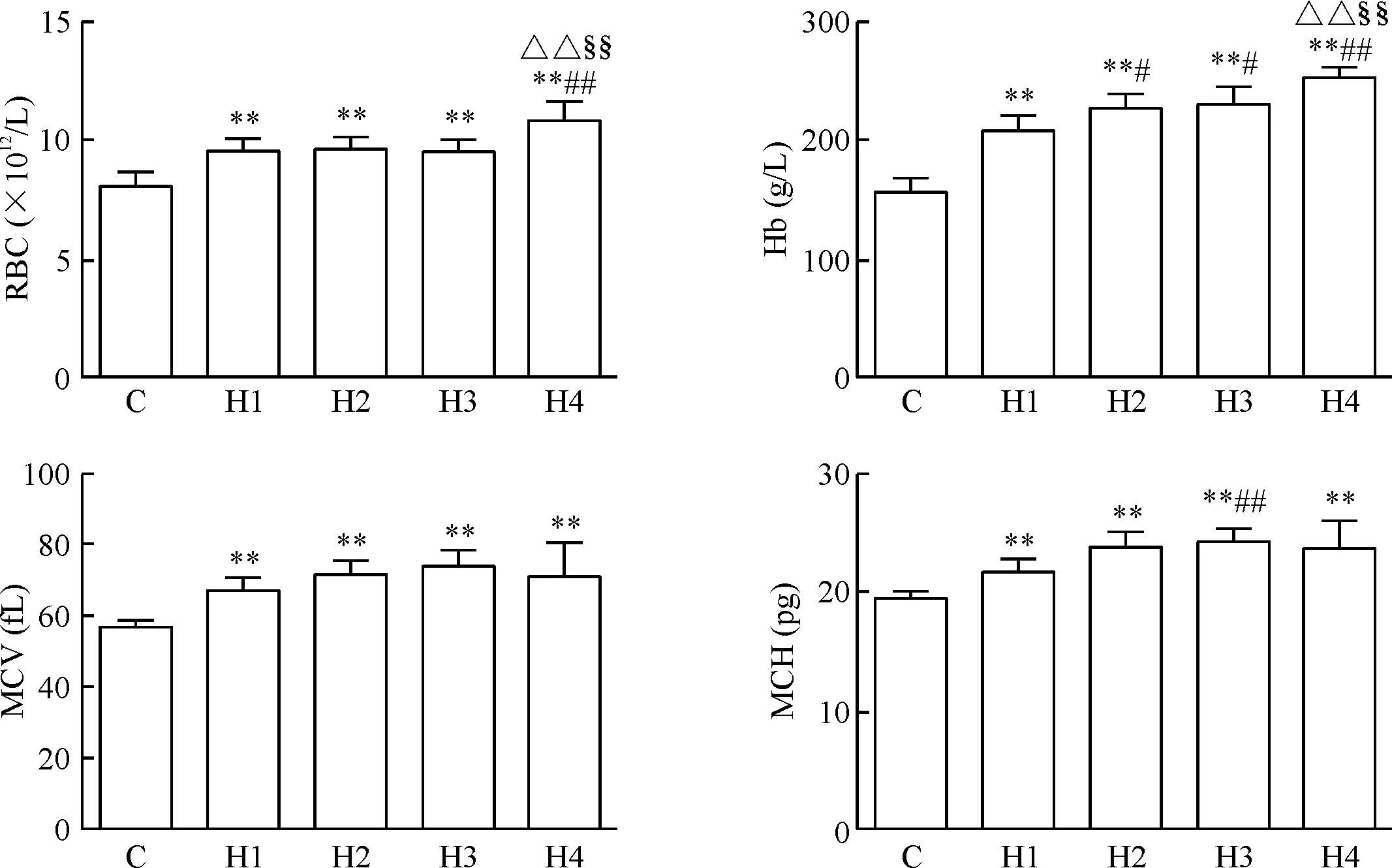
Figure 1. The changes of RBC, Hb, MCV and MCH of rats in the 5 groups. Mean±SD.n=8.**P<0.01vsC group;#P<0.05,##P<0.01vsH1 group;△△P<0.01vsH2 group;§§P<0.01vsH3 group.
图1各组大鼠RBC、Hb、MCV和MCH的变化情况
2 红细胞变形指数
与C组相比,各缺氧组红细胞变形指数显著降低(P<0.01);与H1组相比, H2和H4组变形指数显著降低(P<0.05);与H2组相比,H3组变形指数显著增加(P<0.01);与H3组相比,H4组变形指数显著降低(P<0.01),见图2。

Figure 2. The changes of erythrocyte deformation index of rats in the 5 groups. Mean±SD.n=8.**P<0.01vsC group;#P<0.05vsH1 group;△△P<0.01vsH2 group;§§P<0.01vsH3 group.
图2各组大鼠红细胞变形指数的变化情况
3 红细胞渗透脆性
与C组相比,H1、H3和H4组红细胞渗透脆性显著降低(P<0.01);与H1组相比,H2组渗透脆性显著增加(P<0.01);与H2组相比,H3和H4组渗透脆性显著降低(P<0.05,P<0.01),见图3。
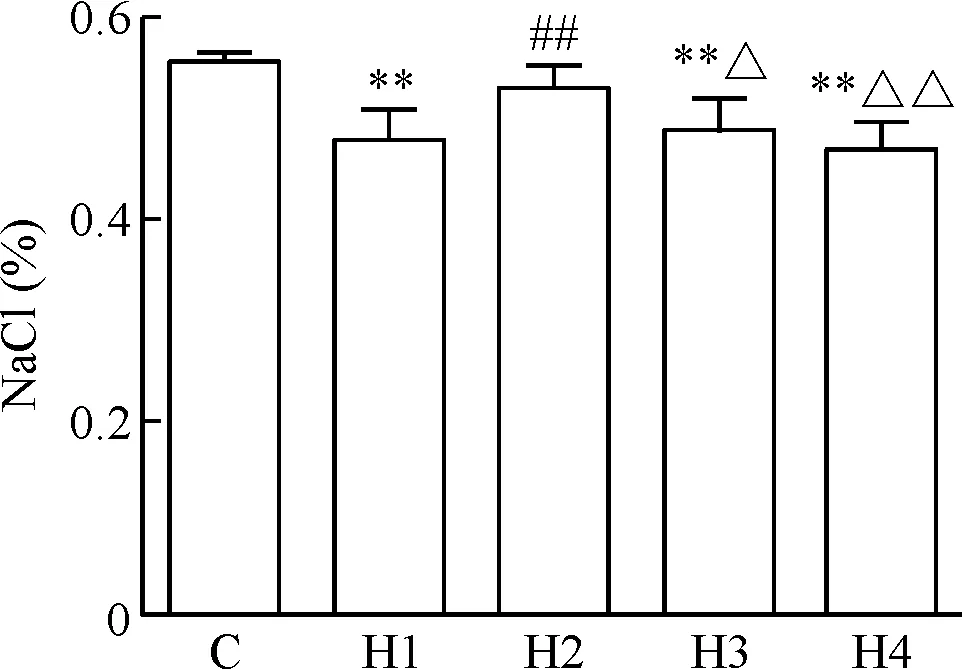
Figure 3. The changes of erythrocyte osmotic fragility of rats in the 5 groups. Mean±SD.n=8.**P<0.01vsC group;##P<0.01vsH1 group;△P<0.05,△△P<0.01vsH2 group.
图3各组大鼠红细胞渗透脆性的变化情况
4 血红蛋白氧解离曲线
与C组相比,各缺氧组的P50显著增加(P<0.05),见图4。
与C组相比,H3组的希尔系数(Hill coeffcient,HC)显著增加(P<0.01); 与H1和H2组相比,H3组的HC均显著增加(P<0.01);与H3组相比,H4组的HC显著降低(P<0.01),见图4。
与C组相比,各缺氧组的氧离曲线均发生右移,见图4。
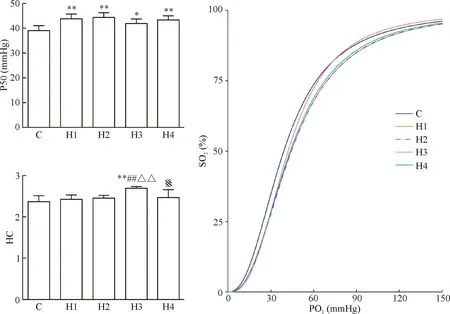
Figure 4. The changes of P50, Hill coefficient (HC) and oxygen dissociation curves of rats in the 5 groups. PO2: partial pressure of oxygen; SO2: oxygen saturation of hemoglobin. Mean±SD.n=8.*P<0.05,**P<0.01vsC group;##P<0.01vsH1 group;△△P<0.01vsH2 group;§§P<0.01vsH3 group.
图4各组大鼠血红蛋白P50、希尔系数和氧解离曲线的变化情况
5 红细胞凋亡
与C组相比,H2和H4组红细胞膜上PS外翻率显著增加(P<0.01);与H1组相比,H2和H4组PS外翻率也显著增加(P<0.01);与H2组相比,H3组PS外翻率显著降低(P<0.01);与H3组相比,H4组PS外翻率显著增加(P<0.01),见图5。
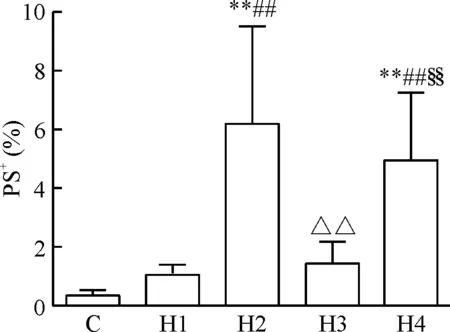
Figure 5. The changes of PS externalization on erythrocytes of rats in the 5 groups. Mean±SD.n=8.**P<0.01vsC group;##P<0.01vsH1 group;△△P<0.01vsH2 group;§§P<0.01vsH3 group.
图5各组大鼠红细胞膜上PS外翻率的变化情况
6 骨髓病理切片观察
HE染色可见,与C组相比,各缺氧组骨髓中红系细胞数量增多,见图6A~E;免疫组化染色观察可见,与C组相比,各缺氧组骨髓红系前体细胞数量增多,见图6F~O。
讨 论
模拟高原缺氧环境,大气氧分压下降导致吸入气氧分压降低和动脉血氧分压下降。为适应高原低氧环境,机体会发生一系列代偿适应性反应,其中包括血液系统的反应。红细胞增多有利于增加血液对氧的运输能力,是对高原低氧的重要的代偿适应机制。但红细胞过度增多,则可引起血液的流动速度减慢,严重的红细胞增多可加重组织和细胞的缺氧,引起个体微循环障碍,易导致多器官缺血缺氧性疾病的发生,受累较严重的器官为脑、心、肺及肝。临床表现有血栓形成、血管卒中或局部组织坏死等,严重者甚至发生猝死[9-10]。除了返回富氧环境之外,尚无任何有效的干预方法[11]。
已有大量对HAPC机制的研究指出,在高原缺氧情况下,HIF-1α与HIF-1β结合后活化成有转录活性的HIF-1,调控EPO和促红细胞生成素受体(erythropoietin receptor,EPOR)的基因编码;同时调控二价金属离子转运体(divalent metal-ion transporter-1,DMT1)、铁调素、转铁蛋白及受体,以上所有蛋白调控机体对铁的利用,使铁利用增加,红细胞生成增多[10]。也有研究报道,在高原缺氧时,HIF-2α通过对GATA结合蛋白1(GATA binding protein-1,GATA-1)的表达调控来促进肺泡Ⅱ型细胞中血红蛋白的表达,HIF-2α可能参与了HAPC成熟红细胞的过度增生过程[12]。但研究者们对缺氧暴露过程中红细胞结构和功能的改变认识仍不够。2014年,Li等[13]的文章报道了采用不连续间断模拟高原缺氧暴露制备大鼠HAPC模型的方法,主要结果是大鼠每天暴露于模拟海拔5 500 m高原8 d、2周、4周及12周,可以引起红细胞数量显著增加,血红蛋白浓度升高,红细胞压积增加,全血黏度增加及红细胞聚集指数升高。虽然,Li 等[13]的结果显示间断性缺氧(8 h/d)可以引起红细胞数量增多,但大量研究显示,在间断性缺氧暴露过程中,机体实际是经历缺氧-富氧的反复交替刺激,所导致的生理、病理生理学改变及机制与连续暴露于缺氧环境完全不同。为此,本文采用模拟高原连续暴露动物模型,更加接近久居高原人群的实际,研究结果更加有助于丰富对HAPC的认识。此外,本文的重点在于利用更加符合高原实际的动物模型观察连续高原缺氧暴露对红细胞结构和功能的影响,为全面深入认识高原红细胞增多症的发生机制提供实验依据。

Figure 6. The changes of bone marrow biopsy of rats in the 5 groups (×800).
图6各组大鼠骨髓病理切片的变化情况
本次实验结果显示, 与C组比较,各缺氧组RBC、HB、MCV、MCH及PS外翻率显著增加,红细胞变形指数及渗透脆性显著降低,P50显著增大,血红蛋白氧离曲线右移,骨髓红系增生增加。查阅文献可知,MCV增大的原因可能是缺氧组大鼠血液中网织红细胞数目增多所导致的[14]。MCH增大提示缺氧组血红蛋白携氧能力增强[15]。由于发生凋亡的红细胞膜上PS外翻,因此可用PS外翻率反映红细胞凋亡率[16-18]。红细胞变形性降低的原因是高原缺氧时红细胞膜上的胆固醇/磷脂比值下降,引起红细胞膜流动性降低,导致红细胞变形性降低[19-20]。红细胞渗透脆性降低可能与红细胞的厚径和膜稳定性的变化有关系[21]。渗透脆性越低,红细胞越不易溶血[22-23]。红细胞渗透脆性及变形性降低,推测缺氧组不易通过毛细血管的红细胞也不易发生溶血反应,因此毛细血管内可能会滞留过多变形性降低的红细胞。P50升高时,血红蛋白与氧的亲和力下降,氧解离曲线右移,血红蛋白释氧功能增强[23-25]。此外,本研究结果显示,与C组相比,H3组希尔系数显著增加,提示H3组4个亚基间正协同效应最强,当HC>1时表示血红蛋白与氧分子正协同,即血红蛋白1个亚基与氧分子结合后,其余亚基更容易与氧分子结合[26]。慢性缺氧时,肾脏释放EPO增多,引起骨髓造血祖细胞向红系分化增多,促进红细胞成熟以及血红蛋白的合成[26]。AHSP是一种特异性的红系伴侣蛋白,这种蛋白可以促进新生的α珠蛋白并入血红蛋白中,它是红系细胞的潜在特异性标示物的代表[27]。AHSP在细胞分化过程中表达水平会增加,在血红蛋白生成增多时AHSP高表达;当红系前体细胞丢失其细胞核功能或血红蛋白合成减少时AHSP低表达。CD71是已确定的红系标志物,可以上调转铁蛋白复合物并且可在红系前体细胞表面高表达[27-28]。因此,AHSP与CD71均高表达的骨髓前体细胞增多表明缺氧组骨髓红系增生增加。
综上所述,在模拟高原缺氧初期,外周血中红细胞的结构与功能发生改变从而使血红蛋白携氧和释氧能力增强以增加机体对组织的氧气供应量,利于高原习服;但是,随着缺氧时间的延长,血管内红细胞数目异常增多,血液黏滞度过度增加,容易导致血栓形成及微循环障碍并加重机体的组织细胞缺氧。上述结果为深入揭示HAPC 的发生机制和防治提供了实验依据。
[1] 范爱莉, 格桑罗布, 周 南, 等. 慢性高原红细胞增多症凝血与纤溶活性动态平衡的研究[J]. 西藏医药, 2015, 36(3):18-19.
[2] 何 蕾, 马慧萍, 马学海, 等. 模拟高原缺氧环境对大鼠血液学相关指标的影响[J]. 解放军医药杂志, 2016, 28(7):5-9.
[3] 于前进, 孔佩艳. 与高原红细胞增多症有关的血清炎症因子的研究进展[J]. 西南国防医药, 2014, 24(9):1026-1027.
[4] 伍文彬, 孟宪丽, 张 艺, 等. 藏药复方新三果汤对高原红细胞增多症模型大鼠的影响[J]. 广州中医药大学学报, 2010, 27(5):492-494.
[5] 靳国恩, 韵海霞, 马 兰, 等. 高原红细胞增多症动物模型的建立及其生理功能反应[J]. 中国组织工程研究与临床康复, 2009, 13(24):4713-4716.
[6] 冯婷婷, 冀林华, 刘 芳, 等. PD98059对高原红细胞增多症患者骨髓CD71+、CD235a+有核红细胞增殖和凋亡的影响[J]. 中国实验血液学杂志, 2016, 24(4):1184-1189.
[7] 杜亚利, 郭馨云, 俞 平, 等. 造血相关因子在高原红细胞增多症中的作用[J]. 医学综述, 2015, 21(15):2703-2706.
[8] Villafuerte FC. New genetic and physiological factors for excessive erythrocytosis and chronic mountain sickness[J]. J Appl Physiol, 2015, 119(12):1481-1486.
[9] 高钰琪, 黄 缄. 炎症反应与高原病[J]. 第三军医大学学报, 2016, 38(3):215-219.
[10] 马 婕, 崔 森, 冀林华, 等. 高原红细胞增多症发病基因的研究进展[J]. 山东医药, 2017, 57(10):112-114.
[11] Liu C, Liu B, Zhang EL, et al. Elevated pentose phosphate pathway is involved in the recovery of hypoxia-induced erythrocytosis[J]. Mol Med Rep, 2017, 16(6):9441-9448.
[12] 刘 芳, 丁 瑾, 魏 巍, 等. GATA-1对高原红细胞增多症模型大鼠骨髓CD71+细胞EpoR表达的影响[J]. 中国实验血液学杂志, 2016, 24(3):884-891.
[13] Li PB, Nie HJ, Liu W, et al. A rat model of high altitude polycythemia rapidly established by hypobaric hypoxia exposure[J]. Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2014, 30(6):526-531.
[14] Esteva S, Panisello P, Torrella JR, et al. Blood rheology adjustments in rats after a program of intermittent exposure to hypobaric hypoxia[J]. High Alt Med Biol, 2009, 10(3):275-281.
[15] 刘 彬, 王振龙, 路纪琪, 等. 雌性棕色田鼠和昆明小鼠在慢性间歇性低氧条件下血象变化的比较[J]. 生理学报, 2010, 62(2):137-142.
[16] Wesseling MC, Wagner-Britz L, Huppert H, et al. Phosphatidylserine exposure in human red blood cells depending on cell age[J]. Cell Physiol Biochem, 2016, 38(4):1376-1390.
[17] Larsson A, Hult A, Nilsson A, et al. Red blood cells with elevated cytoplasmic Ca2+are primarily taken up by sple-nic marginal zone macrophages and CD207+dendritic cells[J]. Transfusion, 2016, 56(7):1834-1844.
[18] Ahmed MS, Abed M, Voelkl J, et al. Triggering of suicidal erythrocyte death by uremic toxin indoxyl sulfate[J]. BMC Nephrol, 2013, 14:244.
[19] Kang J, Li Y, Hu K, et al. Chronic intermittent hypoxia versus continuous hypoxia: same effects on hemorheology?[J]. Clin Hemorheol Microcirc, 2016, 63(3):245-255.
[20] Berezniakova AI, Zhemela OD. Deformability of the erythrocytes membrane in rats of different age in hypoxia[J]. Fiziol Zh, 2013, 59(3):72-77.
[21] 高钰琪, 彭 鹰, 孙秉庸. 慢性缺氧对大鼠红细胞压积和脆性以及右心室重量的影响[J]. 第三军医大学学报, 1990, 12(6):539-540.
[22] 李 龙, 刘锁珠, 王宏辉. 红景天对高原缺氧条件下肉鸡红细胞渗透脆性和红细胞压积的影响[J]. 畜牧与兽医, 2013, 45(2):81-83.
[23] Ellis SS, Pepple DJ. Sildenafil increases the p50 and Shifts the oxygen-hemoglobin dissociation curve to the right[J]. J Sex Med, 2015, 12(12):2229-2232.
[24] Mairbaurl H, Weber RE. Oxygen transport by hemoglobin[J]. Compr Physiol, 2012, 2(2):1463-1489.
[25] 官立彬. 低压低氧引起大鼠血液氧离曲线逆旋与波尔效应增强[D]. 重庆: 第三军医大学, 2015.
[26] 高钰琪. 高原病理生理学[M]. 第1版. 北京: 人民卫生出版社, 2006:144-145.
[27] Yu H, Pinkus JL, Pinkus GS. α-Hemoglobin-stabilizing protein: an effective marker for erythroid precursors in bone marrow biopsy specimens[J]. Appl Immunohistochem Mol Morphol, 2016, 24(1):51-56.
[28] Marsee DK, Pinkus GS, Yu H. CD71 (transferrin receptor): an effective marker for erythroid precursors in bone marrow biopsy specimens[J]. Am J Clin Pathol, 2010, 134(3):429-435.

