SHIP1调控STAT3信号通路对白血病Jurkat细胞活力和凋亡的影响
方 鹏, 张诺芳
(河南省开封市儿童医院PICU, 河南 开封 475000)
白血病又称为血癌,是一种常见的恶性肿瘤。目前白血病常见治疗方法为化疗,随着治疗手段的不断改进,化疗虽然取得了一定的效果,但是部分白血病患者出现多药耐药的现象,并且部分患者经过化疗治疗后会出现一系列的并发症[1-3]。近年来,靶向基因治疗白血病具有针对性强和安全性高等优点,已经成为应用前景最好的方法之一,因此, 寻找有效的靶基因治疗白血病是目前研究的重要内容。
含SH2结构域的肌醇5-磷酸酶1(SH2 domain-containing inositol 5-phosphatase 1,SHIP1)是肌醇5-磷酸酶家族成员之一,参与血液疾病的发生[4-6]。有研究表明,SHIP1的mRNA在白血病患者中表达水平明显降低,参与小鼠骨髓增殖性疾病的发生过程,对小鼠淋巴细胞的增殖也具有重要调控作用[7]。本研究以白血病细胞为研究对象,运用MTT、流式细胞术和Western blot等方法探讨SHIP1对白血病细胞生长和凋亡的影响,以期为靶向基因治疗白血病提供新思路。
材 料 和 方 法
1 主要材料
白血病细胞Jurkat购自中国科学院细胞库;空载体pEGFP和SHIP1过表达载体pEGFP-SHIP1购自于吉满生物科技(上海)有限公司;Lipofectamine 2000购自Thermo;RPMI-1640购自Sigma;SHIP1和β-actin引物由南京金斯瑞生物科技有限公司合成;抗活化的caspase-3(cleaved caspase-3)、信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)和p-STAT3单克隆抗体购自Santa Cruz;抗SHIP1单克隆抗体购自LSBio;real-time PCR试剂盒购自KAPA Biosystems;STAT3信号通路抑制剂AG490购自Thermo。
2 方法
2.1细胞培养及转染 白血病细胞Jurkat用含有10%胎牛血清的RPMI-1640细胞培养液培养,培养条件为饱和湿度、 37 ℃、 5% CO2培养箱。培养3 d后换液,按照1∶3的比例传代。白血病细胞分为空白对照(blank control,control)组、阴性对照(negative control, NC)组和SHIP1组,其中NC组和SHIP1组分别转染空载体 pEGFP和SHIP1过表达载体pEGFP-SHIP1,control组不做处理。白血病细胞培养至对数生长期后,调整细胞悬浮液为2×107/L,接种于96孔细胞培养板中,每孔中加入100 μL细胞悬浮液,放置于37 ℃、5% CO2培养箱中培养,观察细胞融合度为60%时,进行细胞转染。步骤参照转染试剂 Lipofectamine 2000说明书,转染48 h后检测转染效果。
2.2Real-time PCR检测转染效果 Control组、NC组和SHIP1组细胞培养48 h后,收集细胞,按照每毫升加入1 mL的Trizol裂解液,混合后,在室温条件下反应5 min,加入200 μL的氯仿溶液,上下剧烈振荡15 s,静置反应3 min,4 ℃、 12 000 r/min离心15 min,此时溶液从上到下分为3层,提取的RNA存在于上层水相层中,吸取约500 μL的水相溶液,加入等体积的异丙醇,混合后,于冰上静置5 min,4 ℃、12 000 r/min离心15 min,弃上清液,加入适量的75%的乙醇后,放在超净工作台中晾干,用紫外分光光度计检测RNA浓度(A260/A280比值介于1.8~2.1之间)。用real-time PCR检测目的基因的转录水平。SHIP1 的上游引物序列为5’-GCTGGAGGAAGAGGACACAG-3’, 下游引物序列为5’-AGTCAGCGGGATGTTTCTTG-3’;β-actin的上游引物序列为5’-CCTTCTACAATGAGCTGCGT-3’, 下游引物序列为5’-CCTGGATAGCAACGTACATG-3’。反应条件为: 95 ℃预变性30 s; 95 ℃变性 5 s, 60 ℃退火30 s、72 ℃延伸1 min,共计40个循环。内参照为β-actin,用2-ΔΔCt法计算目的基因表达水平,实验重复3次,取均值。
2.3Western blot检测转染效果 Control组、NC组和SHIP1组细胞培养48 h后,收集各组细胞,用PBS洗涤细胞2次,1 000 r/min离心5 min,将培养液上清吸除后,加入蛋白裂解液,充分裂解后,吸取蛋白上清,用BCA蛋白浓度检测试剂盒对蛋白样品进行定量检测。蛋白样品与上样缓冲液按照等体积比例混合煮沸5 min,80 V电压观察溴酚蓝进入分离胶和浓缩胶边缘时,将电压调节到120 V,溴酚蓝进入到电泳槽的底端时,关闭电源。湿转法转膜(100 V恒压或者300 mA恒流)2 h。用含有5%牛血清白蛋白的封闭液将非特异性的结合位点封闭,封闭条件为室温 60 min。弃封闭液,用800倍稀释的 I 抗在4 ℃结合过夜,用辣根过氧化物标记的 II 抗(2 000倍稀释)在室温条件下结合60 min,显色,显影后,根据蛋白灰度值分析蛋白表达水平,实验重复3次,取均值。
2.4MTT法检测细胞活力 Control组、NC组和SHIP1组细胞培养至对数生长期后,把细胞浓度调整为1×108/L,按照每孔中加入200 μL的细胞悬浮液接种到96孔板中,每组设置7个复孔,用PBS将边缘孔填充。培养48 h后,终止培养,每孔中加入5 g/L的MTT溶液20 μL,放在37 ℃、5% CO2培养箱中孵育4 h,1 000 r/min离心5 min,在细胞沉淀中加入200 μL的二甲基亚砜溶液, 37 ℃振荡10 min,待结晶物融化后,进行比色(490 nm)。以不加细胞只加入等量二甲基亚砜的孔为空白组,用于调零,计算细胞存活率。细胞存活率(%)=100%×(A转染组-A空白组)/(A对照组-A空白组)。
2.5流式细胞术检测细胞凋亡 Control组、NC组和SHIP1组细胞培养48 h后,2 000 r/min离心5 min,用PBS调整细胞浓度为6×108/L,收集1 mL细胞悬浮液中的细胞,加入200 μL的结合缓冲液,加入碘化丙啶(propidium iodide,PI)和Annexin V-FITC各5 μL,避光,室温孵育15 min,在1 h内用流式细胞仪检测凋亡情况,实验重复3次,取均值。
2.6Western blot检测cleaved caspase-3、STAT3和p-STAT3的蛋白水平 Control组、NC组和SHIP1组细胞培养48 h后,参照2.3中Western blot法检测细胞中cleaved caspase-3、STAT3和p-STAT3 蛋白水平,其中抗cleaved caspase-3、STAT3、p-STAT3的I 抗均稀释1 000倍,II 抗稀释2 000倍,β-actin为内参照,分析蛋白表达水平,实验重复3次,取均值。
2.7STAT3信号通路抑制剂对细胞活力和凋亡的影响 用50 μmol/L的STAT3信号通路抑制剂AG490分别作用于control组和SHIP1组细胞,记为control+AG490组和SHIP1+AG490组,培养48 h后,参照上述方法检测细胞中STAT3、p-STAT3和cleaved caspase-3的蛋白水平,检测细胞活力和凋亡情况,同时control组细胞培养48 h后检测细胞的活力和凋亡情况,实验重复3次,取均值。
3 统计学处理
所得的实验数据均采用SPSS 22.0统计学软件分析。数据以均数±标准差(mean±SD)表示,组间多重比较用方差齐性检验,用Bonferroni校正的t检验对两组之间进行比较,以P<0.05为差异有统计学意义。
结 果
1 转染效果
Real-time PCR和Western blot实验结果显示,control组、NC组和SHIP1组SHIP1的mRNA表达水平依次为 1.02±0.08、0.99±0.12和2.31±0.18,SHIP1的蛋白水平依次为0.45±0.06、0.46±0.07和1.12±0.16。SHIP1组细胞中SHIP1 mRNA和蛋白水平均明显高于control组和NC组,差异具有统计学意义(P<0.05), 见图1、表1。
2 SHIP1对细胞活力的影响
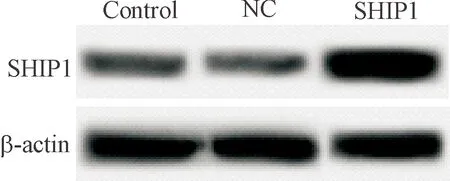
Figure 1. The protein levels of SHIP1 in transfected cells detected by Western blot.
图1Westernblot检测转染后SHIP1蛋白表达水平
表1转染细胞中SHIP1mRNA和蛋白表达水平
Table 1. The mRNA and protein levels of SHIP1 in transfected cells (Mean±SD.n=3)

GroupmRNAProteinControl1.02±0.08*0.45±0.06*NC0.99±0.12*0.46±0.07*SHIP12.31±0.131.12±0.16
*P<0.05vsSHIP1 group.
MTT结果显示,control组、NC组和SHIP1组的细胞存活率依次为(101.35±6.65)%、(100.91±12.63)%和(69.53±9.53)%。3组数据比较差异显著(F=10.172,P<0.05), SHIP1组的细胞存活率明显低于control组和NC组,差异具有统计学意义(t=4.743,P<0.05),见图2。

Figure 2. The changes of the cell viability. Mean±SD.n=3.*P<0.05vsSHIP1 group.
图2SHIP1对细胞活力的影响
3 SHIP1对细胞凋亡的影响
流式细胞术结果显示,control组、NC组和SHIP1组的细胞凋亡率依次为(4.65±0.41)%、(4.80±0.74)%和(23.82±2.66)%。3组比较差异显著(F=140.401,P<0.01),SHIP1组的细胞凋亡率明显高于control组和NC组,差异具有统计学意义(P<0.05),见图3。
4 SHIP1对细胞cleaved caspase-3、STAT3和p-STAT3蛋白水平的影响
Western blot结果显示,control组、NC组和SHIP1组的cleaved caspase-3蛋白水平依次为0.25±0.03、0.24±0.05和0.68±0.07;STAT3的蛋白水平依次为0.84±0.07、0.85±0.06和0.86±0.04;p-STAT3的蛋白水平依次为0.34±0.08、0.35±0.05和0.20±0.03。SHIP1组的cleaved caspase-3蛋白水平明显高于control组和NC组,而p-STAT3的蛋白水平明显低于control组和NC组,差异具有统计学意义(P<0.05),见图4、表2。

Figure 3. The cell apoptosis detected by flow cytometry. Mean±SD.n=3.*P<0.05vsSHIP1 group.
图3SHIP对细胞凋亡的影响

Figure 4. The protein levels of cleaved caspase-3, STAT3 and p-STAT3 determined by Western blot.
图4Westernblot检测cleavedcaspase-3、STAT3和p-STAT3蛋白水平的变化
表2Westernblot检测cleavedcaspase-3、STAT3和p-STAT3蛋白水平变化的定量分析
Table 2. The protein levels of cleaved caspase-3, STAT3 and p-STAT3 determined by Western blot (Mean±SD.n=3)
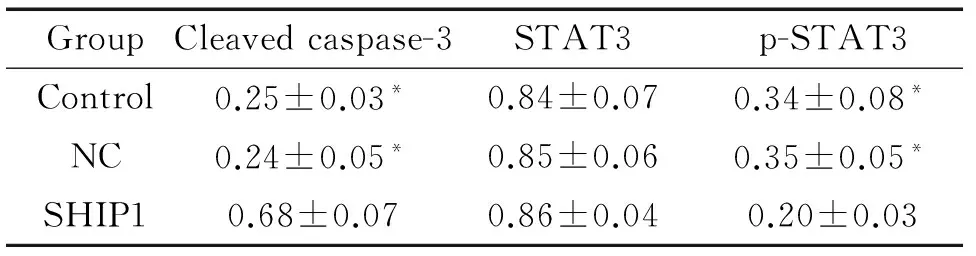
GroupCleavedcaspase-3STAT3p-STAT3Control0.25±0.03*0.84±0.070.34±0.08*NC0.24±0.05*0.85±0.060.35±0.05*SHIP10.68±0.070.86±0.040.20±0.03
*P<0.05vsSHIP1 group.
5 STAT3信号通路抑制剂AG490对细胞活力和凋亡相关蛋白水平的影响
MTT法和Western blot结果示,control组、 control+AG490组和SHIP1+AG490组细胞存活率依次为 (100.15±9.64)%、(72.31±6.73)%和(56.31±8.92)%;cleaved caspase-3蛋白水平依次为0.14±0.07、0.29±0.06和1.03±0.09;STAT3蛋白水平依次为0.93±0.09、0.95±0.08和0.94±0.09;p-STAT3蛋白水平依次为0.36±0.07、0.22±0.04和0.14±0.03。SHIP1+AG490组的细胞存活率和p-STAT3蛋白水平明显低于control+AG490组,而cleaved caspase-3蛋白水平明显高于control+AG490组,差异具有统计学意义(P<0.05),见图5、表3。

Figure 5. The effect of STAT3 signaling pathway inhibitor AG490 on the protein levels of cleaved caspase-3, STAT3 and p-STAT3 determined by Western blot.
图5Westernblot检测STAT3信号通路抑制剂AG490对cleavedcaspase-3、STAT3和p-STAT3蛋白水平的影响

表3 STAT3信号通路抑制剂AG490对Jurkat细胞活力和cleaved caspase-3、 STAT3和p-STAT3蛋白水平的影响Table 3. The effects of AG490 on Jurkat cell viability and protein levels (Mean±SD. n=3)
*P<0.05vscontrol group;△P<0.05vscontrol+AG490 group.
6 STAT3信号通路抑制剂AG490对细胞凋亡的影响
流式细胞术结果所示,control组、 control+AG490组和SHIP1+AG490组的细胞凋亡率依次为(6.32±1.25)%、(21.68±2.69)%和(36.66±4.57)%。3组间数据比较差异显著(F=69.778,P<0.01),control+AG490组细胞凋亡率显著高于control组,SHIP1+AG490组细胞凋亡率明显高于control+AG490组,差异具有统计学意义(P<0.05),见图6。
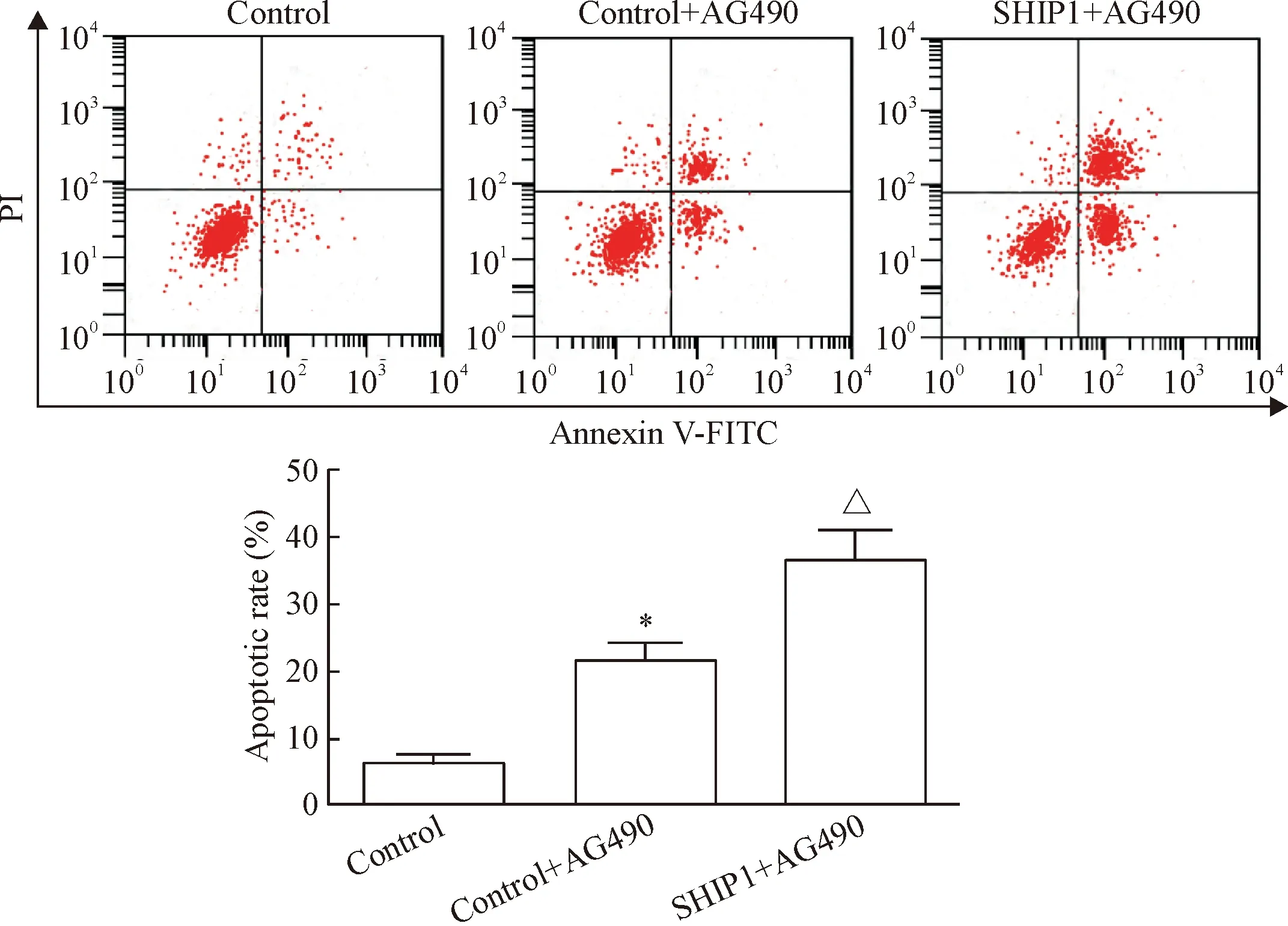
Figure 6. The effect of A490 on the cell apoptosis analyzed by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group;△P<0.05vscontrol+AG490 group.
图6STAT3信号通路抑制剂AG490对Jurkat细胞凋亡的影响
讨 论
白血病是由于造血干细胞异常导致的血液系统恶性肿瘤,白血病细胞在骨髓等造血组织中异常增殖并转移至临近器官和组织中,导致正常的造血功能受阻,出现出血、感染和贫血等症状[8-10]。SHIP1基因定位于2q36~37,能够负调控细胞增殖,是除了PTEN以外发现的另外一种肌醇磷酸酶[11]。有研究表明,SHIP1基因缺失的小鼠髓系细胞大量增殖,并且出现肝脏肿大、脾脏肿大和中性粒细胞浸润肺部等与慢性粒细胞白血病相似的症状[12]。Brauer等[13]的研究表明,在白血病患者中SHIP1无论是在转录水平还是蛋白水平均明显降低;Xue等[14]发现,在白血病细胞中过表达miR-155后,白血病细胞的凋亡减少,细胞中SHIP1蛋白表达减少。这些研究结果说明,SHIP1可能参与白血病的发生过程。
本研究以白血病Jurkat细胞为研究对象,将细胞转染SHIP1过表达载体,并通过real-time PCR和Western blot检测证实SHIP1过表达载体能够促进白血病细胞中SHIP1的mRNA和蛋白表达;进一步检测细胞活力和凋亡发现,SHIP1过表达能够抑制白血病Jurkat细胞的活力,并促进Jurkat细胞凋亡,提示SHIP1能促进白血病凋亡,抑制白血病细胞生长,这与之前的研究报道相符。
肿瘤细胞的增殖和凋亡受到多种基因的严格调控,其中 caspase是目前公认的与细胞凋亡相关的蛋白家族[15-18]。有研究表明,caspase级联反应激活后,导致caspase-3活化水平升高,促进细胞凋亡的发生[19-21];Wang等[22]的研究表明,caspase-3参与介导慢性粒细胞白血病发生过程,当K562细胞凋亡增多时,caspase-3活化水平升高了近3倍。金丹婷等[23]的研究表明,大黄素能够通过影响caspase-3的表达水平诱导白血病细胞的凋亡。本研究结果显示,过表达SHIP1的白血病细胞中caspase-3活化水平升高,这提示,SHIP1可能通过促进caspase-3活化促进白血病细胞的凋亡。
STAT3信号通路广泛存在于真核生物体内,参与调控细胞生长和凋亡[24-26]。STAT3信号通路在乳腺癌、胃癌、肺癌和白血病等多种肿瘤中异常激活,后能够促进肿瘤细胞的增殖[27-29]。李覃等[30]的研究表明,白藜芦醇能够通过降低STAT3磷酸化水平发挥抗白血病的作用;Kontro等[31]的研究表明,急性淋巴细胞白血病患者骨髓单个核细胞中STAT3磷酸化水平明显高于正常人。本研究结果显示,过表达SHIP1能够降低白血病细胞中p-STAT3的水平,而进一步用STAT3信号通路特异性抑制剂作用后发现,细胞凋亡增加更多。这提示,STAT3信号通路参与SHIP1调控白血病细胞凋亡过程。
综上所述,SHIP1能够通过抑制STAT3信号通路的激活促进白血病细胞凋亡,抑制白血病细胞活力。本研究为进一步探讨SHIP1在白血病发病机制中的作用奠定了基础,为靶向SHIP1治疗白血病提供了理论基础。本研究只在体外进行了细胞实验,后续会在体内进行进一步的验证及探讨。
[1] Schultz KR, Carroll A, Heerema NA, et al. Long-term follow-up of imatinib in pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia: Children’s Oncology Group study AALL0031[J]. Leukemia, 2014, 28(7):1467-1471.
[2] Cross NC, White HE, Colomer D, et al. Laboratory re-commendations for scoring deep molecular responses fol-lowing treatment for chronic myeloid leuke-mia[J]. Leukemia, 2015, 29(5):999-1003.
[3] Engle EK, Fisher DA, Miller CA, et al. Clonal evolution revealed by whole genome sequencing in a case of primary myelofibrosis transformed to secondary acute myeloid leukemia[J]. Leukemia, 2015, 29(4):869-876.
[4] Nakano N, Nishiyama C, Yagita H, et al. Notch signaling enhances FcεRI-mediated cytokine production by mast cells through direct and indirect mechanisms[J]. J Immunol, 2015, 194(9):4535-4544.
[5] Maxwell MJ, Srivastava N, Park MY, et al. SHIP-1 deficiency in the myeloid compartment is insufficient to induce myeloid expansion or chronic inflammation[J]. Genes Immun, 2014, 15(4):233-240.
[6] Reth M, Gold MR. What goes up must come down: a tripartite Dok-3/Grb2/SHIP1 inhibitory module limits BCR signaling[J]. Eur J Immunol, 2016, 46(11): 2507-2511.
[7] Gold MJ, Antignano F, Hughes MR, et al. Dendritic-cell expression of Ship1 regulates Th2 immunity to helminth infection in mice[J]. Eur J Immunol, 2016, 46(1):122-130.
[8] Kihara R, Nagata Y, Kiyoi H, et al. Comprehensive ana-lysis of genetic alterations and their prognostic impacts in adult acute myeloid leukemia patients[J]. Leukemia, 2014, 28(8):1586-1595.
[9] Pardanani A, Lasho TL, Laborde RR, et al. CSF3R T618I is a highly prevalent and specific mutation in chro-nic neutrophilic leukemia[J]. Leukemia, 2013, 27(9):1870-1873.
[10] Liu J, Chen G, Feng L, et al. Loss of p53 and altered miR15-a/16-1→ MCL-1 pathway in CLL: insights fromTCL1-Tg:p53-/-mouse model and primary human leukemia cells[J]. Leukemia, 2014, 28(1):118-128.
[11] Xiong Y, Medvedev AE. Induction of endotoxin toleranceinvivoinhibits activation of IRAK4 and increases negative regulators IRAK-M, SHIP-1, and A20[J]. J Leukoc Biol, 2011, 90(6):1141-1148.
[12] Maxwell MJ, Duan M, Armes JE, et al. Genetic segregation of inflammatory lung disease and autoimmune disease severity inSHIP-1-/-mice[J]. J Immunol, 2011, 186(12):7164-7175.
[13] Brauer H, Strauss J, Wegner W, et al. Leukemia-asso-ciated mutations in SHIP1 inhibit its enzymatic activity, interaction with the GM-CSF receptor and Grb2, and its ability to inactivate PI3K/AKT signaling[J]. Cell Signal, 2012, 24(11):2095-2101.
[14] Xue H, Hua LM, Guo M, et al. SHIP1 is targeted by miR-155 in acute myeloid leukemia[J]. Oncol Rep, 2014, 32(5):2253-2259.
[15] Weng D, Marty-Roix R, Ganesan S, et al. Caspase-8 and RIP kinases regulate bacteria-induced innate immune responses and cell death[J]. Proc Natl Acad Sci U S A, 2014, 111(20):7391-7396.
[16] Soares JR, José Tenóriode Melo E, da Cunha M, et al. Interaction between the plantApDef1defensin andSaccharomycescerevisiaeresults in yeast death through a cell cycle- and caspase-dependent process occurringviauncontrolled oxidative stress[J]. Biochim Biophys Acta, 2017, 1861(1 Pt A):3429-3443.
[17] White K, Dempsie Y, Caruso P, et al. Endothelial apoptosis in pulmonary hypertension is controlled by a micro-RNA/programmed cell death 4/caspase-3 axis[J]. Hypertension, 2014, 64(1):185-194.
[18] 任 莉, 徐丹阳, 翟亚东, 等. 持续被动运动对兔骨关节炎软骨细胞凋亡相关基因 P53、 caspase-3、 Bcl-2 和 Bax 的影响[J]. 新疆医学, 2016, 46(10):1233-1236.
[19] Zhang X, Zhu Y, Duan W, et al. Allicin induces apoptosis of the MGC-803 human gastric carcinoma cell line through the p38 mitogen-activated protein kinase/caspase-3 signaling pathway[J]. Mol Med Rep, 2015, 11(4):2755-2760.
[20] Yang B, Wang L, Luo X, et al. SPAG6 silencing inhibits the growth of the malignant myeloid cell lines SKM-1 and K562 via activating p53 and caspase activation-dependent apoptosis[J]. Int J Oncol, 2015, 46(2):649-656.
[21] Miyamoto A, Miyauchi H, Kogure T, et al. Apoptosis induction-related cytosolic calcium responses revealed by the dual FRET imaging of calcium signals and caspase-3 activation in a single cell[J]. Biochem Biophys Res Commun, 2015, 460(1):82-87.
[22] Wang Y, Wei S, Wang J, et al. Phenethyl isothiocyanate inhibits growth of human chronic myeloid leukemia K562 cells via reactive oxygen species generation and caspases[J]. Mol Med Rep, 2014, 10(1):543-549.
[23] 金丹婷, 刘北忠, 刘 畅, 等. 大黄素诱导白血病 K562 细胞凋亡的实验研究[J]. 重庆医科大学学报, 2009, 34(7):822-825.
[24] Wang P, Xue Y, Han Y, et al. The STAT3-binding long noncoding RNA lnc-DC controls human dendritic cell differentiation[J]. Science, 2014, 344(6181):310-313.
[25] Tierney MT, Aydogdu T, Sala D, et al. STAT3 signaling controls satellite cell expansion and skeletal muscle repair[J]. Nat Med, 2014, 20(10):1182-1186.
[26] 李 逦, 王 纯, 卢宏达. 马钱子碱通过抑制 IL-6/STAT3 信号通路诱导结肠癌 SW480 细胞凋亡[J]. 中国病理生理杂志, 2016, 32(6):998-1003.
[27] Yu H, Lee H, Herrmann A, et al. Revisiting STAT3 signalling in cancer: new and unexpected biological functions[J]. Nat Rev Cancer, 2014, 14(11): 736-746.
[28] Vasquez-Dunddel D, Pan F, Zeng Q, et al. STAT3 regulates arginase-I in myeloid-derived suppressor cells from cancer patients[J]. J Clin Invest, 2013, 123(4):1580-1589.
[29] Liang J, Nagahashi M, Kim EY, et al. Sphingosine-1-phosphate links persistent STAT3 activation, chronic intestinal inflammation, and development of colitis-associa-ted cancer[J]. Cancer Cell, 2013, 23(1):107-120.
[30] 李 覃, 范桂香, 王 伟, 等. 虎杖提取物白藜芦醇的抗白血病作用及其可能的分子机制[J]. 西安交通大学学报: 医学版, 2008, 29(3):340-345.
[31] Kontro M, Kuusanmäki H, Eldfors S, et al. Novel activating STAT5B mutations as putative drivers of T-cell acute lymphoblastic leukemia[J]. Leukemia, 2014, 28(8):1738-1742.

