SAHA对糖尿病大鼠肾组织Twist和HDAC1表达的影响*
蒋小涵, 肖 瑛, 王圆圆, 张莹莹, 石明隽, 郭 兵
(贵州医科大学病理生理学教研室, 贵州省高校重大疾病发病机制研究及药物防治特色重点实验室, 贵州 贵阳 550025)
Twist属于高度保守的碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)结构的转录因子家族,在动物和人的胚胎发育、诱导细胞迁移以及组织塑形中起重要作用。近期研究证实,Twist参与上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程,是EMT重要诱导因子之一[1],而EMT是各种器官发生纤维化的中心事件。已有文献报道,在病毒感染的肺纤维化[2]、单侧输尿管梗阻(unilateral ureteral obstruction,UUO)肾脏纤维化模型[3]和高糖刺激的人腹膜间质纤维化[4]中Twist都高表达,由此推测Twist在纤维化病变中发挥重要作用。但是在糖尿病肾病(diabetic nephropathy,DN)肾纤维化中,Twist表达水平及其调控鲜有报道。
辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)又名伏立诺他(vorinostat),是第2代的组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi),可抑制HDAC1、HDAC2、HDAC3和HDAC6的活性[5]。目前,HDACi治疗器官纤维化越来越受到关注。已有研究表明,在肝纤维化、肾纤维化和肺纤维化中,HDACi都能明显减轻纤维化程度[6-7]。前期研究在百草枯中毒致大鼠肺纤维化模型中发现,组蛋白去乙酰化抑制剂SAHA能够降低纤维化的肺组织和细胞中HDAC1的蛋白水平和活性,从而发挥抗纤维化效应[8]。另有研究发现,HDAC1过表达会被某些EMT转录因子募集,影响EMT的进程,从而导致疾病的产生[9-10]。
本研究以链脲佐菌素(streptozotocin,STZ)复制的大鼠糖尿病(diabetes mellitus,DM)模型为研究对象,检测SAHA对糖尿病肾病大鼠肾纤维化病变的影响、Twist在糖尿病大鼠肾组织中的作用和SAHA治疗后Twist的变化,并对其相关机制进行初步探讨,为临床治疗糖尿病肾病提供新的思路。
材 料 和 方 法
1 材料
1.1实验动物 健康清洁级雄性 Sprague-Dawley (SD)大鼠,体重(160±20)g,购于北京华阜康生物科技有限公司,许可证号为[SCXK(京)2009-0004]。
1.2实验试剂 STZ(Sigma);SAHA(BioChemPartner);兔抗Twist多克隆抗体和鼠抗Ⅳ型胶原(collgen type Ⅳ,Col-Ⅳ)多克隆抗体(Sigma);兔抗HDAC1多克隆抗体,鼠抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体(Santa Cruz);兔抗上皮钙黏蛋白(E-cadherin)多克隆抗体(北京博奥森公司);小鼠抗大鼠β-actin 单克隆抗体、辣根过氧化物酶标记羊抗鼠 IgG 和辣根过氧化物酶标记羊抗兔 IgG(武汉普美克生物技术有限公司);血糖仪和血糖试纸(强生有限公司);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(Millipore);免疫组织化学SP两步法检测试剂盒(北京中杉金桥生物技术有限公司);RIPA强裂解液和 BCA 蛋白浓度测定试剂盒(碧云天生物技术研究所);总RNA 提取试剂盒以及Twist和β-actin 引物(上海生工生物技术工程服务有限公司);RevertAid First Strand cDNA Synthesis Kit(Thermo); 2× SuperReal PreMix Plus(天根生化科技有限公司)。
2 方法
2.1动物模型建立及分组 大鼠适应性喂养1周后,随机分为正常对照(normal control,NC)组、DM组和SAHA组,每组12只。造模前先禁食6~8 h,然后乙醚麻醉,DM组和SAHA组一次性尾静脉注射溶于0.01 mol/L无菌柠檬酸-柠檬酸钠缓冲液(pH 4.5)的STZ,剂量为55 mg/kg, NC组大鼠尾静脉注射等体积枸橼酸钠缓冲液,72 h后测造模组大鼠的空腹血糖,以血糖值≥16.7 mmol/L且尿糖阳性为造模成功。在造模8周后,SAHA组用0.3%羧甲基纤维素溶解的SAHA(25 mg·kg-1·d-1)灌胃,持续8周。
2.2标本收集 饲养16周后处死大鼠。处死前1 d用代谢笼收集24 h尿液并记录尿量,收集的尿液取部分离心后,取上清,-20 ℃保存;处死前禁食6~8 h,麻醉前称重,股动脉取血,静置后离心取上清,-20 ℃保存;开腹后,用针尖扎向左心室注射0.9%的生理盐水进行肾脏灌洗,并将右心耳戳破,直至双侧肾变苍白后,取双侧肾脏,小心去掉包膜及周围脂肪组织,称重并记录,用来评估肾脏指数(kidney index,KI),KI(mg/g)=肾重(mg)/体重(g);所取肾脏标本一部分放于-80 ℃保存,以备肾组织蛋白和RNA检测用,另一部分用4%中性甲醛固定以备形态学检测用。
2.3生化指标检测 血糖(blood glucose,BG)用氧化酶法检测,尿蛋白(urine protein,UP)用双缩脲法检测,尿总蛋白量为24 h尿量与尿蛋白浓度的乘积。
2.4肾组织病理学的检测 4%中性甲醛固定的肾组织,先用乙醇将肾组织块脱水,经石蜡包埋、固定,然后切片(3 μm),切片用于HE和Masson染色。光镜观察肾组织形态学变化。
2.5免疫组织化学染色 石蜡切片脱蜡,微波修复抗原,3% H2O2封闭内源性过氧化物酶,加兔抗Twist多克隆抗体(1∶150)孵育4 ℃过夜,第2天取出后30 min复温,然后滴加山羊抗兔的II抗孵育30 min,DAB 染色,苏木素复染,脱水,晾干后中性树胶封片,镜下观察并拍摄图像。
2.6Western blot 法检测蛋白水平 取0.2 g的肾皮质放入匀浆器,并加入1 mL的蛋白裂解液(RIPA∶PMSF=100∶1)于冰上进行研磨,12 000 r/min低温离心取上清,BCA法测蛋白浓度,制成蛋白样品。经6%~15%的SDS-PAGE分离,转移至PVDF膜上,在5%的脱脂奶粉TBST溶液室温封闭1 h,洗膜后分别加入抗β-actin(1∶4 000)、Twist(1∶1 000)、E-cadherin (1∶300)、HDAC1(1∶300)、α-SMA(1∶300)和Col-Ⅳ(1∶1 000),4 ℃孵育过夜,II 抗室温孵育1 h。洗膜后,加入ECL发光液1~2 min后,置入Bio-Rad凝胶成像系统进行曝光。曝光后的条带用Image Lab 图像分析软件进行分析。用管家基因β-actin 蛋白条带作内参照,目的蛋白的灰度值与内参对比分析结果。
2.7Real-time PCR检测Twist的mRNA 表达 TRI-zol法提取总RNA,使用Thermo试剂盒进行逆转录成cDNA。按照SuperReal 荧光定量预混试剂盒的20 μL体系加样,放入Bio-Rad CFX96荧光定量PCR分析系统进行检测,以β-actin为内参照,目的基因的相对含量以2-ΔΔCt表示。引物及退火温度见表1。
表1PCR引物序列及扩增条件
Table 1. The sequences of the primers and the PCR conditions used in real-time PCR
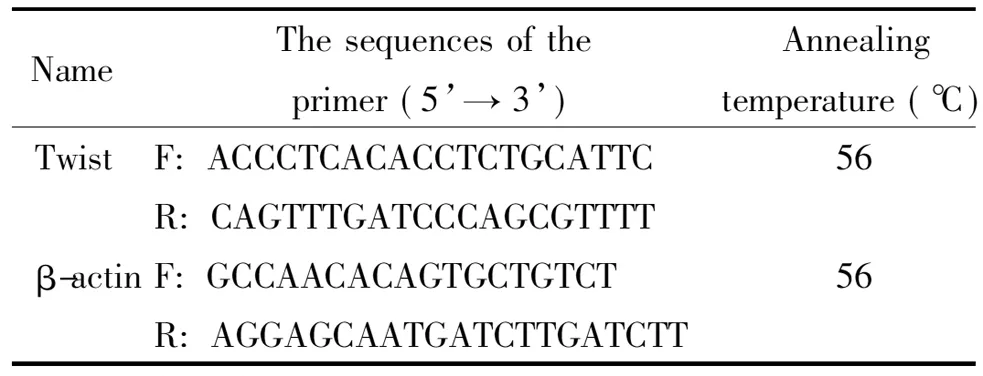
NameThesequencesoftheprimer(5’→3’)Annealingtemperature(℃)TwistF:ACCCTCACACCTCTGCAT-TC56R:CAGTTTGATC-CCAGCGTTTTβ-actinF:GCCAACACAGTGCTGTCT56R:AGGAGCAATGATCTT-GATCTT
F: forward; R: reverse.
3 统计学处理
用SPSS 17.0 统计软件进行数据处理和统计分析。实验数据用均数±标准差(mean±SD)表示,先进行正态性和方差齐性检验,满足正态分布和方差齐性后组间比较采用单因素方差分析。以P<0.05为组间差异有统计学意义。
结 果
1 各组大鼠的一般情况变化与生化指标
与NC组大鼠对比,DM组大鼠的血糖、24 h尿蛋白和肾脏指数均增高;但与DM组对比,仅SAHA组肾脏指数降低有统计学意义(P<0.05),其尿蛋白虽有降低,但差异无统计学显著性,血糖改变不明显,见表2。
表2各组大鼠肾脏指数、血糖和24h尿蛋白量的变化
Table 2. The levels of kidney index (KI), blood glucose (BG) and 24 h urine protein (24 h UP) in different groups (Mean±SD.n=12)

GroupKI(mg/g)BG(mmol/L)24hUP(mg)NC5.73±0.218.89±0.8733.48±11.71DM15.37±1.07*17.81±0.94*913.08±311.42*SAHA13.08±0.10#17.59±1.23505.74±185.82
*P<0.05vsNC group;#P<0.05vsDM group.
2 各组大鼠肾组织的病理学变化
HE染色结果显示,NC组大鼠的肾小球轮廓清晰,肾小管上皮细胞排列整齐,基底膜完整,间质中未见炎症细胞浸润;DM组可见大部分肾小管上皮细胞崩解有空泡变性,肾小管管腔明显扩张,偶见基底膜增厚,间质区有炎症细胞浸润;经过SAHA治疗后,肾小球和肾小管病变有所改变,间质炎症细胞浸润也减少。Masson染色结果显示,NC组大鼠肾小球基底膜及系膜区未见胶原沉积,肾小管间质区未见胶原增多;DM组大鼠可见肾小管管腔明显扩大,肾小球、肾小管基底膜区,肾小球系膜区以及肾小管间质区可见大量胶原纤维沉积即为蓝色条索状物质;经过SAHA治疗后,整个视野蓝色条索状物质有所减少,见图1。
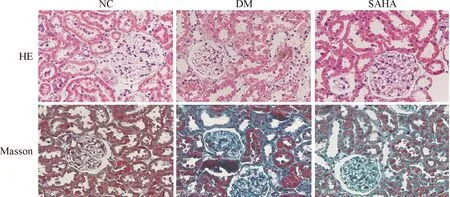
Figure 1. The histological changes of the renal tissues of the rats in different groups (HE and Masson staining, × 400).
图1各组大鼠肾组织的形态学观察
3 各组大鼠肾组织中HDAC1、E-cadherin、α-SMA和Col-Ⅳ蛋白的表达
Western blot实验结果显示,与NC组相比,DM组大鼠肾组织中的E-cadherin蛋白的表达明显降低,而HDAC1、α-SMA和Col-Ⅳ蛋白的表达增加(P<0.05);经过SAHA治疗的大鼠,其E-cadherin蛋白的表达较DM组大鼠有所增加,HDAC1、α-SMA和Col-Ⅳ蛋白的表达明显低于DM组大鼠(P<0.05),见图2。

Figure 2. The protein expression of HDAC1, E-cadherin, α-SMA and Col-Ⅳ in different groups. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vsDM group.
图2各组大鼠肾组织中HDAC1、E-cadherin、α-SMA和Col-Ⅳ蛋白的表达量比较
4 各组大鼠肾组织中 Twist的表达
免疫组化结果显示,DM组大鼠肾组织中Twist的表达量明显增多且分布在肾小管;SAHA给药治疗后,Twist在肾小管中的分布有所减少,见图3。Western blot结果显示,Twist蛋白表达水平在DM组中的表达均比NC组中多(P<0.05);经过SAHA给药干预后,Twist蛋白表达较DM组明显降低(P<0.05)。Real-time PCR结果显示,Twist的mRNA在DM组中的表达均比NC组中高(P<0.05);经过SAHA给药治疗后,Twist的mRNA表达较DM组明显降低(P<0.05),见图4。
5 糖尿病大鼠肾组织中Twist、HDAC1、E-cadhe-rin、α-SMA和Collgen-Ⅳ蛋白表达量的相关性分析
相关性分析显示,在糖尿病大鼠肾组织中,Twist与HDAC1的蛋白表达量呈正相关,相关系数为0.6848(P<0.05);与此同时,Twist蛋白表达量与E-cadherin呈负相关,与α-SMA呈正相关,与Col-Ⅳ呈正相关,相关系数分别为-0.7212、0.9152和0.8909(P<0.01); HDAC1蛋白与E-cadherin呈负相关,与α-SMA呈正相关,与Col-Ⅳ呈正相关,相关系数分别为-0.7455、0.6970和0.6848(P<0.05),见图5。

Figure 3. The expression of Twist in the renal tissues of different groups detected by immunohistochemical staining (×200).
图3免疫组化染色观察各组大鼠肾组织中Twist的表达变化
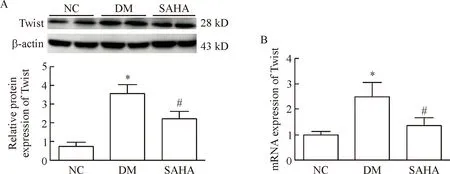
Figure 4. The expression of Twist in renal tissues at mRNA and protein levels in different group. A: the protein expression of Twist in renal tissues; B: the mRNA expression of Twist in renal tissues. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vsDM group.
图4各组大鼠肾组织中TwistmRNA和蛋白的表达

Figure 5. Correlation analysis of Twist, HDAC1, E-cadherin, α-SMA and Col-Ⅳ protein expression in renal tissues of DM group.
图5糖尿病大鼠肾组织中Twist、HDAC1、E-cadherin、α-SMA和Col-Ⅳ蛋白表达量的相关性分析
讨 论
DN发展为慢性肾功能衰竭的最终通路是肾小球硬化及肾小管间质纤维化(tubulointerstitial fibrosis,TIF)。肾小管间质纤维化是DN的主要病理特征,越来越多的证据表明,在TIF进程中肾小管上皮细胞向间充质细胞转分化发挥着关键作用[11]。本课题组和其他学者[12-13]均发现,DM大鼠随着病程的进展,肾小管上皮细胞E-cadherin显著减少而α-SMA大量表达,并伴随FN和胶原纤维等ECM的沉积,表明糖尿病进展过程中肾小管间质发生了EMT,促进了肾功能的恶化,故抑制或逆转EMT的发展对于延缓DN等慢性肾脏疾病具有重要的意义。
Twist基因作为一种癌基因目前备受关注。脊椎动物中,Twist基因存在2种,分别是Twsit1(即Twist)和Twsit2(即Dermo-1),它们编码的蛋白有共同的bHLH结合区域,两者编码的C端有共同的编码序列,但是N端,Twsit2比Twsit1少一个富有氨基酸的区域。研究发现,Twist基因在多种实体肿瘤中高表达,是多种肿瘤细胞发生侵袭和转移的关键调控因子[14]。在这一过程中,Twist能够促使上皮细胞向间充质细胞转分化,促使肿瘤细胞游走,促进了EMT的过程[15]。目前研究发现,Twist与某些器官纤维化有关,且能促进EMT的进展。He等[4]用高糖刺激人腹膜间质细胞,发现细胞的表型发生改变,同时观察到Twist基因大量表达,Twist可与其下游的YB-1基因相互作用,然后激活靶基因的E-box,促进EMT的发生,导致细胞发生纤维化。相反,如果沉默Twist基因,纤维化病变有所逆转。Kida等[3]在UUO肾纤维化模型中发现,EMT的发生率与Twist表达量呈正相关。在慢性低氧诱导的肾纤维过程中,Twist表达增多就会抑制E-cadherin的表达并且可以调控α-SMA的表达;当敲低Twist,缺氧所导致的EMT会发生逆转[16]。但是有关Twist在DN肾小管间质纤维化中的作用以及其调控机制还不清楚。本研究结果显示,在糖尿病大鼠16周的肾组织中观察到了Twist的表达较同期正常对照组明显增多,且伴随着α-SMA和Col-Ⅳ的表达增加,E-cadherin的表达减少,提示在糖尿病肾小管间质纤维化发生发展中,Twist可能参与了EMT转变和ECM沉积的过程。
在纤维化疾病中,HDAC1的活性增强,提示蛋白质的乙酰化/去乙酰化平衡可能被打破。HDAC1属于HDAC中的I类,既可以催化组蛋白发生去乙酰化反应,使核心组蛋白分子N端被乙酰化修饰的赖氨酸残基去乙酰化,从而使染色质处于紧密的超螺旋结构,抑制基因的表达[17];也可以催化某些非组蛋白发生去乙酰化反应,改变其蛋白的翻译后修饰水平,从而改变蛋白质的生理功能或稳定性[18-19]。有研究表明,HDAC1参与调控EMT,能够抑制ZO-1和E-cadherin的启动子活性[20]。本研究中高糖引起了肾小管上皮细胞发生了EMT转变,在此过程中,观察到HDAC1蛋白在糖尿病组中的表达均比正常组中多,且与E-cadherin蛋白的表达呈显著负相关,表明HDAC1可能通过抑制E-cadherin基因启动子活性参与高糖诱导的EMT过程。
有研究报道,HDACs是Twist的上游蛋白,它们可相互作用对靶蛋白进行调节[21-22]。过表达的Twist会影响成骨细胞的分化,它通过募集HDAC1和Smad4,形成抑制复合物,对BMP信号通路有抑制作用;当加入HDACi后,Twist影响成骨细胞的分化有改善,提示二者之间存在某种关系[23]。于是本实验对二者的表达变化进行了相关性分析,发现二者之间呈正相关。SAHA是一种非选择性HDACi,能够抑制HDAC1、2、3和6的活性[8],已由FDA批准用于临床。在食管鳞状细胞癌中,调控EMT的Twist表达上调;运用HDACi后,EMT发生逆转且Twist明显下调[9]。在胆道癌研究上,发现SAHA可以通过降低与CDH1(E-cadherin)有关联的转录因子Twist、Snail1、Snail2、ZEB1、ZEB2和Smad4的亲和力,抑制了Smad4的核转位,这样可以使CDH1表达增多,则EMT表达发生逆转[10]。为了进一步验证,我们使用SAHA对STZ诱导的糖尿病大鼠肾纤维化进行干预,发现SAHA给药治疗的大鼠,HDAC1蛋白表达量明显降低,Twist蛋白和mRNA的表达量也显著减少,二者蛋白的变化存在显著正相关,而且伴随EMT的逆转,ECM沉积也有所减少,大鼠的肾纤维化程度有所改善。提示SAHA有可能通过抑制HDAC1的功能,使转录因子Twist募集HDAC1减少,这样形成的抑制复合物减少,进而抑制组蛋白去乙酰化,使E-cadherin的转录起始不会被抑制,最终有利于EMT的逆转。但是确切的机制还需要在体外高糖培养的肾小管上皮细胞敲低HDAC1或Twist进行深入的研究。
[1] Yang J, Mani SA, Donaher JL, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis[J]. Cell, 2004, 117(7):927-939.
[2] Pozharskaya V, Torres-González E, Rojas M, et al. Twist: a regulator of epithelial-mesenchymal transition in lung fibrosis[J]. PLoS One, 2009, 4(10):e7559.
[3] Kida Y, Asahina K, Teraoka H, et al. Twist relates to tubular epithelial-mesenchymal transition and interstitial fibrogenesis in the obstructed kidney[J]. J Histochem Cytochem, 2007, 55(7):661-673.
[4] He L, Che M, Hu J, et al. Twist contributes to proliferation and epithelial-to-mesenchymal transition-induced fibrosis by regulating YB-1 in human peritoneal mesothelial cells[J]. Am J Pathol, 2015, 185(8):2181-2193.
[5] Cavasin MA, Stenmark KR, McKinsey TA. Emerging roles for histone deacetylases in pulmonary hypertension and right ventricular remodeling (2013 Grover Conference series) [J]. Pulm Circ, 2015, 5(1):63-72.
[6] Sanders YY, Hagood JS, Liu H, et al. Histone deacetylase inhibition promotes fibroblast apoptosis and ameliorates pulmonary fibrosis in mice[J]. Eur Respir J, 2014, 43(5):1448-1458.
[7] Kaimori A, Potter JJ, Choti M, et al. Histone deacetylase inhibition suppresses the transforming growth factor β1-induced epithelial-to-mesenchymal transition in hepatocytes[J]. Hepatology, 2010, 52(3):1033-1045.
[8] Rao SS, Zhang XY, Shi MJ, et al. Suberoylanilide hydroxamic acid attenuates paraquat-induced pulmonary fibrosis by preventing Smad7 from deacetylation in rats[J]. J Thoracic Dis, 2016, 8(9):2485-2494.
[9] Kanamoto A, Ninomiya I, Harada S, et al. Valproic acid inhibits irradiation-induced epithelial-mesenchymal transition and stem cell-like characteristics in esophageal squamous cell carcinoma[J]. Int J Oncol, 2016, 49(5):1859-1869.
[10] Sakamoto T, Kobayashi S, Yamada D, et al. A histone deacetylase inhibitor suppresses epithelial-mesenchymal transition and attenuates chemoresistance in biliary tract cancer[J]. PLoS One, 2016, 11(1):e0145985.
[11] Kang MK, Park SH, Choi YJ, et al. Chrysin inhibits diabetic renal tubulointerstitial fibrosis through blocking epithelial to mesenchymal transition[J]. J Mol Med, 2015, 93(7):759-772.
[12] 王圆圆, 刘丽荣, 李 霜, 等. 蛋白酶体抑制剂MG132减轻糖尿病大鼠肾小管间质纤维化[J]. 基础医学与临床, 2014, 34(2):160-167.
[13] Gong Q, Hou F. Silencing of angiotensin Ⅱ type-1 receptor inhibits high glucose-induced epithelial-mesenchymal transition in human renal proximal tubular epithelial cells via inactivation of mTOR/p70S6K signaling pathway[J]. Biochem Biophys Res Commun, 2016, 469(2):183-188.
[14] Wushou A, Hou J, Zhao YJ, et al. Twist-1 up-regulation in carcinoma correlates to poor survival[J]. Int J Mol Sci, 2014, 15(12):21621-21630.
[15] Cieply B, Farris J, Denvir J, et al. Epithelial-mesenchymal transition and tumor suppression are controlled by a reciprocal feedback loop between ZEB1 and grainyhead-like-2[J]. Cancer Res, 2013, 73(20):6299-6309.
[16] Sun S, Ning X, Zhang Y, et al. Hypoxia-inducible factor-1α induces twist expression in tubular epithelial cells subjected to hypoxia, leading to epithelial-to-mesenchymal transition [J]. Kidney Int, 2009, 75(12):1278-1287.
[17] Pang M, Zhuang S. Histone deacetylase: a potential the-rapeutic target for fibrotic disorders [J]. J Pharmacol Exp Ther, 2010, 335(2):266-272.
[18] Pang M, Ma L, Liu N, et al. Histone deacetylase 1/2 mediates proliferation of renal interstitial fibroblasts and expression of cell cycle proteins[J]. J Cell Biochem, 2011, 112(8):2138-2148.
[19] Choudhary C, Kumar C, Gnad F, et al. Lysine acetylation targets protein complexes and co-regulates major cellular functions[J]. Science, 2009, 325(5942):834-840.
[20] Lei W, Zhang K, Pan X, et al. Histone deacetylase 1 is required for transforming growth factor-β1-induced epithelial-mesenchymal transition[J]. Int J Biochem Cell Biol, 2010, 42(9):1489-1497.
[21] Vesuna F, Lisok A, Kimble B, et al. Twist contributes to hormone resistance in breast cancer by downregulating estrogen receptor-α[J]. Oncogene, 2012, 31(27):3223-3234.
[22] Chen J, Xia J, Yu YL, et al. HDAC5 promotes osteosarcoma progression by upregulation of Twist 1 expression [J]. Tumour Biol, 2014, 35(2):1383-1387.
[23] Hayashi M, Nimura K, Kashiwagi K, et al. Comparative roles of Twist-1 and Id1 in transcriptional regulation by BMP signaling[J]. J Cell Sci, 2007, 120(Pt 8):1350-1357.

