油茶籽粕发酵制备乙醇的研究
聂斌英,刘红民 (宜春学院 化学与生物工程学院,江西 宜春 336000)
乙醇被广泛应用于国民生活的各个方面:食品方面被用作各种酒的配制原料;化工方面是许多化工产品不可缺少的基础原料和溶剂;医药和医疗方面可用于提取、配制各种医药制剂和消毒液。近年来,由于石油等能源的大量消耗以及工业的不断发展导致对能源的需求日益增加,乙醇作为清洁、安全、环保的再生能源被用于燃料及石油添加剂。
传统的乙醇生产是以农作物(大米、玉米、红薯等)为原料。但随着国家粮食价格的不断放宽,乙醇发酵成本剧增。所以寻求廉价的、能取代农作物发酵乙醇的原料成为当务之急。
油茶籽粕中蛋白质和糖类的含量在40%~50%。茶籽多糖主要由6种单糖组成,即木糖、葡萄糖、甘露糖、半乳糖、鼠李糖、阿拉伯糖,蛋白质和糖类物质是生物转化生产乙醇的优质原料。油茶籽粕中的多糖类以及粗纤维能够被微生物发酵生成还原糖,为油茶籽粕生物发酵生产生物能源乙醇提供了物质基础[1]。因此,如何有效地利用油茶籽粕中的多糖、纤维素与半纤维素转换为还原糖,再进一步发酵为乙醇,是油茶籽综合开发利用研究的又一课题。
本文以油茶籽粕为原料,将其粉碎后经酸-菌-酶综合处理后将其中的木质纤维、纤维素、半纤维等物质转换为还原糖,得到水解液。再用氢氧化钙进行澄清处理,去除糠醛等发酵抑制剂。向水解液中接种酵母[2]后通过单因素实验,控制酵母接种量、pH、氯化铵添加量、钙镁离子比的变化,28℃下发酵48 h,以乙醇得率为指标确定各变量范围,排除影响较小的因素pH,最后通过响应面法进行实验,得到最佳发酵条件。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
油茶籽粕,宜春青龙高科有限公司;黄孢原毛平革菌,广东省微生物菌种保藏中心;酵母,安琪酵母股份有限公司;纤维素酶(100 000 U/g),和氏璧生物科技有限公司。
无水乙醇、浓硫酸、重铬酸钾、酒石酸钾钠、3,5-二硝基水杨酸、氢氧化钠、苯酚、无水亚硫酸钠、氯化钙、氯化镁、氯化铵等均为分析纯。
1.1.2 仪器与设备
BS-223S电子天平,北京赛多利斯仪器系统有限公司;LRO数显恒温水浴锅,国华电器有限公司;ZHWY-2102C恒温摇床,上海科导超声仪器有限公司;SW-CJ-ZD超净工作台,苏州苏杰净化设备有限公司;LX-B35L高压蒸汽灭菌锅,上海三中医疗器材有限公司;UV-2800AH紫外可见分光光度计,上海天普分析仪器有限公司;SPX-250BS-II恒温培养箱,上海新药医疗器械制造有限公司。
1.2 实验方法
1.2.1 油茶籽粕酸-菌-酶预处理
油茶籽粕粉碎后,称取20 g进行酸处理:以1∶10 的固液比加入2%的硫酸溶液后在100℃下处理120 min。后将pH调到6.0,再经高压蒸汽灭菌锅灭菌后接种2%的黄孢原毛平革菌,在恒温摇床培养4 d,温度26℃,pH 6.0,转速150 r/min。菌处理完之后,将样品取出进行灭菌,然后加入1%的纤维素酶,进行酶处理,温度50℃,pH 5.0,时间10 min[3]。
1.2.2 去除抑制剂
将样品过滤后往滤液中加入2 g氢氧化钙,与样液快速充分搅拌混合,将pH调到10.0,静置1 h后过滤,再用浓硫酸酸化将pH调到5.5,静置1 d后再次过滤[4]。
1.2.3 发酵制备乙醇
调节水解液发酵初始pH,按一定的钙镁离子比添加氧化钙和氯化镁,添加一定量的氯化铵并接种酵母,于恒温摇床厌氧发酵3 d,温度28℃,转速130 r/min[5]。
1.2.4 分析方法
发酵前样液中总还原糖及发酵后残糖通过DNS法测定。分别取葡萄糖标准溶液(1 mg/mL)0、0.5、1.0、1.5、2.0、2.5 mL于15 mL比色管中,用蒸馏水补足至10 mL,分别加入DNS试剂2.0 mL,沸水浴加热2 min,流水冷却,用蒸馏水补足到15 mL,在520 nm波长下测定吸光度,绘制标准曲线,得出回归方程。再将样品取1.0 mL于15 mL比色管中,与葡萄糖标准溶液做同样处理,在520 nm波长下测定吸光度,将吸光度代入回归方程中,得到还原糖的含量[6]。
乙醇含量的测定通过重铬酸钾氧化分光光度法测定。分别取乙醇标准溶液(2 mg/mL)0、0.3、0.6、0.9、1.2、1.5 mL于10 mL比色管中,分别加入5.0%重铬酸钾溶液(5 g重铬酸钾溶于50 mL蒸馏水中,加入10 mL浓硫酸,加水至100 mL)2.0 mL,加水至10 mL,沸水浴加热10 min,流水冷却5 min,在600 nm波长下测定吸光度,绘制标准曲线,得出回归方程。取1.0 mL样品于10 mL比色管中,与乙醇标准溶液做同样处理,在600 nm波长下测定吸光度,将吸光度代入回归方程中,得到乙醇的含量[7]。
乙醇得率按下式计算。
式中:R1为乙醇得率,%;M为实验测得乙醇量,mg;T为总还原糖量,mg;C为残糖量,mg。
2 结果与分析
2.1 单因素实验
2.1.1 发酵初始pH对发酵的影响
在发酵初始pH分别为3.0、4.0、5.0、6.0、7.0,钙镁离子比为1∶1,氯化铵添加量为0.75%,酵母接种量为0.4%条件下,考察发酵初始pH对发酵的影响,结果见图1。

图1 发酵初始pH对乙醇得率的影响
发酵初始pH对酵母的生长及发酵产乙醇能力有一定的影响。酵母一般在弱酸条件下生长。当发酵初始pH过低时,影响酵母细胞膜的带电状态,改变细胞膜的通透性,影响酵母对营养物质的吸收以及代谢废物的排放,从而影响细胞的生长代谢[8]。当发酵初始pH过高时,增加了发酵液染菌的可能性。由图1可知,随着发酵初始pH的增加,乙醇得率先增后降,pH 5.0后乙醇得率的变化不明显,因此可认为发酵初始pH对乙醇得率的影响并不大。
2.1.2 钙镁离子比对发酵的影响
在发酵初始pH为5.0,钙镁离子比分别为0.1∶1、1∶1、2∶1、3∶1、4∶1,氯化铵添加量为0.75%,酵母接种量为0.4%条件下,考察钙镁离子比对发酵的影响,结果见图2。
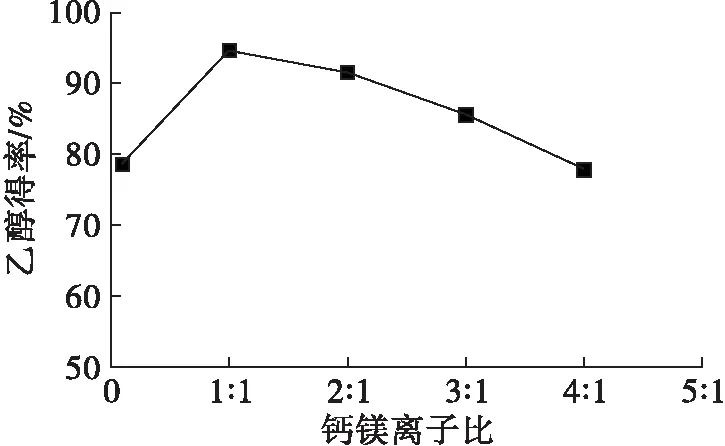
图2 钙镁离子比对乙醇得率的影响
在活细胞的生长代谢过程中,钙离子和镁离子都是重要金属离子,钙离子对细胞骨架有着重要的调控作用[8]。镁离子可通过细胞分裂周期的影响间接影响酵母的生长代谢,同时镁离子还参与多种物质的变化,可促进酵母的发酵能力[9]。目前,国内外已有很多酒厂在酵母发酵过程中添加钙镁离子,以提高发酵效率。但是钙离子的存在会对镁离子有拮抗作用,从而对发酵产生抑制作用,因此在酵母发酵过程中,必须控制合适的钙镁离子比。由图2可知,随着钙镁离子比的增大,乙醇得率先增后降,钙镁离子比在1∶1时,乙醇得率最高。
2.1.3 氯化铵添加量对发酵的影响
在发酵初始pH为5.0,钙镁离子比为1∶1,氯化铵添加量分别为0.25%、0.50%、0.75%、1.00%、1.25%,酵母接种量为0.4%条件下,考察氯化铵添加量对发酵的影响,结果见图3。
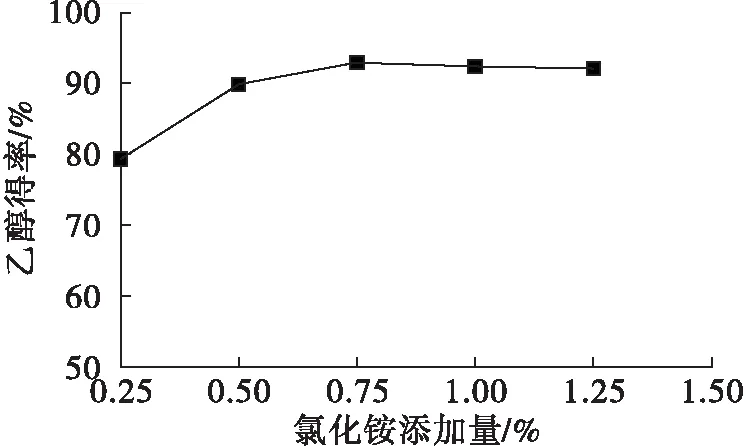
图3 氯化铵添加量对乙醇得率的影响
氮源是酵母合成核糖和蛋白质等含氮物质的重要原料,油茶籽粕中氮含量较低,适当改善发酵液的营养成分,可以对酵母发酵起到促进作用。氮源的添加可以是无机氮如铵盐和尿素等,也可以是有机氮源如酸性蛋白酶[10]。 由图3可知,在氯化铵添加量为0.25%~0.75%范围内,乙醇得率增加,在氯化铵添加量大于0.75%时,乙醇得率的变化不明显。
2.1.4 酵母接种量对发酵的影响
在发酵初始pH为5.0,钙镁离子比为1∶1,氯化铵添加量为0.75%,酵母接种量分别为0.2%、0.3%、0.4%、0.5%、0.6%条件下,考察酵母接种量对发酵的影响,结果见图4。
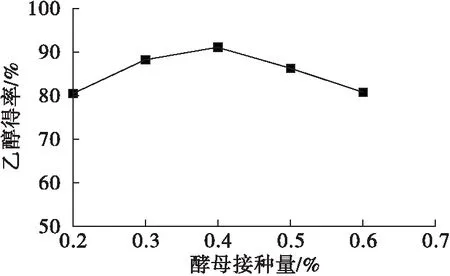
图4 酵母接种量对乙醇得率的影响
酵母接种量对酵母发酵产乙醇的能力有很大影响,当酵母接种量过少时,导致发酵空间利用率不足,造成营养物质的浪费,发酵能力也不足,从而降低乙醇得率。酵母接种量过大时,空间不足,营养物质也不足,从而酵母之间竞争空间和营养,产生竞争性抑制,也会降低乙醇得率。由图4可知,随着酵母接种量的增加,乙醇得率先增后降,在酵母接种量为0.4%时,乙醇得率最高。
2.2 响应面实验优化
通过单因素实验结果,以乙醇得率(R1)为响应值,固定发酵初始pH 5.0,以钙镁离子比(X1),氯化铵添加量(X2),酵母接种量(X3)为自变量,根据Box-Behnken中心组合实验设计原理进行实验设计,响应面因素水平编码见表1,响应面设计及结果见表2,方差分析见表3。

表1 响应面因素水平编码

表2 响应面设计及结果

表3 方差分析
注:P<0.05高度显著,P<0.1显著。
对拟合方程进行一阶偏导,得出3个因素的极值点,分别为钙镁离子比0.87∶1、氯化铵添加量0.76%、酵母接种量0.40%;此时得到乙醇得率为95.4%。为了便于实验操作,将实验条件修正为钙镁离子比0.90∶1、氯化铵添加量0.75%、酵母接种量0.40%,在此条件下进行3组平行实验,得到乙醇得率的平均值为94.3%,与预测值相对偏差为1.15%。
3 结 论
适度发展废物再利用,是解决环境污染、能源浪费、缓解能源危机的有效途径。本文通过单因素实验确定钙镁离子比、氯化铵添加量、酵母接种量这3个主要影响因素的最适范围,通过响应面法,建立乙醇得率对钙镁离子比、氯化铵添加量、酵母接种量的回归模型。确定了油茶籽粕中还原糖发酵产乙醇的最佳工艺条件为:发酵初始pH 5.0,钙镁离子比0.90∶1,氯化铵添加量0.75%,酵母接种量0.40%。在最佳工艺条件下,乙醇得率为94.3%。
[1] 朱培.油茶粕固态发酵及其蛋白质水解物抗氧化的研究[D].长沙:中南林业科技大学,2012.
[2] 李秋园. 纤维素原料酶水解及酒精发酵的研究[D].杭州:浙江大学,2006.
[3] 曹卫星.预处理方法对甜高粱茎秆汁液及残渣乙醇发酵的影响[D].上海:上海交通大学,2012.
[4] QEVEDO-HIDALGO B,MONSALVE-MARIN F, NARVEZ-RINCN P C,et al.Ethanol production bySaccharomycescerevisiaeusing lignocellulosic hydrolysate fromChrysanthemumwaste degradation[J].World J Microbiol Biotechnol,2013,29(3):459-466.
[5] DIEN B S ,COTTA M A ,JEFFRIES T W. Bacteria engineered for fuel ethanol production:current status[J].Appl Microbiol Biotechnol, 2003, 63(3):258-266.
[6] 王俊刚,张树珍,杨本鹏,等.3,5-二硝基水杨酸(DNS)法测定甘蔗茎节总糖和还原糖含量[J].甘蔗糖业,2008(5):45-48.
[7] 林仁权,胡文兰,陈国亮.重铬酸钾氧化分光光度法测定酒中乙醇含量[J].浙江预防医学,2006,18(3):78-79.
[8]王立安,赵俊霞.钙对细胞骨架的调控及其在生命活动中的重要作用[J].生物学杂志,1999,16(4):6-7.
[9] 赵春海,赵土豪.钙镁对酿酒酵母发酵的影响[J].食品研究与开发,2007,28(10):46-48.
[10] 岳瑞雪,孙键,钮福祥,等.响应面分析法优化甘薯乙醇发酵条件[J].核农学报,2014,28(8):1400-1406.

