游泳运动对尘螨诱导哮喘的影响及机制研究
陈建国 袁继芳 姜同仁 钱 峰
(1.安徽财经大学 体育教学部, 安徽 蚌埠 233000 : 2.上海交通大学 医学部, 上海 200025)
哮喘是气道慢性炎症性疾病,由免疫系统中的淋巴细胞、树突状细胞、巨噬细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞以及上皮细胞共同参与的复杂炎症病理过程[1]。在变应原(过敏原)的作用下,患者出现支气管反应性增加、粘液产生增多、气道壁重塑和气道腔缩小等气道高反应性变化,从而导致短时间内呼吸困难、哮鸣和胸部压迫感[2]。哮喘属于当今社会高发疾病,每10位儿童或12位成年人中就有1位是哮喘患者。在世界范围内,有超过3亿的哮喘发病人群,仅在美国,用于该疾病的总花费每年就超过180亿美元[3]。临床上,皮质类固醇和β肾上腺素能激动剂可以短期控制症状,但是这些药物的长期使用,极易产生耐受。除此之外,约有5%-10%严重哮喘患者对现有药物耐受,无法治愈[4-5],全球每年约有49万人因哮喘而丧生[6]。随着空气污染等环境因素变化,哮喘发病率在逐年增加,预计2025年患病人数将达到4亿[5]。因此,寻找并发现潜在的哮喘预防方法及治疗药物,有效提高病人的生活质量,显得迫在眉睫,也极具药物开发的商业价值。
近年来对运动的研究已延伸到通过运动促进健康、预防和治疗疾病等方面[7]。其中,运动在炎症性疾病中的作用备受关注。越来越多的研究表明,不同强度的运动对慢性炎症具有调控作用[8-13],且有文献报道,定期有氧运动可改善肺功能,显著改善哮喘症状,提高患者健康相关的生活质量[14-15]。基于此,本研究预先对小鼠进行游泳训练,并采用Dust mite诱导小鼠哮喘模型,通过分析哮喘性炎症的严重程度探讨游泳运动在哮喘中的作用,为哮喘的防治提供新思路。
1 材料与方法
1.1 实验动物
SPF级C57BL/C雄性小鼠24只(购自上海斯莱克实验动物有限公司),8-12周龄,体重25±3 g。1周适应性喂养后,随机分为对照组和运动训练对照组,每组12只。实验小鼠自由饮食、饮水,小鼠饲养环境温度为20-25℃,湿度55%,12小时循环光/暗周期。
1.2 动物训练方案
小鼠运动方案结合预实验经验,训练组小鼠施加6周无负重游泳训练。第一周的训练时间是30分钟/天,第2-3周的训练时间是45分钟/天,第4-6周以60分钟/天进行训练。每周训练6天,中间休息一天。水温为33±1 ℃,水深50厘米。
1.3 诱导剂的配制
Dust mite铝剂佐剂的配制:将Dust mite溶于PBS,浓度为0.5 mg/mL,再将其与铝剂以体积比1:19进行混合,4 ℃混悬仪上混合0.5小时以上,得Dust mite与铝剂的混合物。鼻内给予Dust mite的配制:将Dust mite溶于PBS,配置成浓度为8.5 mg/mL的浓储(50×),使用前用PBS稀释。
1.4 Dust mite诱导小鼠哮喘模型的建立
动物训练结束后,将上述对照组和运动训练组小鼠再进一步分组,其中对照组随机分为PBS对照组(A,n=6)和Dust mite对照组(B,n=6),运动训练组随机分为运动训练对照组(C,n=6)和Dust mite运动训练组(D,n=6)。游泳运动结束24 h后,戊巴比妥钠麻醉(50 mg/kg)小鼠,使用Dust mite诱导哮喘模型,其中B组和D组在第0天和第5天腹腔给予Dust mite和铝剂佐剂(200 μL/只),模型组第12、13、14天再次鼻内给予Dust mite(50 μL/只/天)进行免疫攻击,A组和C组相对B组和D组分别给予PBS,各组均在第15天处理小鼠。
1.5 主要试剂
苏木素伊红染色液购自武汉博士德生物工程有限公司;ELISA试剂盒(IL-4和IL-5)购自美国R&D公司;IgE检测试剂盒购自eBioscience公司;铝剂佐剂购自美国Thermo Fisher scientific;其他试剂均购自美国Sigma公司。
1.6 实验取材与指标检测
1.6.1 实验取材
运动训练结束并构建Dust mite诱导哮喘模型15天后,麻醉小鼠,待小鼠充分昏迷后,用生物胶带将小鼠以仰卧姿势固定于操作台上。用75%酒精溶液擦拭小鼠颈部及腹部皮肤进行消毒,用灭菌的手术剪沿腹中线剪开皮肤,将皮肤与腹膜剥离,同样的方法剪开腹膜,找到胸腔,用眼科手术剪戳破横膈膜,剪开胸骨,暴露小鼠心肺,用1 mL注射器抽取小鼠心脏血,随后剥离小鼠颈部皮肤、肌肉及气管周围的平滑肌,暴露气管并剪开小口,插入平头针并用手术线固定平头针,向其中缓慢注射0.6 mL DPBS,停顿数秒后,将DPBS从小鼠肺组织中抽出于EP管中,再重新吸取DPBS注射,重复3次,收集肺灌洗液(BALF)于EP管中,放于冰上。将腹主动脉剪开,迅速向右心室中注射10mL的PBS,将肺组织中残留的血液冲洗干净。将其中4叶小肺结扎,并剪下置于液氮中冻存,右侧大肺则用注射器吸取0.6 mL的4%多聚甲醛溶液,缓慢沿平头针注射进入小鼠气管中,将肺组织充满,拔出平头针的同时,迅速扎紧手术缝合线。小心将肺叶剪下,浸泡于4%多聚甲醛中。
1.6.2 小鼠肺组织病理染色(H&E染色)
4%多聚甲醛溶液固定左肺24 h后,将组织依次浸入80%、95%I、95%II、100%I和100%II乙醇溶液各1小时脱水,然后浸入二甲苯溶液I、II分别透明30分钟,再入蜡缸I、II、III分别浸蜡1小鼠,再将组织包埋制成蜡块。蜡块放入-20 ℃冰箱半小时后切片,厚度为4 μm。将切好的组织贴在载玻片上,置于65-70 ℃烘箱烤片30分钟-1小时后,经100%、95%、90%、80%、70%酒精脱蜡并放于蒸馏水。随后将切片浸入苏木精染液内染色5-10分钟,自来水冲洗,用1%盐酸乙醇溶液分化透明,再用1%氨水溶液返蓝,浸入伊红溶液2-5分钟,自来水冲洗,然后70%、80%、95%I、95%II、100%I、100%II、二甲苯I和二甲苯II溶液各3分钟,待晾干后,用中性树脂封片,置于显微镜下观察拍照。
1.6.3 小鼠外周血血浆IgE含量检测
在最后一次鼻内刺激24 h后,麻醉小鼠,收集外周血,离心(3000 rpm,4 ℃,15 min)后收集血浆,参照eBioscience公司IgE试剂盒说明书检测血浆中IgE的含量。
1.6.4 小鼠肺盥洗液中Th2型细胞因子含量检测
在最后一次鼻内刺激24 h后,收集肺盥洗液并离心(500 g,4 ℃,5 min),使用IL-4和IL-5 ELISA试剂盒,按照试剂盒说明书测定肺盥洗液上清中IL-4和IL-5的含量。
1.7 统计分析
本研究各数据结果均采用means ± S.D的方法,统计分析软件为Graphpad Prism 5,采用T检验进行结果分析。
2 实验结果
2.1 游泳运动降低Dust mite诱导小鼠肺组织病理损伤程度
由于在哮喘的发生过程中会有较多的嗜酸性粒细胞等细胞的募集和浸润,组织中的细胞会明显增加。因此,在Dust mite诱导后小鼠的肺组织中会有较多炎性细胞的浸润,通过H&E染色(图1)可以看到,在Dust mite诱导后小鼠肺组织中炎性细胞浸润较PBS对照组明显增多,说明Dust mite诱导小鼠肺部产生的炎性变化,而运动训练组较Dust mite对照组炎性细胞的浸润显著减少,同时PBS对照组与运动训练对照组无明显差异。这一结果说明,运动训练可以改善Dust mite诱导的哮喘性炎症发生的严重程度。
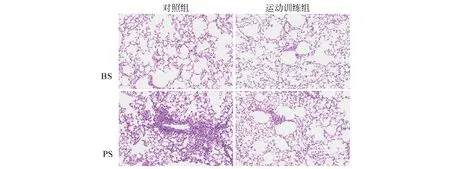
图1 小鼠肺组织H&E染色结果示意图
2.2 运动训练抑制Dust mite诱导小鼠血浆中IgE的产生
哮喘是Th2细胞介导的气道过敏性炎症反应,在过敏原刺激下,IgE产生增加。在最后一次刺激24 h后,收集外周血上清,检测其IgE含量,结果表明,PBS对照组与运动训练PBS组无明显差异,而Dust mite对照组IgE产生量明显升高,运动干预后,血浆中IgE含量较Dust mite对照组显著降低,如图2所示。这一结果表明,运动训练可减轻Dust mite引起的哮喘的发生发展。
2.3 游泳运动改善Th2型细胞因子的产生
在过敏原刺激下,小鼠哮喘发生过程中伴随着Th2细胞因子的产生,包括IL-4和IL-5等。如图3和图4所示,在过敏原Dust mite诱导下,肺盥洗液中IL-4和IL-5的含量较PBS对照组显著增多,而这一现象伴随着游泳运动的干预有所减少,说明运动训练可改善Dust mite诱导的Th2型细胞因子的产生,提示游泳运动可缓解哮喘的发生,并通过减少Th2型细胞因子的产生减低哮喘发生的严重程度。
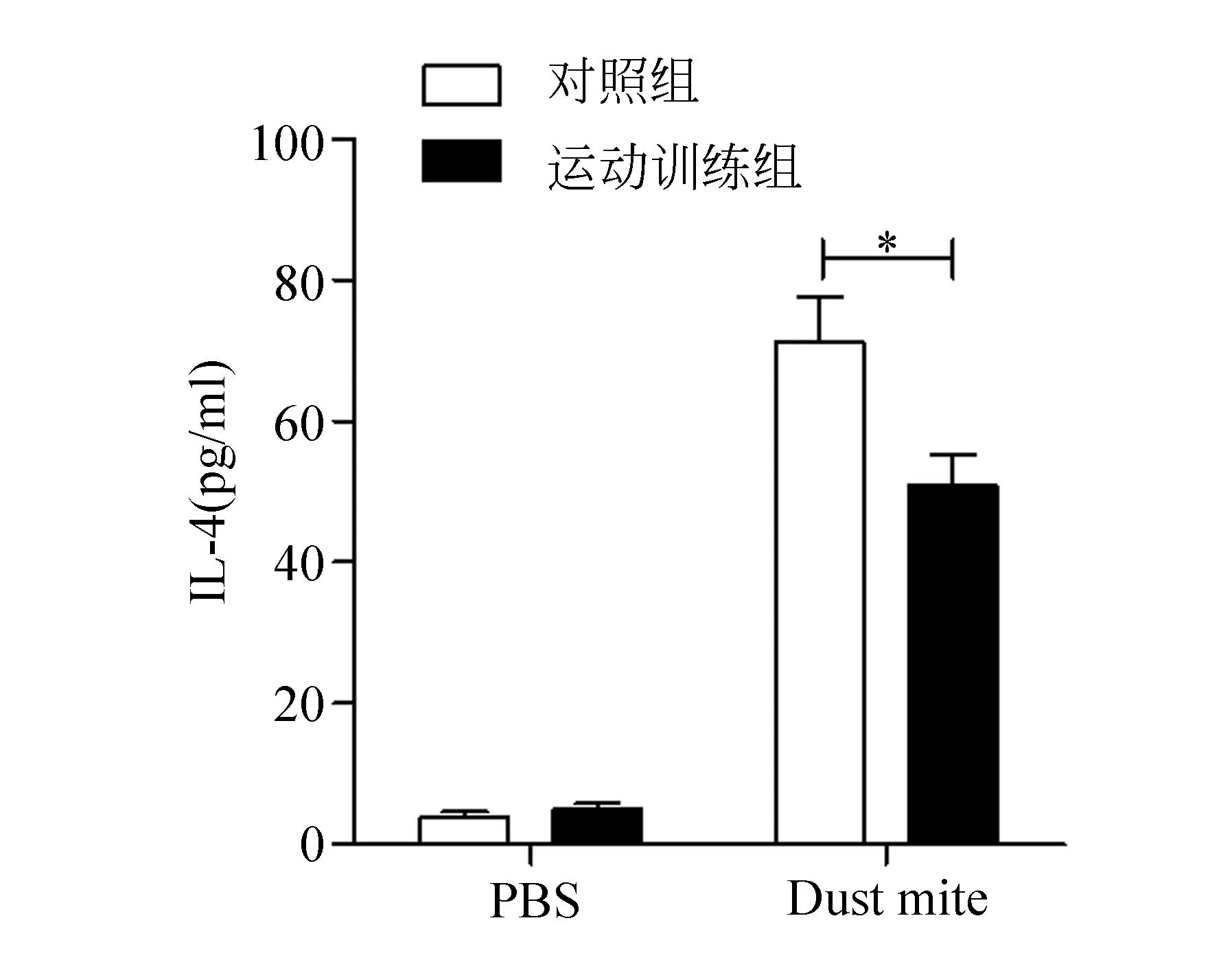
图3 运动训练缓解Dust mite诱导的IL-4的产生(注:与Dust mite对照组相比,*表示P<0.05)
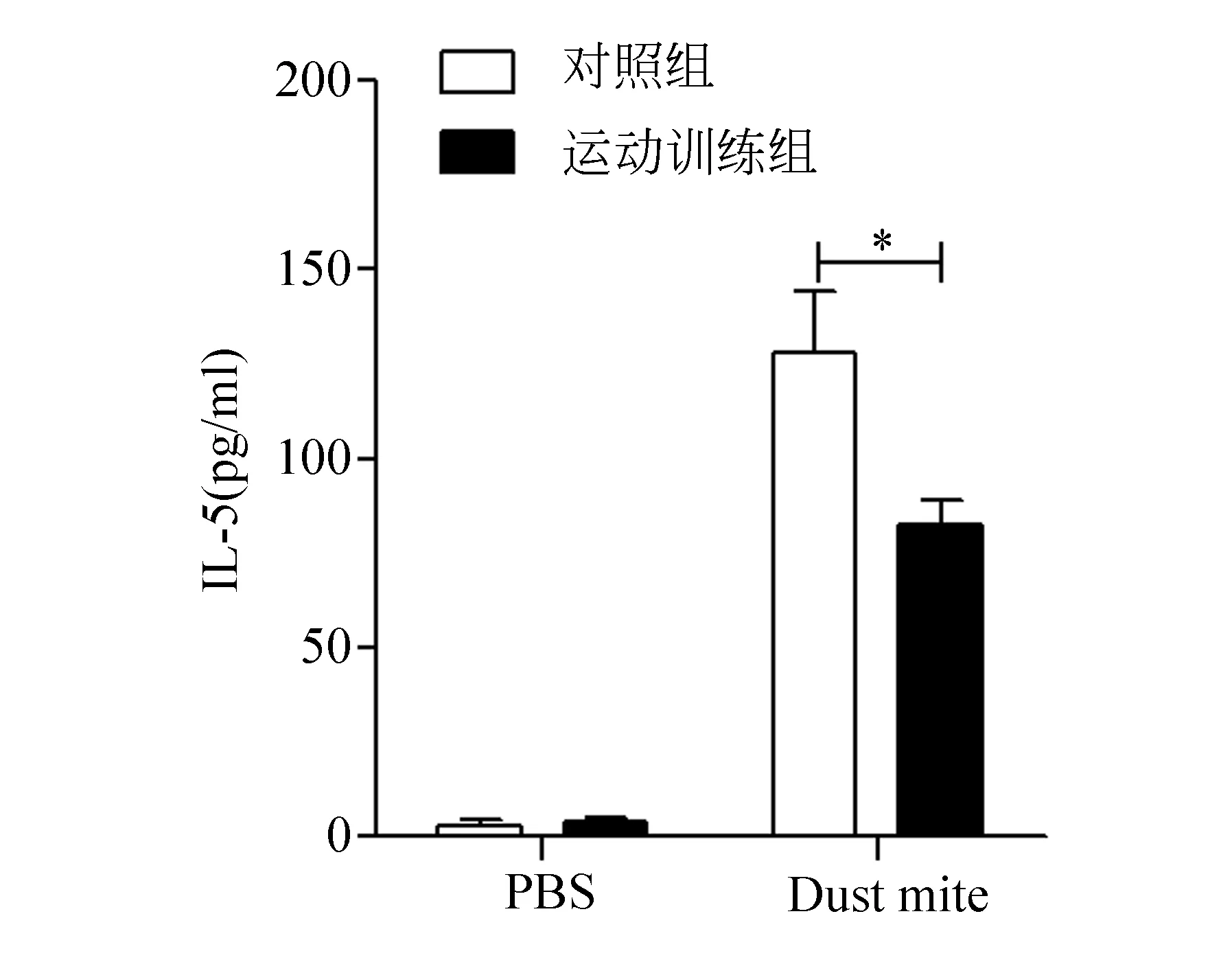
图4 酶联免疫吸附检测肺盥洗液中IL-5含量示意图(注:与Dust mite对照组相比,*表示P<0.05)
3 分析与讨论
随着人类生活水平的提高及运动的普及,科学家们对运动的研究也越来越深入,运动与疾病之间的联系也越来越清晰。近年来的研究表明,不同强度的运动对慢性炎症具有调控作用[8-13]。游泳作为奥运项目之一,深受广大人民群众的喜爱,加上中国健儿在游泳项目上的突破,越来越多的中国人参与到该项运动中来。游泳运动不仅可以强身健体,且可缓解疾病的发生,已有研究表明,游泳可降低糖尿病大鼠炎症反应、慢性炎症反应等[16-19]。但是游泳在哮喘中的作用尚不清楚。因此,本研究探讨游泳运动在Dust mite诱导的哮喘性炎症中的作用,以期为哮喘的防治和治疗提供新方法。
为探讨游泳运动在哮喘性炎症中的作用,本研究对游泳训练组小鼠预先采用6周游泳训练,随后构建小鼠哮喘模型。对小鼠哮喘模型的构建,科研中存在多种方法,本研究中采用Dust mite作为诱导剂,构建了小鼠哮喘模型,模拟临床哮喘的发生。在哮喘的发生过程当中,多种免疫细胞参与其中,肺部存在大量炎性细胞的聚集,尤以嗜酸性粒细胞为主。本实验结果显示,Dust mite诱导小鼠后,肺组织中存在明显炎性细胞的浸润,说明Dust mite可诱导小鼠发生哮喘性炎症,同时,游泳训练干预后Dust mite诱导的炎性细胞浸润显著减少。这一现象说明,游泳运动可改善哮喘发生的严重程度。
哮喘是Th2细胞介导的慢性肺部炎症性疾病,在哮喘的发生过程中,当I型上皮细胞受损,可以释放白介素-25(IL-25)和白介素-33(IL-33)等细胞因子[13,20]调节嗜酸性粒细胞(eosinophil)、T细胞和固有淋巴细胞(innate lymphoid cell, ILC)等免疫细胞功能,诱导IL-4、IL-5、IL-13、IL-9、IL-17、CCL17、CCL22和CCL11等细胞因子和趋化因子分泌[3]。其中,IL-4和IL-5是哮喘发生过程中两类重要的细胞因子,可使嗜酸性粒细胞募集,并促使杯状细胞增生产生包括MUC5AC及MUC5等黏液阻塞气道腔,同时可以活化B细胞产生较多的IgE, 促进哮喘的发生[13]。
免疫球蛋白IgE存在于血中,是过敏反应的介质,为过敏反应的核心物质,在哮喘的发生发展过程中其产生量显著增加[21]。抑制IgE的产生可缓解哮喘的发生,甚至已有IgE抗体被开发用于哮喘的治疗[22]。这些事实均说明IgE含量是哮喘发生过程中的重要指标。本研究通过对血浆中IgE含量检测,发现Dust mite对照组中IgE含量明显增高,而在游泳运动干预后,IgE含量显著下降。这说明游泳运动可缓解哮喘的发生发展。
此外,由于IL-4和IL-5是哮喘发生过程中两类重要的细胞因子,本研究也对各实验组小鼠肺盥洗液中细胞因子的含量进行了检测。实验结果显示,Dust mite对照组IL-4和IL-5含量较PBS组均明显升高,且游泳运动Dust mite组该两类细胞因子的含量均较对照组显著降低。这表明,IL-4和IL-5分泌量增加,参与Dust mite诱导的小鼠哮喘,同时游泳运动可能通过减少IL-4和IL-5的产生发挥抑制哮喘的作用。
4 结论
本研究结果表明,游泳运动可以缓解Dust mite诱导的小鼠肺组织中炎性细胞的浸润、降低血浆中IgE的产生,从而改善了Dust mite诱导的哮喘,这一作用可能是通过下调Th2 型细胞因子IL-4和IL-5的产生而引起的。该研究结果提示,游泳作为一种健康的运动方式,可以有效地预防和改善疾病的发生发展,为哮喘的预防和治疗提供新方向。
[1] Barnes P.J.Immunology of asthma and chronic obstructive pulmonary disease[J]. Nat Rev Immunol.2008, 8(3):183-92.
[2] Edwards M.R., Bartlett N.W., Hussell T., Openshaw P., Johnston S.L.The microbiology of asthma[J].Nat Rev Microbiol.2012, 10(7):459-71.
[3] Lambrecht B.N., Hammad H.The immunology of asthma[J].Nat Immunol,2015,16(1):45-56.
[4] Pelaia G., Vatrella A., Maselli R. The potential of biologics for the treatment of asthma[J]. Nat Rev Drug Discov. 2012, 11(12): 958-72.
[5] Adcock I.M., Caramori G., Chung K.F. New targets for drug development in asthma[J]. The lancet. 2008, 372(9643):1073-87.
[6] GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013. Lancet,2015:385,117-171.
[7] 罗贝贝, 陈佩杰. 运动免疫学研究的现状与展望[J]. 生理科学进展, 2014(4):271-275.
[8] Petersen A M W, Pedersen B K. The anti-inflammatory effect of exercise[J]. J ApplPhysiol, 1985, 98(4): 1154-1162.
[9] Mathur N, Pedersen B K. Exercise as a mean to control low-grade systemic inflammation[J]. Mediat Inflamm, 2009:2008.
[10] Flynn M G, McFarlin B K. Toll-like receptor 4: link to the anti-inflammatory effects of exercise [J]. Exerc Sport Sci Rev, 2006, 34(4): 176-181.
[11] Gleeson M, Bishop N C, Stensel D J, et al. The anti-inflammatory effects of exercise: mechanisms and implications for the prevention and treatment of disease[J]. Nat RevImmunol, 2011, 11(9): 607.
[12] Flynn M G, McFarlin B K, Phillips M D, et al. Toll-like receptor 4 and CD14 mRNA expression are lower in resistive exercise-trained elderly women[J]. J ApplPhysiol, 2003, 95(5): 1833-1842.
[13] McFarlin B K, Flynn M G, Campbell W W, et al. TLR4 is lower in resistance-trained older women and related to inflammatory cytokines[J]. Med Sci Sports Exerc, 2004, 36(11): 1876-1883.
[14] Tetzlaff K, Thomas P S. Short-and long-term effects of diving on pulmonary function[J]. European Respiratory Review, 2017, 26(143): 160097.
[15] Al-Muhsen S, Johnson J R, Hamid Q. Remodeling in asthma[J]. Journal of allergy and clinical immunology, 2011, 128(3): 451-462.
[16] 贺强, 季浏. 4周游泳训练对db/db小鼠脂肪组织巨噬细胞介导炎症的影响[J]. 体育学刊, 2015(5):133-138.
[17] 柏海平, 高前进. 游泳运动对2型糖尿病大鼠炎症和氧化应激状态的影响[J]. 中国康复医学杂志, 2013, 28(8):708-713.
[18] 贺强, 季浏. 一次急性耐力游泳运动对DIO小鼠脂肪组织巨噬细胞介导的慢性炎症的影响[J]. 北京体育大学学报, 2016(2):61-68.
[19] 张坦, 崔迪, 张喆,等. 游泳运动对糖尿病小鼠骨骼肌AMPK/SIRT1/NF-κB炎症信号通路的影响[J]. 体育科学, 2016, 36(9):40-47.
[20] Wynn, T. A., Chawla, A., and Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature,2013, 496(7446):445-55.
[21] Gould H J, Sutton B J. IgE in allergy and asthma today[J]. Nature Reviews Immunology, 2008, 8(3): 205-217.
[22] Milgrom H, Fick Jr R B, Su J Q, et al. Treatment of allergic asthma with monoclonal anti-IgE antibody[J]. New England Journal of Medicine, 1999, 341(26): 1966-1973.

