乌司他丁对水下爆炸继发性急性肺损伤兔基质金属蛋白酶-9等的影响
王前进,黄奕江,叶长青,邵先安,徐长江,丁体龙,马宏昊,郝 建,齐晓林
爆炸性武器在水下爆炸时均能造成水下冲击伤,文献报道第二次世界大战中曾发生数千例水下冲击伤伤员,且伤情重,救治难度大,病死率高[1]。现代战争中,水下冲击伤仍是海战和岛礁登陆作战时最常见的损伤。肺是水下冲击波致伤和致死的靶器官,急性肺损伤(acute lung injury,ALI)是早期死亡的主要原因,在水下冲击伤早期救治中,重点应加强对肺损伤的救治[2]。研究表明,炎症介质在继发性肺损伤中发挥重要作用[3]。乌司他丁是一种蛋白酶抑制剂,可有效调节炎症递质水平,抑制机体炎症反应,从而起到保护肺功能的作用。本试验建立兔水下爆炸肺损伤动物模型,研究乌司他丁对继发性急性肺损伤兔MMP-9等细胞因子水平影响,探讨其治疗作用及机制。
材料与方法
1 实验材料
健康新西兰兔30只,雌雄不限,质量(2.15±0.26)kg,购自安徽长临河医药科技有限公司[许可证号syxk(皖)2007-002],实验兔均按标准饲养条件饲养。乌司他丁注射液(广东天普生化医药股份有限公司);MMP-9试剂盒(上海江莱生物科技有限公司,批号:201602);NE试剂盒(上海江莱生物科技有限公司,批号:201602);TNF-α试剂盒(上海江莱生物科技有限公司,批号:201602);蛋白提取和SDS-PAGE凝胶制备试剂盒(北京信诺金生物科技有限公司),BCA蛋白浓度测定试剂盒(上海碧云天生物科技有限公司),western blot kit(Shanghai BBI Life Sciences,批号:C600392),MMP-9抗体(STANTA CRUZ BIOTECHNOLOGY,USA,批号:SC-21733),GAPDH抗体(STANTA CRUZ BIOTECHNOLOGY,USA,批号:SC-66163),Blue Plus II Protein Marker(14~120kDa)(北京全式金生物技术有限公司);血气分析采用美艾利尔Epoc®血气分析系统。
2 爆炸装置
爆炸源为太安炸药,压力数据测试系统包括安捷伦示波器(型号dso5054A),水下压力传感器为pcb138A25(由中国科学技术大学近代力学系爆炸实验室提供)。
3 实验方法
3.1实验分组 将30只新西兰兔随机数字表法分为对照组(N组)、爆炸组(I组)和爆炸后乌司他丁治疗组(B组),每组10只。造模完成后,B组经右颈外静脉注射乌司他丁注射液(10万单位/kg),N组、I组注射等量生理盐水。
3.2模型建立 氯胺酮40mg/kg、氟哌利多1.6mg/kg经肌肉注射麻醉实验兔[4],兔胸部及颈部备皮,分别经左颈总动脉和右颈外静脉放置留置针。新西兰兔固定在自制钢质保护箱中,保护箱在兔胸部处开一窗口,窗口大小与兔子胸部一致,且可调节。头部露出水面,其余部位如腹部、四肢等均保护在箱体内,将兔保护箱放置于水下爆炸罐内并固定。爆源采用太安炸药1g,制成圆柱状药包,炸药采用导爆管起爆,同时保证新西兰兔胸部中心与水下压力传感器位于同一水平线上。爆炸实验操作全部由专业人员实施[5]。
3.3标本采集 各组经留置的动脉针分别采集伤后12、24h的动脉血,行血气分析,同时采集部分动脉血离心,分离血清备用。伤后24h放血处死实验兔。夹闭左主支气管,0.9%氯化钠10mL经气管反复3次灌洗右肺,抽取支气管肺泡灌洗液(BALF)离心备用。取左肺下叶,吸干表面杂质,测干湿比重。左肺上叶下部经0.9%氯化钠冲洗,10%甲醛固定。其余左上肺叶做匀浆。
4 观察指标
4.1MMP-9浓度测定 动脉血离心取血清,ELISA测定浓度,试验步骤严格按照试剂盒说明书操作。
4.2Western blot法测定MMP-9表达水平 取肺组织50mg,加入800μL RIPA细胞裂解液进行裂解,13 000rpm离心30min,将上清液转入新管中即为总蛋白。经过电泳、转膜、封闭、一抗孵育、二抗孵育等步骤后,得到蛋白条带;实验过程严格按照说明书进行。
4.3RT-PCR法测定MMP-9 采用TRIzol法提取各组肺组织总RNA,反转录成 cRNA并进行荧光定量PCR。选定 GAPDH为内参基,根据扩增曲线确定Ct值,荧光定量采用2-ΔΔCt法计算目的基因表达相对值。引物序列如下:MMP-9上游引物:5′-ACACACGACGTCTTCCA-3′,MMP-9下游引物:5′-GAGCTTTGACATCCTGCA-3′,MMP-9探针:5′FAM-CTACTTCTGCCAGGACCGCTTCTTCTG-TAMRA3′,GAPDH上游引物:5′-GCCATCACTGCCACCCA-3′,GAPDH下游引物:5′-CAGTGAGCTTCCCGTTC-3′,GAPDH探针:5′FAM-CCGCCCAGAACATCATCCCTG-TAMRA3′。
4.4BALF中性粒细胞弹性蛋白酶(NE)含量测定 回收BALF约6mL,3000r/min离心10min(室温),取上清液存于-80℃冰箱。按照ELISA说明书测定。
4.5TNF-α浓度测定 动脉血离心取血清,ELISA测定浓度,试验步骤严格按照试剂盒说明书操作。
4.6肺病理组织学观察 左肺上叶下部经0.9%氯化钠冲洗,10%甲醛固定,石蜡包埋,切片4~5μm厚,HE染色,光镜下由2名有经验的病理医生分别独立观察。
4.7湿干比(W/D) 取左肺下叶,吸干表面杂质,天平称取肺湿重后,置于80℃烘箱烘72h至烘干,称取干重,计算W/D。
4.8动脉血气分析 经左颈总动脉留置管采动脉血2mL,即刻行血气分析。
5 统计学分析
结 果
1 血清和肺组织MMP-9的含量比较
I组12、24h血清MMP-9含量均较N组升高(P<0.05),B组的12、24h血清MMP-9含量均较I组降低(P<0.05);I组肺组织MMP-9 mRNA的相对表达量较N组升高(P<0.05),B组肺组织MMP-9 mRNA的相对表达量较I组降低(P<0.05)。见表1。

表1 血清和肺组织MMP-9的含量比较(n=10)
与对照组比较:*P<0.05;与爆炸组比较:#P<0.05
2 Western blot法测定各组MMP-9表达水平
I组MMP-9蛋白表达最明显,B组的MMP-9蛋白表达较I组降低。见图1。
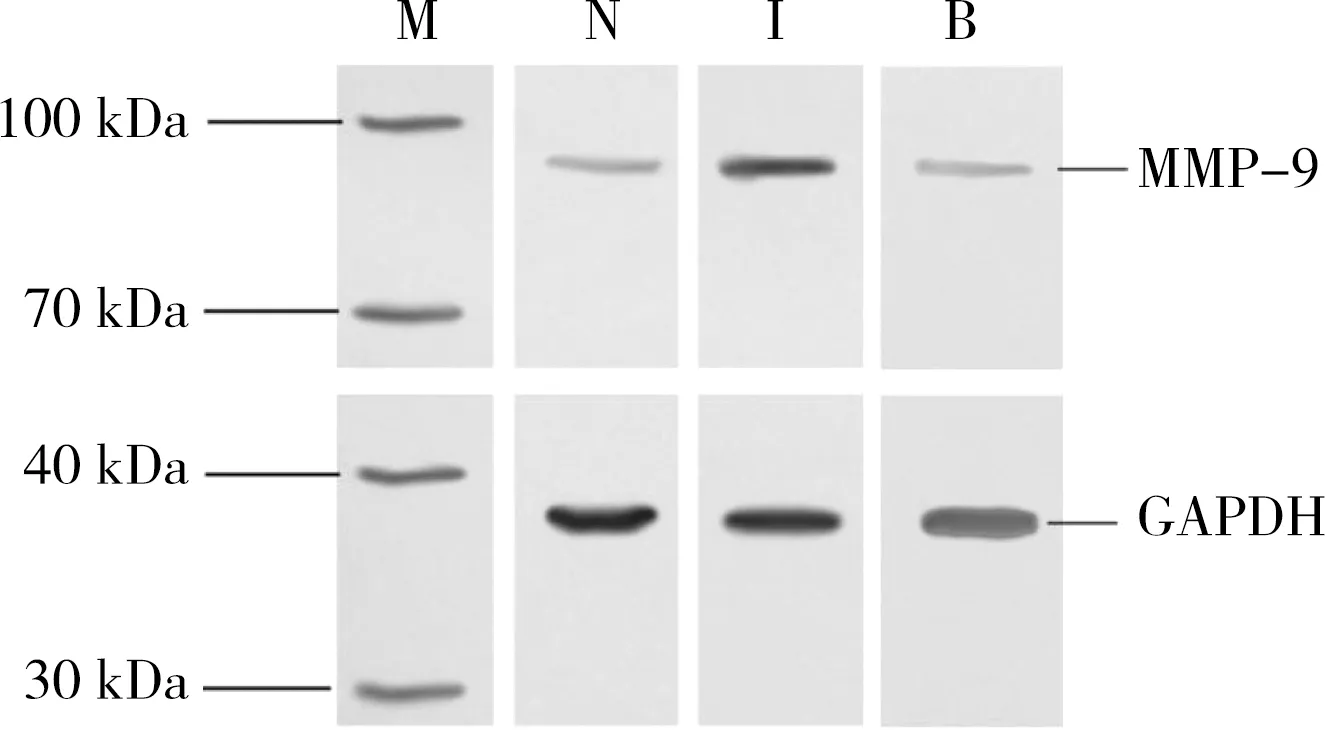
图1 Western blot法测定各组MMP-9表达水平
3 肺W/D、BALF中NE含量比较
I组W/D、BALF中NE含量均较N组升高(P<0.05),B组的W/D、BALF中NE含量较I组降低(P<0.05)。见表2。

表2 肺W/D、BALF中NE含量比较(n=10)
与对照组比较:*P<0.05;与爆炸组比较:#P<0.05
4 血清TNF-α和动脉PaO2比较
I组12h、24h血清TNF-α含量均较N组升高(P<0.05),B组的12、24h血清TNF-α含量均较I组降低(P<0.05);I组24h PaO2较N组降低(P<0.05),B组24h PaO2较I组升高(P<0.05)。见表3。
5 肺组织HE染色
N组肺组织结构无明显损伤,肺泡结构完整,无明显水肿及炎症等改变(图2);I组肺组织结构损伤明显,肺泡壁断裂破碎,肺间质及肺泡腔水肿、出血,大量多形核粒细胞(PMN)浸润,间质毛细血管内血流淤滞(图3),提示ALI模型复制成功;B组肺组织出血渗出及间质增宽程度较I组明显减轻(图4)。

表3 血清TNF-α和动脉PaO2比较
与对照组比较:*P<0.05;与爆炸组比较:#P<0.05
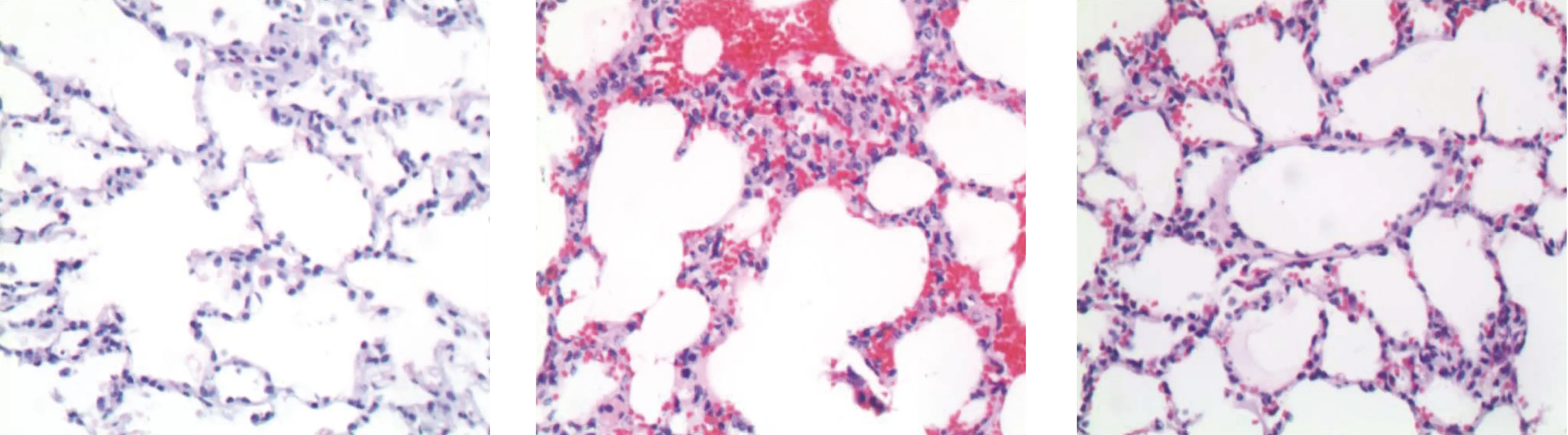
图2 N组肺组织(HE ×100)图3 I组肺组织(HE ×100)图4 B组肺组织(HE ×100)
讨 论
水下爆炸产生冲击波,直接作用于胸部,对肺造成原发性损伤。大量多形核粒细胞(PMN)在肺部聚集,激活并释放NE、MMP-9等多种炎症介质,引起继发性损伤,不及时救治,易导致急性呼吸窘迫综合征[6],早期病死率极高[7]。
水下冲击波直接损伤肺组织,肺泡巨噬细胞被激活并释放多种炎性因子,如TNF-α、白细胞介素等,这些细胞因子介导PMN聚集,黏附在肺毛细血管内皮细胞上,激活并脱颗粒,释放NE、MMP-9等多种炎症介质。有研究认为,在激活的中性粒细胞释放的各种组织损伤因子中,血浆蛋白酶如NE、MMP-9被认为与急性肺损伤和急性呼吸窘迫综合征密切相关[8-9]。急性肺损伤的早期阶段,在肺组织、BALF中均可检测到高浓度的MMP(主要是MMP-9)[10]。NE能够分解几乎所有细胞外基质(ECM)和许多重要血浆蛋白,造成弹力纤维和胶原纤维断裂、分离,肺泡扩张;MMP-9直接作用于肺泡毛细血管基膜,使其通透性增加,直接参与肺损伤过程中的细胞外基质的分解和重塑。本实验结果显示,爆炸组12h TNF-α明显升高,24h仍高于对照组,BALF中NE也明显升高,血清12、24h MMP-9均高于对照组,肺组织MMP-9蛋白和mRNA的表达水平也明显升高。光镜下肺泡间隔明显增宽,PMN聚集,肺泡壁断裂断裂,可见肺大泡形成。肺W/D较对照组升高,说明肺水肿严重。24h动脉PaO2较对照组升高,提示呼吸功能受损。以上均说明细胞因子在水下爆炸继发性肺损伤中发挥重要作用,MMP-9可以作为炎症的早期检测指标,可预示炎症的发生[11]。
多种炎症因子介导的肺部失控性炎症反应是ALI主要病理生理基础,有效控制和减轻肺部过度炎症反应是治疗关键[12]。乌司他丁系从健康成年男性尿液中分离纯化而得的一种糖蛋白,属于Kunitz型蛋白酶抑制剂的一种,能够抑制多种蛋白、糖和脂类水解酶的活性,具有抑制炎症介质释放、抑制细胞因子产生、清除自基、稳定溶酶体膜、抑制溶酶体酶释放的作用,对肺损伤起保护作用。TNF-α是最主要也是最初启动炎性反应的炎性细胞因子,能激活细胞因子级联反应,诱发炎性介质合成,导致炎性反应失控。乌司他丁通过抑制TNF-α的过度生成,控制炎症反应程度,进而抑制中性粒细胞的活化,阻抑炎症反应,达到保护肺功能的目的[13]。有研究发现乌司他丁通过抑制肺组织中中性粒细胞浸润和炎症介质的过度释放,有效保护油酸所致的大鼠 ALI,显著改善血氧饱和度[14]。本实验静脉注射乌司他丁12h,血清TNF-α即明显降低,24h BALF中NE、血清和肺组织中MMP-9较爆炸组降低,病理检查证实应用乌司他丁后肺组织出血渗出及间质增宽程度明显减轻,PMN减少,血气分析提示24h动脉PaO2升高,肺W/D明显降低。说明静滴乌司他丁后,急性肺损伤明显好转,治疗有效。分析其作用机制可能为: 乌司他丁抑制TNF-α产生,阻止PMN在肺内集聚、粘附,减少NE、MMP-9等炎症介质释放; 乌司他丁水解NE,降低活性,减轻NE触发的“瀑布样级联释放”;乌司他丁抑制MMP-9在血清和肺组织的表达,减轻对肺的损伤。
综上所述,NE、MMP-9可以作为水下爆炸ALI指标,但BALF需行支气管镜检查才能获取,BALF中NE不能作为常规检测。MMP-9可以作为炎症的早期检测指标,在ALI发生中起重要重要,血清ELISA检测方便易行,能反映水下爆炸ALI程度及治疗效果。乌司他丁通过抑制NE、MMP-9表达,改善肺毛细血管通透性、减少渗出,减轻水下爆炸致家兔 ALI的程度,可有效治疗ALI。
[1] Bellamy RF,Zaitchuk K.Conventional warfare ballistics,blast and burn injuries-textbook of military medicine(Part 1,Vol 5)[M].Washington D.C:Office of the Surgeon General Dept of the Army,1991:231-232,258-260.
[2] 杨志焕,朱佩芳,蒋建新,等.水下冲击伤损伤的特点的初步探讨[J].中华创伤杂志,2003,19(2):111-114.
[3] 张金洲,王文,段维勋,等.胸部爆炸伤后原发和继发性肺损伤机制研究[J].创伤外科杂志,2007,9(4):347-350.
[4] 胡玉红.一种新的家兔麻醉方法[J].中国实验动物学杂志, 2001,11(3):183.
[5] 万晓智,马宏昊,沈兆武,等.RDX 基铝纤维炸药与铝粉炸药水下爆炸性能比较[J].振动与冲击,2014,24(33):129-123.
[6] 张兆瑞,陈良安.原发性肺冲击伤临床研究[J].解放军医学院学报,2013,34(9):997-999.
[7] Cereda M,Xin Y,Meeder N,et al.Visualizing the propagation of acute lung injury[J].Anesthesiology,2016,124(1):121-131.
[8] Lanchou J,Corbel M,Tanguy M,et al.Imbalance between matrix metalloproteinases(MMP-9 and MMP-2)and tissue inhibitors of metalloproteinases(TIMP-1 and TIMP-2)in acute respiratory distress syndrome patients[J].Crit Care Med,2003,31(2):536-542.
[9] 赵鸿飞,腾林,刘先哲.基质金属蛋白酶及抑制剂与急性肺损伤/呼吸窘迫综合征[J].医学综述,2011,17(6):817-819.
[10] Fligiel SE,Standiford T,Fligiel HM,et al.Matrix metalloproteinases and matrix Metalloproteinases inhibitors in acute lung injury[J].Hum Pathol,2006,37(4):422-430.
[11] Warner RL,Narasimharao B,Nerusu KC, et al.matrix metalloproteinases in acute inflammation:induction of MMP-3 and MMP-9 in fibroblasts and epithelial cells following exposure to pro-inflammatory mediators in vitro[J].Exp Mol Pathol, 2004,76(3):189-195.
[12] 李文华,宋志芳,单慧敏.乌司他丁对脓毒症大鼠肺损伤的保护作用[J].中华急诊医学杂志,2007,16(2):132-137.
[13] Kanayama S,Yamada Y,Onogi A, et al.Molecular structure and function analysis of bikunin on down-regulation of tumor necrosis factor-alpha expression in activated neutrophils[J].Cytokine,2008,42(2):191-197.
[14] Ito K,Mizutani A,Kira S,et al.Effect of ulinastatin,a human urinary trypsin inhibitor,on the oleic acid-induced acute lung injury in rats via the inhibition of activated leukocytes[J].Injury,2005,36(3):387-394.

