术前胸腺肽α1新辅助化疗对老年食管癌患者术后免疫功能的影响
陈万忠,彭木开,黄于佳,邵文龙
(1.广东省云浮市人民医院,广东 云浮 527300;2.广州医科大学第一附属医院,广东 广州 510030)
食管癌(esophageal cancer,EC)因发病隐匿、早期诊断困难,大部分患者确诊时已经到了晚期阶段[1],是我国最常见的恶性肿瘤之一。Ⅱ、Ⅲ期EC患者除接受大范围手术外,术后还需接受辅助化疗以改善其预后[2]。近年来在恶性肿瘤术前采用DP(多西他赛+奈达帕)方案化疗,可使肿瘤缩小、降低病理分期和控制远处微小转移病灶,提高了手术成功率及生存率[3]。但化疗后的不良反应,可能对患者造成沉重的身心负担,特别是对老年EC患者,因其器官功能衰退、高龄等各种因素,对化疗的耐受性差[4-6]。因此如何提高老年食管癌患者的免疫功能,增强其对化疗及手术的耐受性具有重要的意义。近年来,人工合成的胸腺肽α1逐渐应用于EC术后化疗方案中,它是一种提高机体免疫功能的生物反应调节剂,国内外学者采用其用于不同恶性肿瘤,已获得满意疗效。本研究通过对46例Ⅱ、Ⅲ期老年EC患者进行前瞻性研究,旨在探讨胸腺肽α1新辅助化疗对Ⅱ、Ⅲ期老年EC患者术后免疫功能的影响。现报告如下。
1 资料与方法
1.1一般资料:选取我院2010年3月~2016年9月老年EC患者46例为研究对象,随机分为两组,各23例,纳入标准:①年龄60~72岁;②经肝脏B超、胸片等检查,纤维胃镜确诊食管癌,无远处转移,临床分期为T3N0M0、T2N1M0和T3N1M0期,有手术切除适应证;③患者入院前均未接受过放化疗及其他抗肿瘤治疗,所有患者KPS评分≥80分,肝肾功能、血常规、心肺功能均能耐受化疗及手术治疗。其中对照组女11例,男12例,年龄60~71岁,平均(62.8±5.2)岁;病理类型腺癌10例、鳞癌13例;临床分期为Ⅱ期的有10例(T3N0M05例,T2N1M05例),Ⅲ期T3N1M0 13例;治疗组女12例,男11例,年龄60~72岁,平均(63.1±4.9)岁;病理类型腺癌8例,鳞癌15例;临床分期为Ⅱ期的有9例(T3N0M0 5例,T2N1M0 5例),Ⅲ期T3N1M0 14例。两组患者一般资料、病理类型、病理分期等方面比较差异无统计学意义。见表1。
表1两组患者详细资料
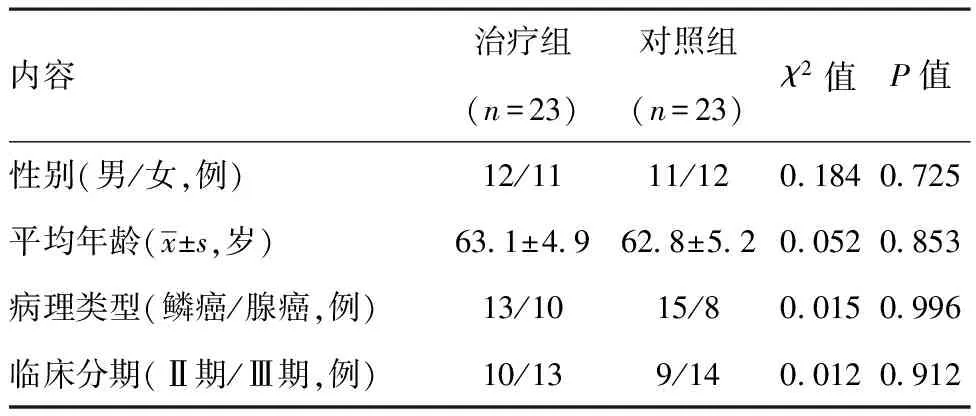
内容治疗组(n=23)对照组(n=23)χ2值P值性别(男/女,例)12/1111/120 1840 725平均年龄(x±s,岁)63 1±4 962 8±5 20 0520 853病理类型(鳞癌/腺癌,例)13/1015/80 0150 996临床分期(Ⅱ期/Ⅲ期,例)10/139/140 0120 912
1.2方法:所有患者术前均行DP方案(第1天,多西他赛75 mg/m2,静脉滴注;第2天:奈达铂80 mg/m2,静脉滴注)辅助化疗,3周为1个周期,共进行2个周期,化疗结束后休息2周,再进行手术。另外,治疗组于化疗前3 d开始,予胸腺肽α1( 1.6 mg/次,1次/d)皮下注射,直至化疗结束后1周。
1.3细胞免疫功能检测:分别于化疗前1天、化疗1周期、2周期及手术后7 d早晨(8∶00~9∶00)空腹采集患者静脉血,应用流式细胞仪检测外周血淋巴细胞及其亚群。分别计数NK细胞含量变化及T细胞亚群(CD4+、CD8+、CD4+/CD8+、CD3+)的阳性百分率。用药前、后各取患者2 ml EDTA抗凝的新鲜血备用。采用鼠抗人CD3+、CD4+、CD8+、CD16+、CD56+直标荧光抗体(Immunotech公司,法国)标记样本,Blying solytion( Immunotech 公司,法国) 溶解红细胞后,以Beckman Coulter Epics XL流式细胞仪检测NK细胞数量(CD16+CD56+),淋巴细胞亚群水平(CD3+、CD4+、CD8+),CD3+、CD3+CD4+、CD3+CD8+、CD16+CD56+分别主要代表总T、Th、Ts及NK细胞。

2 结果
2.1化疗不良反应发生情况:所有患者均完成化疗,无术中或术后死亡患者。不良反应主要表现为恶心、呕吐、粒细胞减少和食管炎等,二者比较,治疗组显著低于对照组,差异有统计意义(P<0.05) 。见表2。
表2化疗期间两组患者不良反应发生比较[例(%)]
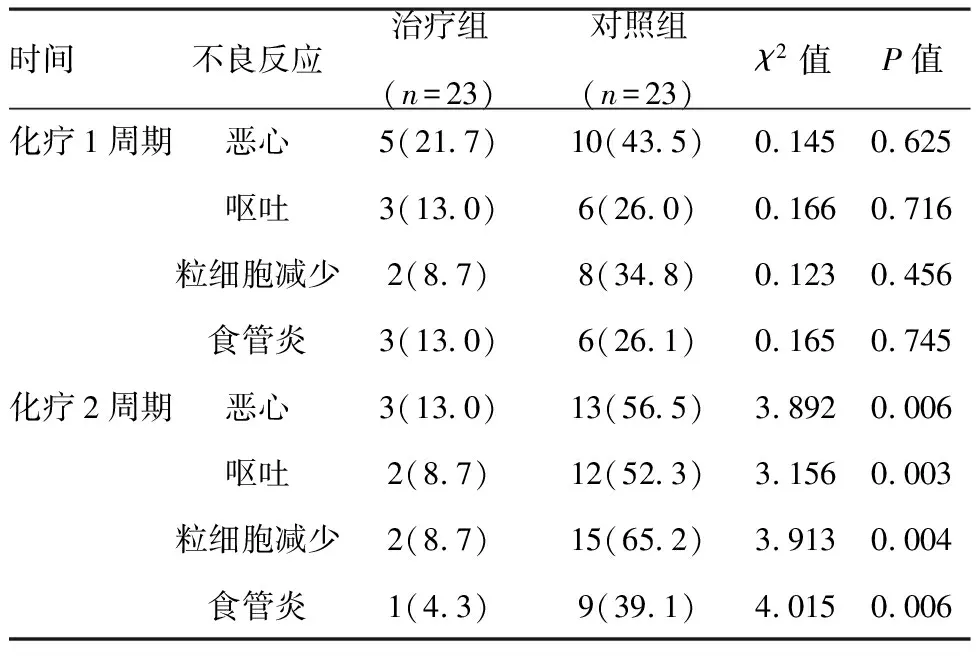
时间不良反应治疗组(n=23)对照组(n=23)χ2值P值化疗1周期恶心5(21 7)10(43 5)0 1450 625呕吐3(13 0)6(26 0)0 1660 716粒细胞减少2(8 7)8(34 8)0 1230 456食管炎3(13 0)6(26 1)0 1650 745化疗2周期恶心3(13 0)13(56 5)3 8920 006呕吐2(8 7)12(52 3)3 1560 003粒细胞减少2(8 7)15(65 2)3 9130 004食管炎1(4 3)9(39 1)4 0150 006
2.2术后并发症的发生情况:治疗组并发症总发生率(21.74%)低于对照组发生率(47.83%),但二者差异无统计学意义(χ2=1.578,P=0.356),术后并发症主要为肺部感染、吻合口瘘、肺不张、呼吸衰竭、心律失常、切口感染等。其中,肺部感染发生率,两者比较差异具有统计学意义(P<0.05)。见表3。
表3两组患者术后并发症反应发生情况[例(%)]

术后并发症治疗组(n=23)对照组(n=23)χ2值P值吻合口瘘1(4 3)2(8 7)0 0140 916肺部感染1(4 3)6(26 1)1 8160 043肺不张1(4 3)2(8 7)0 0130 986心律失常2(8 7)1(4 3)0 0130 984
2.3细胞免疫情况:化疗前,两组患者外周血CD3+、CD4+、CD8+、CD4+/CD8+水平比较,差异无统计学意义(P>0.05);化疗1周期、2周期和术后7天,对照组CD3+、CD4+、CD8+、CD4+/CD8+逐渐下降,与化疗前比较,差异有统计学意义(P<0.05);治疗组CD3+、CD4+、CD8+、CD4+/CD8+水平逐渐升高,与化疗前比较,差异有统计学意义(P<0.05);治疗组CD3+、CD4+、CD8+、CD4+/CD8+水平、NK细胞含量不同时期均显著高于对照组(均P<0.05)。见表4。


时间CD3+CD4+CD8+CD4+/CD8+NK对照组(n=23)化疗前72 84±4 5748 26±3 7324 66±2 631 86±1 438 13±2 16化疗1周期69 53±5 16①47 67±1 43①22 37±2 45①1 63±2 16①7 53±2 45①化疗2周期58 3±6 62①40 26±2 13①21 69±2 23①1 36±1 73①6 66±2 33①术后7天54 65±3 26①36 66±2 33①19 61±2 13①1 05±1 93①6 16±2 93①观察组(n=23)化疗前72 36±4 3947 86±3 9323 67±2 631 36±1 568 86±2 12化疗1周期72 72±5 16①②49 26±1 47①②24 69±2 43①②1 74±2 03①②9 36±2 57①②化疗2周期78 16±6 23①②50 23±2 16①②27 64±2 23①②1 96±1 33①②10 84±2 66①②术后7天79 43±3 66①②51 83±2 35①②31 61±2 13①②2 46±1 24①②11 23±2 96①②
注:与本组化疗前比较,①P<0.05;与同期对照组比较,②P<0.05
3 讨论
食管癌(EC)是我国常见的恶性肿瘤,因其发病隐匿、早期诊断困难,大多数患者确诊时已是中晚期,治疗效果、预后欠佳[7]。手术前行新辅助化疗有助于缩小肿瘤的体积,减少手术范围及创伤,使部分无法根治的恶性肿瘤降期,达到可以手术根治的目标[8-9]。恶性肿瘤患者免疫功能相对低下,免疫细胞不能有效识别、排斥和杀灭肿瘤细胞是恶性肿瘤发生的根本原因[10]。人体抗肿瘤的主要效应为激活体内的免疫效应系统,主要免疫机制为细胞免疫,通过NK 细胞、T淋巴细胞、巨噬细胞完成[11]。激活后的T淋巴细胞对肿瘤细胞有特异性的杀伤作用。从另一个侧面来说,患者外周血T细胞亚群及NK细胞含量的变化可以说是机体启动抗肿瘤免疫能力的反映[8]。肿瘤细胞的增生与增殖通常为免疫应答减弱的结果[9],同时,大多数老年EC患者免疫功能低下,因此,采取措施提高恶性肿瘤患者的免疫功能对提高恶性肿瘤治疗效率具有积极意义[12]。
研究表明[10],胸腺肽α1可增强抗肿瘤的临床疗效,其主要作用机制为促进T淋巴细胞的成熟与分化。术前给予可以加强T淋巴细胞的功能,继而增强患者机体免疫力,同时,还可恢复部分受抑制的免疫功能,增强机体抗肿瘤能力。术前胸腺肽α1新辅助化疗与传统术后化疗相比,具有诸多优点:①可于术前实现肿瘤“降体积”、“降期”,进而提高手术根治切除率,使部分患者达到病理学完全缓解(pathologic complete response,PCR);②提高食管癌患者功能恢复;③降低肿瘤切缘阳性率,从而减少术后肿瘤原位复发率;④为手术创造机会或减少术后复发,减小毒性反应及手术吻合口放射性损伤[13-14]。目前,术前胸腺肽α1新辅助化疗已成为综合治疗EC的一项重要手段,广泛应用于临床中。
在本研究中,化疗1周期、2周期和术后7 d,治疗组T细胞亚群水平均显著高于对照组,且术后7 d治疗组的T细胞亚群增加幅度大于化疗1周期、2周期后。机体在患肿瘤状态下,T细胞功能不全或受到抑制,表现为T细胞数量减少、功能改变和T细胞亚群比例失调[15],本研究结果表明治疗组患者淋巴细胞亚群比例逐渐增加,细胞免疫功能逐渐增强。同时,两周期化疗结束后,在粒细胞减少上,治疗组与对照组的差异更显著,同时治疗组不良反应显著少于对照组;尽管两组术后并发症比较差异无统计学意义,但治疗组肺部感染发生率显著低于对照组。治疗组不同时期NK细胞含量均显著高于对照组,但术后7 d增长幅度较前减小,这可能与外科手术对患者的应激影响有关。
综上所述,术前胸腺肽α1新辅助化疗应用于Ⅱ、Ⅲ期老年食管癌可显著提高患者对化疗及手术的耐受性,增强患者免疫功能,有利于改善患者生活质量,不良反应小。
[1] Campbell NP,Villaflor VM.Neoadjuvant treatment of esophageal cancer[J].World J Gastroenterol,2010,16(30):3793.
[2] 金芳玲,胡祖良,马海锋,等.新辅助放化疗联合手术与单纯手术治疗局部晚期食管癌的疗效比较[J].实用肿瘤杂志,2011,26(5):2523.
[3] Wolf MC,Stahl M.Curative treatment of oesophageal carcinoma:current options and future developments[J].Radiat Oncol,2011,6(10):55.
[4] Garaci E,Pica F,Serafino A,et al.Thymosin alphal and cancer:action on immune effector and tumor target cells[J].Ann N Y Acad Sci,2012,1269(1):26.
[5] 沈 冬,卞秀华,放疗同步FOLFOX方案治疗Ⅲ期食管癌的临床观察[J].中华肿瘤防治杂志,2011,17(22):1849.
[6] 周 俊,陈宏俊,夏 洪,新辅助化疗对老年食管癌患者生活质量和手术根治率的影响[J].江苏大学学报(医学版),2010,20(6):546.
[7] Schrag D,Weiser M R,Goodman K A,et al.Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer:a pilot trial[J].J Clin Oncol,2014,32(6):513.
[8] Shueng P W,Shen B J,Wu L J,et al.Concurrent image-guided intensity modulated radiotherapy and chemotherapy following neoadjuvant chemotherapy for locally advanced nasopharyngeal carcinoma[J].Radiat Oncol,2011,6(1):95.
[9] Kim S H,Lee J Y,Lee J M,et al.Apparent diffusion coefficient for evaluating tumour response to neoadjuvant chemoradiation therapy for locally advanced rectal cancer[J].Eur Radiol,2011,21(5):987.
[10] Shia J,McManus M,Guillem J G,et al.Significance of acellular mucin pools in rectal carcinoma after neoadjuvant chemoradiotherapy[J].Am J Surg Pathol,2011,35(1):127.
[11] Van Cutsem E,Dicato M,Geva R,et al.The diagnosis and management of gastric cancer:expert discussion and recommendations from the 12th ESMO/World Congress on Gastrointestinal Cancer,Barcelona,2010[J].Ann Oncol,2011,22(5):1.
[12] Wu XX,Sun Y,Guo WJ,et al.Rebuilding the balance of STAT1 and STAT3 signalings by fusaruside,a cerebroside compound,for the treatment of T-cell-mediated fulminant hepatitis in mice[J].Biochem Pharmacol,2012,84(9):1164.
[13] 李 青,冯奉仪,张湘茹,等.全身化疗加或不加胸腺肽α1治疗晚期非小细胞肺癌[J].中国肿瘤临床,2011,28(3):201.
[14] 熊发亮,贾 玲,刘春生,等.化疗联合胸腺肽α1 治疗乳腺癌的基础与临床观察[J].中国医药,2010,5(4):357.
[15] Cathcart M C,Gately K,Cummins R,et al.Thromboxane synthase expression and correlation with VEGF and angiogenesis in non-small cell lung cancer[J].Bba-Mol Basis Dis,2014,1842(5):747.

