Exendin-4通过下调Wnt5a基因表达促进胰岛β细胞瘤INS-1细胞增殖
吴杏儿,赵丽辉,陈应智,孙世珺
(中山市人民医院1.分子诊断中心,2.病理科,广东 中山528403)
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)及其受体激动剂 Exendin-4(Exd-4)作为糖尿病治疗药物,对2型糖尿病患者具有刺激葡萄糖依赖的胰岛素分泌、减少胰岛β细胞凋亡及促进β细胞增殖等作用[1]。Exd-4与多个参与调节β细胞功能的细胞内信号通路相互作用,其中包括Wnt信号通路。Wnt信号通路在细胞增殖、存活、迁移及分化等过程发挥重要的调控作用[2-3]。近年研究发现,Exd-4可通过调控如Wnt4等Wnt信号通路配体基因表达,影响β细胞增殖[4]。这种现象提示Wnt配体可能是介导Exd-4调节β细胞增殖活性的重要蛋白分子。Wnt5a是人类及大鼠Wnt配体家族的重要成员,在胰腺组织中基础表达丰度高,对脊椎动物胚胎发育过程中胰岛形成起重要作用。本实验通过研究Exd-4对大鼠胰岛β细胞瘤INS-1细胞中Wnt5a基因表达的调控,探讨Exd-4调控β细胞增殖的新机制。
1 材料与方法
1.1 材料
大鼠胰岛 β细胞瘤 INS-1细胞(ATCC细胞库)。小牛血清和RPMI-1640培养基(美国Gibco公司);Exd-4、2-巯基乙醇、4-羟乙基哌嗪乙磺酸(HEPES)、二甲亚砜(美国Sigma公司);siRNA由广州吉捷生物科技有限公司合成提供(包括无意义序列、序列1、序列2和序列3);重组人/鼠Wnt5a蛋白(美国R&D system公司);EdU试剂盒购自锐博生物技术公司;转染试剂脂质体2000、PCR引物(美国Invitrogen公司);兔抗鼠Wnt5a抗体、兔抗鼠GAPDH抗体(美国Cell Signal Technology公司);辣根过氧化酶标记IgG购自杭州弗德生物技术有限公司;Eastep通用型总RNA提取试剂盒、GoScriptTM反转录试剂盒、GoTaq®qPCR Master Mix(美国 Promaga公司)。
荧光定量PCR仪7500(ABI公司);倒置荧光显微镜(日本奥林巴斯公司)。
1.2 细胞培养
将大鼠胰岛β细胞瘤INS-1细胞培养在37℃、含5%CO2培养箱,每100 mL细胞培养液含有10%
小牛血清、1%青-链霉素双抗、1%2-巯基乙醇35 μL、碳酸氢钠 0.2 g、10μmol/L HEPES 0.1 mL。以含0.25%胰酶消化细胞传代,每隔24 h更换1次培养液。
1.3 Edu标记染色法检测INS-1细胞增殖率
1.3.1 细胞分组 Exd-4刺激细胞实验中细胞分8组:PBS溶剂对照组以及 1、5、10、25、50、75及 100 nmol/L共7个浓度Exd-4处理组。共培养24 h后进行细胞染色计数。
Exd-4及重组Wnt5a蛋白共培养实验中细胞分6组:50 nmol/L Exd-4处理组,50 nmol/L Exd-4+重组 Wnt5a蛋白5种浓度(50、100、250、500、1 000 ng/mL)共培养组。共培养24 h后进行细胞染色计数。
1.3.2 细胞染色 细胞以 4×104/孔密度种植至铺有盖玻片的24孔板,细胞贴壁后更换培养基,进行转染或共培养,离观察终点2 h前往培养基中加入EdU溶液(终浓度为50μmol/L),按试剂盒说明固定细胞、染色及铺片。
1.3.3 倒置显微镜下计数细胞增殖率 观察Appolo567染色使用550 nm激发光,观察Hoechst3342染色使用350 nm激发光(放大倍数为400×)。每复孔等分4象限,每象限随机拍摄3张不同视野照片并计数,分别计算Hoechst(细胞核)及Appolo(增殖细胞)染色细胞数,Appolo/Hoechst比值为细胞增殖率,每复孔Hoechst染色阳性细胞计数 >1 000个。同组设3个复孔,取增殖率平均数及标准差。
1.4 细胞转染
将INS-1细胞分为4组:无意义siRNA转染组,Wnt5a-siRNA-1转染组,Wnt5a-siRNA-2转染组和Wnt5a-siRNA-3转染组。按LipofectamineTM2000转染试剂盒操作说明,分别将含有1μg无意义siRNA,Wnt5a-siRNA-1(上游:5′-CAAGGAAUUCGUGGACGCACGAGAAdTd-3′,下游:5′-UUCUCGUGCGUCCACGAAUUCCUUGdTd-3′),Wnt5a-siRNA-2(上游:5′-GCAUCCUCAUGAACUUGCACAACAAdTd-3′,下游:5′-UUGUUGUGCAAGUUCAUGAGGAUGCdTd-3′)及 Wnt5a-siRNA-3(上 游:5′-GGACAGUAUACAACCUGGCAGAUGUdTd-3′,下游:5′-ACAUCUGCCAGGUUGUAUACUGUCCdTd-3′)稀释液加入含无血清培养基的EP管中混匀,缓慢加入到含1μL LipofectamineTM2000的50μL无血清培养基中,混匀后室温静置20 min形成转染复合物。使用转染复合物培养INS-1细胞6~8 h后吸出转染复合物,换含有血清的培养基继续培养,总培养时间为36 h。收集细胞用于蛋白印迹检测或EdU标记染色进行细胞增殖率计数。
1.5 半定量 RT-PCR检测 INS-1细胞 Wnt5a的表达
将细胞分为3组:PBS溶剂对照组、50 nmol/L Exd-4处理细胞12 h组和24 h组。按试剂盒说明柱提法冰面操作提取对数生长期细胞总RNA,进行逆转录。反应条件:25℃退火5 min,延伸1 h,70℃灭活15 min。cDNA样本-20℃保存备用。RTPCR反应总体系为20μL,包括反转录产物样本5 μL,无酶核酸水4μL,引物0.8μL,Master Mix2×10 μL,CXR100×0.2μL。反应条件:95℃10 min,95℃15 s后60℃1 min(40个循环)。
采用2-△△Ct方法计算Wnt5a相对表达量,内标基因为 β-肌动蛋白。ΔΔCt=实验组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因)。
1.6 蛋白质印迹法检测INS-1细胞Wnt5a的表达
将INS-1细胞分为6组,对照组加入PBS,其余5组分别采用 50 nmol/L Exd-4处理 1、3、6、12、24 h。至观察终点弃去培养基加入RIPA裂解液提取细胞总蛋白。12%SDS-PAGE分离蛋白质,转膜,4%BSA封闭2 h,TBST洗膜3次后加兔抗Wnt-5a一抗(1∶1 000),4℃孵育过夜,洗膜3次加二抗(1∶5 000)室温孵育1 h,洗膜后再在暗室中加入发光剂,显影后定影。以GAPDH为内参,Image J软件灰度扫描图像检测Wnt5a蛋白的表达。
1.7 统计学方法
每组设置3次重复独立实验,每个处理组至少重复3个复孔,采用SPSS 11.0统计软件处理数据,结果均以均数±标准差(±s)表示。采用单因素方差分析或t检验,置信区间为95%,P<0.05为差异具有统计学意义。
2 结果
2.1 Exd-4对INS-1细胞增殖的影响
使用不同浓度的Exd-4处理INS-1细胞24 h后,EdU标记染色实验显示,Exd-4呈浓度依赖性促进INS-1细胞增殖。与 PBS组比较,自10 nmol/L浓度起Exd-4能显著提高INS-1细胞增殖率(均P<0.01);50 nmol/L Exd-4促进 INS-1增殖达最大效应。见图1。
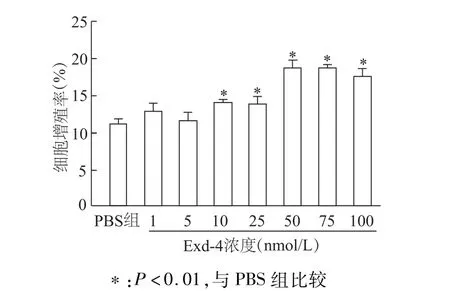
图1 不同浓度Exd-4对INS-1细胞增殖率的影响
2.2 Exd-4下调INS-1细胞中Wnt5a基因的表达
半定量RT-PCR检测结果显示,Exd-4处理12 h、24 h后,INS-1细胞Wnt5amRNA转录水平比PBS对照组显著下降(均P<0.05)。见图2。使用50 nmol/L Exd-4刺激细胞进行时间梯度实验,蛋白质印迹检测结果显示,经Edx-4处理6 h后细胞Wnt5a蛋白水平显著下降(均P<0.01)。见图3。
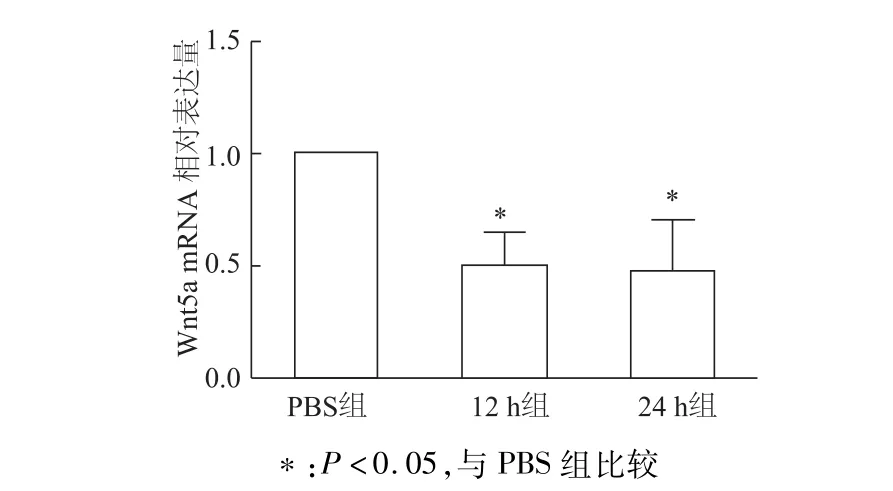
图2 Exd-4处理后INS-1细胞中W nt5a mRNA的表达
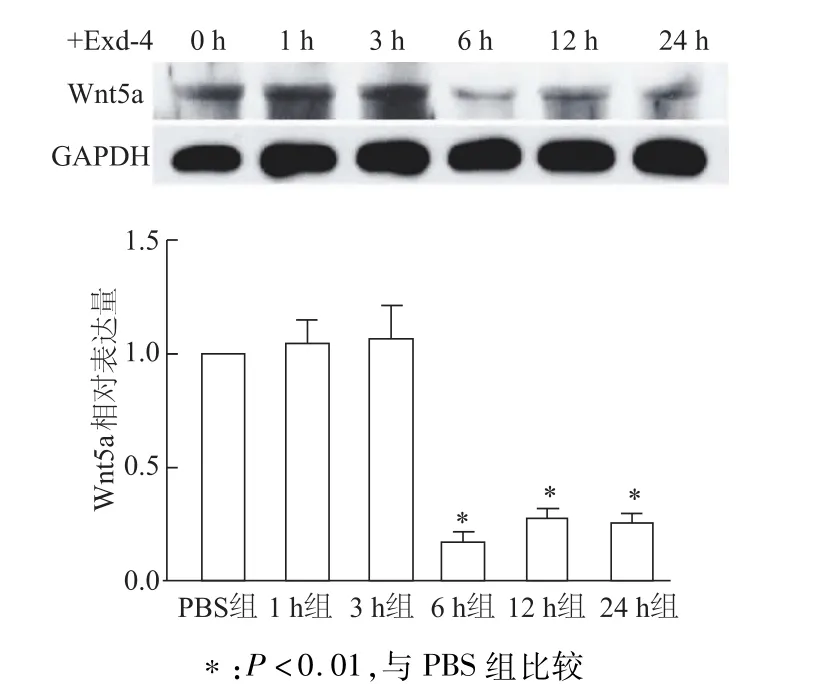
图3 蛋白质印迹检测经Exd-4处理不同时间后INS-1中W nt5a蛋白水平
2.3 Wnt5a对INS-1细胞增殖的影响
蛋白质印迹检测结果显示,3种不同序列siRNA-Wnt5a均能有效沉默INS-1中Wnt5a基因表达(图4)。EdU标记染色法检测结果显示,与无意义siRNA转染组比较,siRNA沉默Wnt5a后细胞增殖率明显升高(P<0.01)。见图5。上述结果表明,基础状态下Wnt5a是抑制INS-1细胞增殖的重要调控因子。
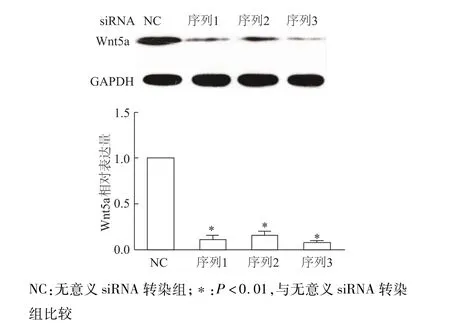
图4 蛋白质印迹检测经siRNA转染后各组INS-1细胞W nt5A的表达
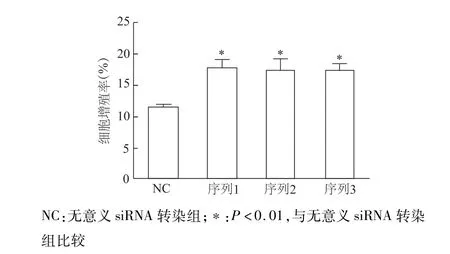
图5 EdU标记法检测siRNA沉默Wnt5a基因后INS-1细胞增殖率
2.4 Wnt5a介导Exd-4调控INS-1细胞增殖
培养基中加入不同浓度重组Wnt5a蛋白与50 nmol/L Exd-4共培养,EdU标记染色法检测结果显示,与不加Exd-4组比较,加入各种浓度Exd-4均能明显降低INS-1细胞增殖率(均P<0.01),且呈浓度依赖性。说明重组Wnt5a蛋白呈浓度依赖性拮抗Exd-4对INS-1细胞的促增殖作用。见图6。
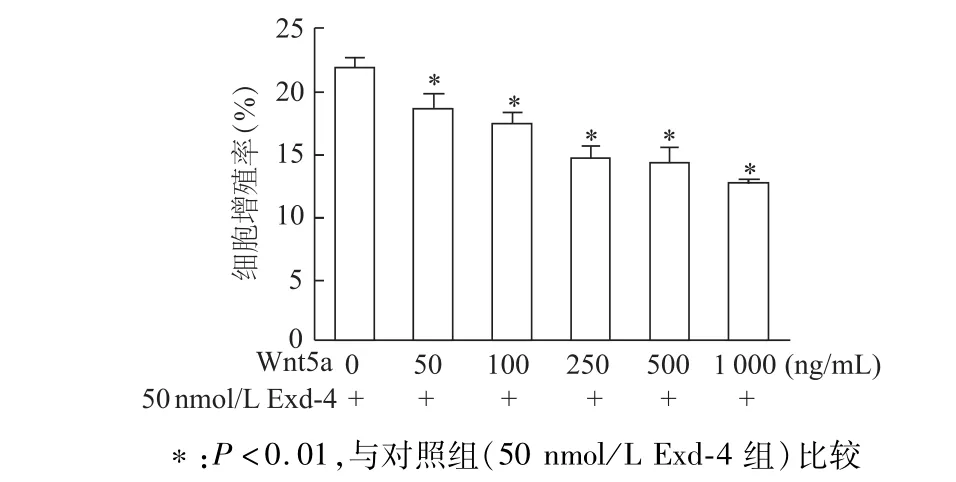
图6 EdU标记法检测不同浓度重组W nt5a蛋白对Exd-4诱导的细胞增殖影响
3 讨论
Exd-4作为GLP-1受体长效激动剂,已被体内外实验证实具有促β细胞增殖效应[5]。GLP-1及Exd-4可通过调控细胞内经典Wnt信号通路影响细胞增殖。Exd-4与细胞膜上GLP-1受体结合后引起胞内 cAMP聚集,激活 cAMP依赖蛋白激酶 A(cAMP-dependent protein kinase A,PKA),PKA对β-catenin第675位丝氨酸残基进行磷酸化修饰,使胞质β-catenin稳定性增加,更多β-catenin进入细胞核内与TCF7L2等转录因子结合成具有转录活性的复合体,调节下游有关细胞周期的靶基因表达,促进 β细胞增殖[6]。
遗传高度保守的Wnt信号通路对胚胎及出生后胰岛β细胞的发育和功能调节都有重要的作用[7-8],该通路的信号分子在胰岛β细胞中有不同程度的表达[9]。然而,既往关于 GLP-1/Exd-4与Wnt信号通路的研究,焦点多集中于Exd-4对该通路受体水平以下的信号调节,至于Exd-4能否调控Wnt信号通路源头——第一信号分子的Wnt配体表达,目前鲜有报道。
Wnt基因家族编码一系列富含半胱氨酸的分泌型糖蛋白,目前已知鼠及人类Wnt基因家族有19个成员,Wnt蛋白通过自分泌、旁分泌及内分泌等方式与细胞膜上受体结合,不同的Wnt亚型对细胞的生物学行为起不同的效应[10]。相关研究显示,在小鼠及斑马鱼等动物胚胎模型中,Wnt5a及其相应受体(如Frizzled-2)在胰岛中广泛表达;对小鼠胚胎过表达Wnt5a cDNA,观察到胰岛组织较对照组缩小;以吗啉基下调斑马鱼胚胎中Wnt5a基因表达后,分泌胰岛素的细胞迁移受到影响,与对照组形成的典型胰岛结构相比,Wnt5a低表达导致多个较小的细胞岛形成[11]。这些实验说明Wnt5a可能对胰岛及β细胞的发育迁移起重要作用。至于Wnt5a对胰岛β细胞增殖起何作用,Wnt5a能否介导Exd-4调控β细胞增殖,目前尚无文献报道。
本研究结果显示,GLP-1受体长效激动剂Exd-4促进大鼠胰岛β细胞瘤细胞系INS-1增殖,并同时抑制Wnt5a基因表达。通过转染siRNA沉默Wnt5a基因并观察细胞增殖率变化,证实Wnt5a是抑制大鼠β细胞瘤细胞增殖的重要调控因子。本研究进一步在细胞培养基中加入鼠/人重组Wnt5a蛋白与Exd-4进行共培养,发现Wnt5a重组蛋白可有效拮抗Exd-4引起的促INS-1细胞增殖效应。上述结果提示Exd-4可能通过调控Wnt5a表达影响β细胞增殖。
目前,尚无研究揭示Exd-4调控Wnt5a基因表达的具体机制。如前述,Exd-4与GLP-1受体结合后通过聚集cAMP激活PKA,有研究指出PKA激活后可抑制TGF-β对下游通路信号分子的诱导表达[12]。在乳腺癌细胞中,TGF-β通过调控转录因子CUTL1而进一步调控其下游的Wnt5a基因表达,增强细胞转移能力[13]。也有报道称Exd-4可下调db/db小鼠肾脏及人间充质干细胞中 TGF-β1的表达[6,14]。故此推测胰岛β细胞中的Exd-4可能通过激活GLP-1受体后抑制TGF-β,从而调控Wnt5a基因表达。但确切的机制还需进一步的实验证实。
本研究发现Wnt5a可抑制大鼠β细胞瘤细胞的基础增殖,并拮抗Exd-4对INS-1细胞的促增殖作用。已有大量研究证实,Exd-4/GLP-1受体通过激活PKA促进β-catenin入核,促进下游如Cyclin D1等细胞周期因子转录[6]。Wnt5a可通过激活CaMKⅡ下调Cyclin D1表达,从而抑制小鼠B淋巴细胞增殖[15]。此外,另有研究显示 Wnt5a可降低β-catenin稳定性,抑制与DNA结合的T细胞因子转录活性从而拮抗经典Wnt信号通路[16]。目前非经典Wnt通路配体Wnt5a调控胰岛β细胞增殖的通路机制尚有待于后续研究进一步探索。
综上所述,本项研究结果显示,Exendin-4通过下调Wnt5a基因表达,促进大鼠胰岛β细胞瘤细胞增殖。该结果提示Wnt5a可能是调节β细胞数量的重要因子。但Exendin-4调控Wnt5a基因表达的具体机制仍有待进一步研究揭示。
[1]Holst JJ.Treatment of type 2 diabetesmellitus with agonists of the GLP-1 receptor or DPP-IV inhibitors[J].Expert Opin Emerg Drugs,2004,9(1):155-166.
[2]Gordon MD,Nusse R.Wnt signaling:multiple pathways,multiple receptors,and multiple transcription factors[J].JBiol Chem,2006,281(32):22429-22433.
[3]Moon RT,Kohn AD,De Ferrari GV,et al.WNT andβcatenin signalling:diseases and therapies[J].Nat Rev Genet,2004,5(9):691-701.
[4]Heller C,Kühn MC,Mülders-Opgenoorth B,et al.Exendin-4 upregulates the expression ofWnt-4,a novel regulator of pancreaticβ-cell proliferation[J].Am J Physiol Endocrinol Metab,2011,301(5):E864-872.
[5]Wang Q,Li L,Xu E,etal.Glucagon-like peptide-1 regulates proliferation and apoptosis via activation of protein kinase B in pancreatic INS-1βcells[J].Diabetologia,2004,47(3):478-487.
[6]Liu Z,Habener JF.Glucagon-like peptide-1 activation of TCF7L2-dependentWnt signaling enhances pancreaticβ cell proliferation[J].J Biol Chem,2008,283(13):8723-8735.
[7]Rulifson IC,Karnik SK,Heiser PW,et al.Wnt signaling regulates pancreaticβcell proliferation[J].Proc Natl Acad Sci U SA,2007,104(15):6247-6252.
[8]Murtaugh LC.The what,where,when and how ofWnt/β-catenin signaling in pancreas development[J].Organogenesis,2008,4(2):81-86.
[9]Heller RS,Klein T,Ling Z,et al.Expression of Wnt,Frizzled,sFRP,and DKK genes in adult human pancreas[J].Gene Expr,2003,11(3/4):141-147.
[10]Kühl M.Non-canonicalWnt signaling in Xenopus:regulation of axis formation and gastrulation[J].Semin Cell Dev Biol,2002,13(3):243-249.
[11]Kim HJ,Schleiffarth JR,Jessurun J,etal.Wnt5 signaling in vertebrate pancreas development[J].BMC Biol,2005,3:23.
[12]Stratton R,Rajkumar V,Ponticos M,et al.Prostacyclin derivatives prevent the fibrotic response to TGF-βby inhibiting the Ras/MEK/ERK pathway[J].The FASEB J,2002,16(14):1949-1951.
[13]Ripka S,König A,Buchholz M,et al.WNT5A-target of CUTL1 and potentmodulator of tumor cellmigration and invasion in pancreatic cancer[J].Carcinogenesis,2007,28(6):1178-1187.
[14]Schinner S,Ulgen F,Papewalis C,et al.Regulation of insulin secretion,glucokinase gene transcription and beta cell proliferation by adipocyte-derived Wnt signalling molecules[J].Diabetologia,2008,51(1):147-154.
[15]Liang H,Chen Q,Coles AH,et al.Wnt5a inhibits B cell proliferation and functions as a tumor suppressor in hematopoietic tissue[J].Cancer Cell,2003,4(5):349-360.
[16]Topol L,Jiang X,Choi H,et al.Wnt-5a inhibits the canonical Wnt pathway by promoting GSK-3-independent β-catenin degradation[J].JCell Biol,2003,162(5):899-908.

