LSD1对非小细胞肺癌细胞增殖与迁移的影响
洪娟,王冬青,殷瑞根,赵天,朱彦
(江苏大学附属医院影像科,江苏镇江212001)
赖氨酸特异性组蛋白去甲基化酶1(lysine-specific demethylase 1,LSD1)是一种高度保守的 FAD依赖性胺氧化酶,可通过氧化去除底物甲基化的H3K4、H3K9的甲基,也可去除组蛋白以外结构上的甲基,从而影响基因表达[1-2]。诸多研究证实,LSD1过表达与多种肿瘤如乳腺癌、前列腺癌等发展、侵袭及预后不良相关[3-8]。此外,据报道,LSD1的小分子抑制剂在血液系统肿瘤及实体肿瘤的治疗中显示出良好的治疗前景[9-10],抑制 LSD1表达后可阻止上皮间质转化(EMT)的进程从而延缓前列腺癌的进展[11]。本研究通过比较LSD1在非小细胞肺癌(non-small cell lung cancer,NSCLC)组织和细胞中的表达,分析其与临床病理特征的关系;探讨外源性干扰LSD1表达后,细胞一系列生物学功能的改变及调节机制。
1 材料与方法
1.1 材料
1.1.1 病例 收集2010年3月至2013年3月于江苏大学附属医院胸外科行部分肺叶切除的52例NSCLC患者肺癌组织及癌旁组织(距离肿瘤边缘>5 cm)。其中,男31例,女21例。年龄41~78岁,所有患者术前均未行放疗、化疗,所有标本均经过病理证实。其中,鳞癌25例,腺癌27例。
1.1.2 试剂及仪器 NSCLC细胞株A549及人支气管上皮细胞株16HBE购自中国科学院上海细胞所;RPMI 1640、DMEM、胎牛血清(美国 Gibco公司);RNA抽提剂 Trizol、LSD1小干扰 RNA(si-LSD1)、阴性对照、转染试剂Lipofectamine 2000(美国Invitrogen公司);Transwell小室(美国Millipore公司);MTT(美国Cell Signaling Technology公司);qRT-PCR试剂盒(日本TaKaRa公司);E-钙黏蛋白、波形蛋白及对照GAPDH抗体均为美国Santa Cruz公司产品。
1.2 方法
1.2.1 A549肺癌细胞培养、分组与转染 在37℃、相对湿度及5%CO2条件下,将A549肺癌细胞置于含10%胎牛血清的1640培养液中培养。同时,用含10%胎牛血清的DMEM培养肺正常上皮16HBE细胞。取对数生长期A549肺癌细胞,并于转染前24 h接种至6孔板(3×105个/孔),继续培养,待细胞生长融合度达70%~80%时进行转染。转染依照说明书,将10μL si-LSD1转染入A549细胞中(si-LSD1组),另转染阴性对照作为对照组,在37℃及5%CO2培养箱中继续培养,用于后续相关实验检测。
1.2.2 qRT-PCR检测 LSD1和 EMT相关蛋白的mRNA表达 用Trizol提取组织和细胞总RNA,行反转录获得cDNA,然后对产物进行扩增。GAPDH引物序列,上游:5′-GCAAATTCCATGGCACGTC-3′,下游:5′-TCGCCCCACTTGATTTTGG-3′;LSD1引物序列,上 游:5′-CAAGTGTCAATTTGTTCGGG-3′,下游:5′-TTCTTTGGGCTGAGGTACTG-3′;E-钙黏蛋白引物序列,上游:5′-AAACCTTGCCTTCTTTGTC-3′,下游:5′-TTCCCAACTCCTCTCCTG-3′,波形蛋白引物序列,上游:5′-CGGTTCGCCAACTACAT-3′,下游:5′-AGGGC-ATCCACTTCACAG-3′。PCR反应条件:90℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环。以 GAPDH作为内参,采用2-ΔΔCt法计算LSD1相对表达量。
根据NSCLC组织中LSD1相对表达量的中位数,将NSCLC患者分为LSD1低表达组(≤中位数)和高表达组(>中位数)。
1.2.3 MTT比色法实验 取“1.2.1”转染后细胞,接种于96孔板,每孔2×103个,每组6个复孔,获得单细胞悬液,37℃及5%CO2饱和湿度培养24~96 h;每孔加入5 mg/mL MTT 20μL,孵育4 h;弃培养基,加入DMSO 150μL/孔,振荡10min;待结晶物充分溶解,于酶标仪490 nm处检测各孔光密度(D)值。
1.2.4 细胞集落形成实验 取“1.2.1”转染后细胞,接种于6孔板,每孔1×103个,吹打至均匀,继续培养;4 d后更换培养基,继续培养;直至10 d后培养基内肉眼可见克隆终止培养;4%甲醇固定约15 min;结晶紫染色10 min;洗净并晾干。
1.2.5 细胞凋亡检测 取“1.2.1”转染后细胞,收集3×105个,加入100μL结合缓冲液,使细胞悬浮;顺序加入5μL Annexin V及5μL PI,混匀,于室温避光孵育15 min;加入400μL结合缓冲液,运用流式细胞仪检测细胞凋亡。
1.2.6 Transwell迁移实验 取“1.2.1”转染后细胞,调整细胞浓度为1×105个/mL,分别将300μL细胞悬液和700μL含10%胎牛血清的RPMI 1640加入每个Transwell上室和下室,并于37℃,5%CO2条件下培养48 h;取出Transwell小室,吸弃液体,医用棉签擦净内部基底膜;PBS漂洗,4%低聚甲醛固定10 min;结晶紫染液染色20 min;清水漂洗,显微镜下观察并拍照。
1.2.7 蛋白质印迹法检测E-钙黏蛋白和波形蛋白的表达 用全蛋白裂解液提取待测细胞总蛋白;上样30μg,行 SDS-PAGE;转至 PVDF膜,TBST(含5%脱脂牛奶)封闭2 h;1×TBST洗膜4次,每次5 min;一抗波形蛋白(1∶200)、E-钙黏蛋白(1∶250)、GAPDH(1∶1 000),4℃孵育过夜;洗膜,加入相应二抗(1∶3 000),室温孵育2 h;1×TBST洗膜3次;暗室ECL发光显色并行曝光拍照。
1.3 统计学方法
采用统计软件SPSS 15.0分析数据,计量资料用均数±标准差(±s)表示,采用独立样本t检验,率的比较采用χ2检验,所有实验均重复3次。P<0.05为差异有统计学意义。
2 结果
2.1 LSD1在NSCLC癌组织中的表达及其与临床病理特征的关系
qRT-PCR检测结果如图1所示,与癌旁组织相比,NSCLC组织中 LSD1表达明显增高(t=2.861,P<0.05)。由表1可见,LSD1表达量与NSCLC患者 TNM分期及淋巴结转移相关(χ2=4.062,6.047,P<0.05),中晚期及转移患者LSD1呈高表达,而患者年龄、性别、吸烟、肿瘤直径、病理分型与LSD1水平未见明显关系。
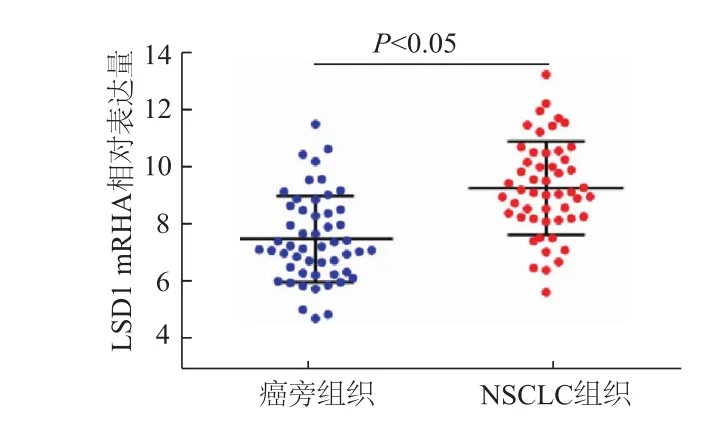
图1 NSCLC组织和癌旁组织中LSD1 mRNA表达比较
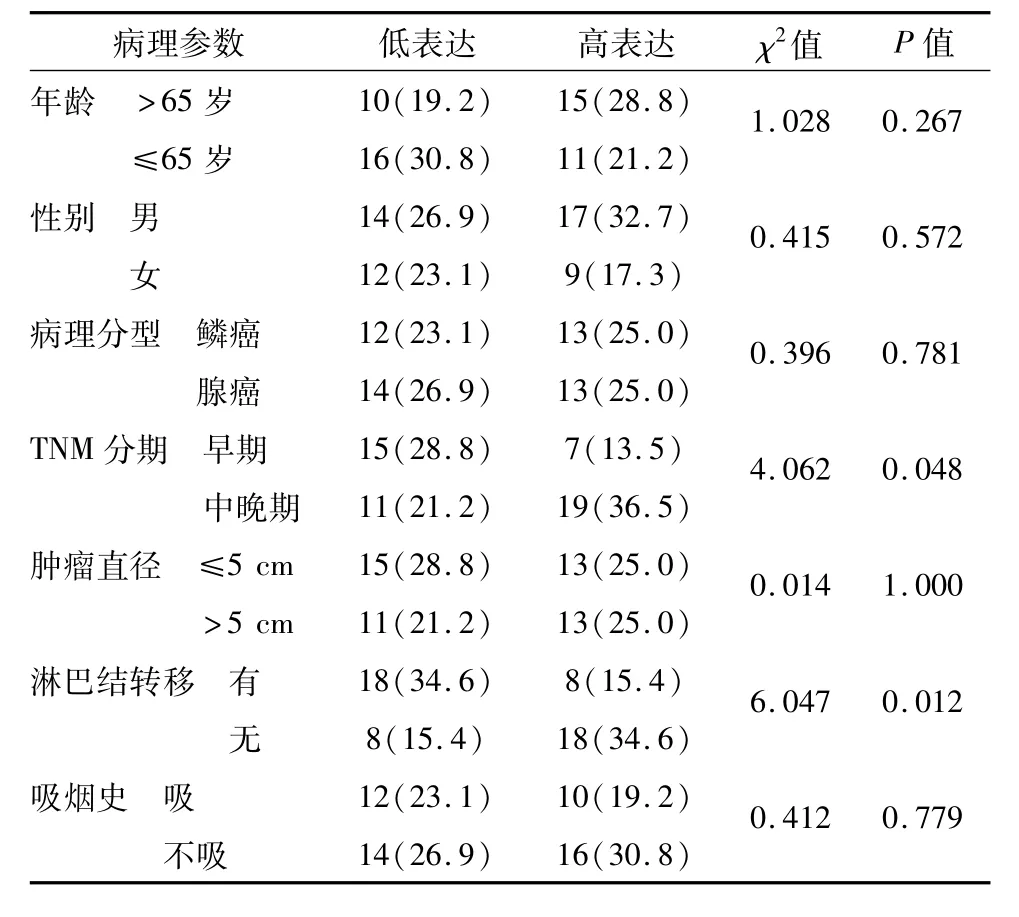
表1 LSD1 mRNA表达与NSCLC患者临床病理特征的关系 例(%)
2.2 LSD1在肺癌细胞中的表达量以及si-LSD1的干扰效率
如图2所示,LSD1在A549细胞中表达量明显高于16HBE细胞(t=3.569,P<0.05)。为验证 si-LSD1的干扰效率,在转染48 h后,qRT-PCR检测显示,si-LSD1组A549细胞LSD1表达量较对照组明显下降(t=4.825,P<0.05),干扰效率达 80%以上,可用于后续实验。
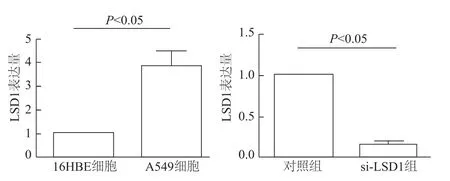
图2 qRT-PCR检测细胞中LSD1 mRNA的表达
2.3 LSD1对A549细胞增殖能力的影响
如图3所示,MTT实验结果显示,与对照组相比,在48、72、96 h时si-LSD1转染组细胞增殖能力均较对照组低(P<0.05),表明si-LSD1转染组细胞增长速度受到抑制;克隆形成实验显示转染si-LSD1组细胞克隆形成能力降低。由此可见,干扰A549细胞中LSD1表达后,细胞增殖能力下降。
2.4 LSD1对A549细胞凋亡的影响
流式细胞检测分析显示,与对照组相比,转染si-LSD1组细胞凋亡率明显增加(t=3.618,P<0.05)。由此表明,抑制LSD1表达可促进A549细胞凋亡。见图4。
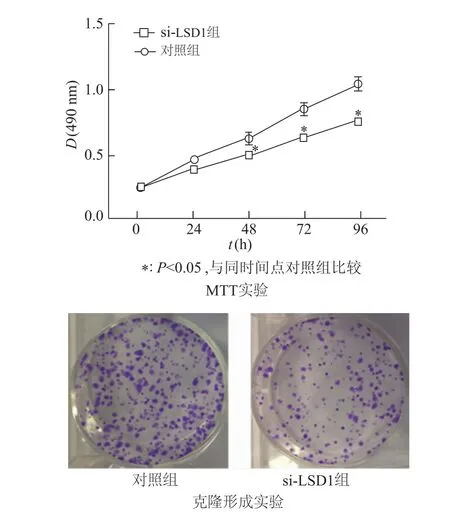
图3 各组细胞增殖力比较
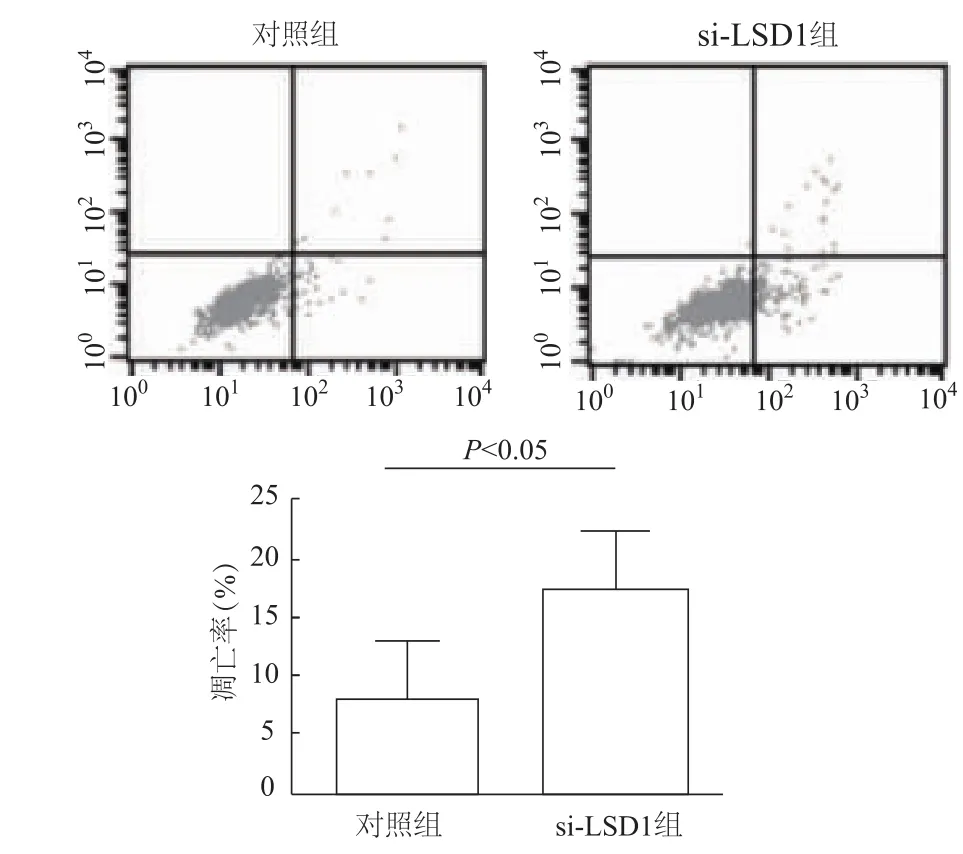
图4 各组细胞凋亡率比较
2.5 LSD1对细胞迁移能力的影响
Transwell实验检测结果显示,与对照组相比,si-LSD1转染组细胞穿透基膜的能力明显降低。由此说明,干扰LSD1表达后能够明显抑制A549细胞的迁移能力。见图5。
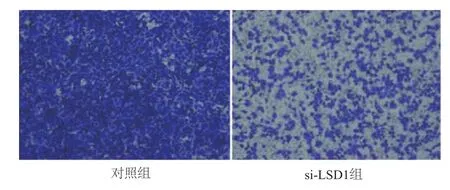
图5 Transwell实验检测细胞的迁移能力
2.6 LSD1对EMT相关分子的调控作用
qRT-PCR结果显示,与对照组相比,转染 si-LSD1组上皮标志分子E-钙黏蛋白mRNA水平上调,间质标志分子波形蛋白mRNA表达下调;蛋白质印迹法结果显示,与对照组相比,转染si-LSD1组E-钙黏蛋白表达水平增加(t=5.607,P<0.05),波形蛋白表达降低(t=-6.628,P<0.05)。见图6。综上,LSD1可能通过调控EMT相关分子的表达,参与A549细胞增殖与迁移的调控。
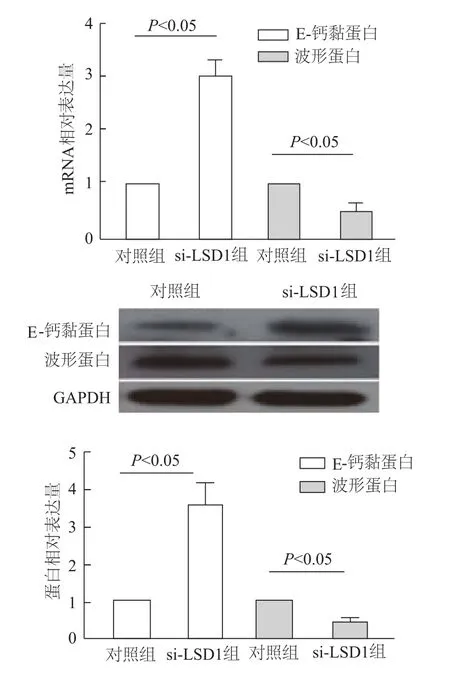
图6 EMT相关分子mRNA和蛋白的表达
3 讨论
LSD1是胺氧化酶家族的重要成员,亦称KIAA0601、AOF2、KDM1,在肿瘤发生、发展、侵袭、转移中的作用已得到诸多研究者的认同[3-5],如LSD1与肿瘤抑制基因p53相互作用,与脱乙酰基酶复合物(NuRD)形成LSD1/NuRD影响肿瘤的进展及侵袭的关键信号通路TGF-β,调节人端粒酶逆转录酶(hTERT)等[6-8]。近来研究发现,LSD1介导的EMT可能通过调控转录因子表达及miRNA转录后修饰影响肿瘤的侵袭与转移能力[12]。另有文献证实,LSD1高表达与表皮生长因子(EGF)信号过度激活有关,活化的EGF信号通路能够促进LSD1表达;反之,抑制LSD1表达,可阻断EGF诱导的卵巢癌细胞增殖与迁移[13]。无疑,LSD1可能是转移性肿瘤的一个潜在治疗靶点,并提示其在肿瘤增殖与迁移中的研究价值。关于肿瘤微环境与代谢的研究进一步证实LSD1可抑制细胞线粒体呼吸、促进糖酵解途径,从而加速食管癌细胞的代谢,增强食管癌细胞的转移和侵袭能力,并加强其恶性生物学行为[14]。
本研究显示在中晚期及转移性NSCLC患者癌组织中LSD1表达增加,且与肿瘤分期及淋巴转移相关,不仅阐明LSD1与NSCLC的恶性表型相关,也提示LSD1可能参与NSCLC细胞的增殖与转移能力的调控。朱继云等[12]报道LSD1通过组蛋白修饰实现对前列腺癌、乳腺癌、结肠癌、胰腺癌、卵巢癌、肝癌增殖和迁移的影响。本研究进一步体外实验结果显示,干扰LSD1可显著抑制细胞的增殖和迁移能力,并增加细胞凋亡率,从机制学层面证实LSD1对NSCLC增殖和迁移的影响。现有文献已证实LSD1可通过调节 TGF-β1激活 ERK、NF-κB通路;调控关键蛋白Wnt3a的胞外分泌量来影响Wnt经典通路;另外,LSD1可通过上调EMT的标志蛋白E-钙黏蛋白的表达来激活其启动子[15]。肿瘤细胞增殖和迁移受多种信号通路调控,如Wnt、NF-κB等经典信号通路。本研究未对LSD1对信号通路中蛋白因子的作用行具体分析,其在肿瘤尤其在NSCLC中的作用和机制有待进一步研究。
[1]Metzger E,Wissmann M,Yin N,etal.LSD1 demethylates repressive histone marks to promote androgen-receptor-dependent transcription[J].Nature,2005,437(7057):436-439.
[2]Amente S,Lania L,Majello B.The histone LSD1 demethylase in stemness and cancer transcription programs[J].Biochim Biophys Acta,2013,1829(10):981-986.
[3]Kim J,Singh AK,Takata Y,et al.LSD1 is essential for oocytemeiotic progression by regulating CDC25B expression inmice[J].Nat Commun,2015,6:10116.
[4]Wada T,Koyama D,Kikuchi J,et al.Overexpression of the shortest isoform of histone demethylase LSD1 primes hematopoietic stem cells for malignant transformation[J].Blood,2015,125(24):3731-3746.
[5]Lei ZJ,Wang J,Xiao HL,et al.Lysine-specific demethylase 1 promotes the stemness and chemoresistance of Lgr5+liver cancer initiating cells by suppressing negative regulators ofβ-catenin signaling[J].Oncogene,2015,34(24):3188-3198.
[6]Chen L,Xu Y,Xu B,et al.Over-expression of lysinespecific demethylase 1 predicts tumor progression and poor prognosis in human esophageal cancer[J].Int J Clin Exp Pathol,2014,7(12):8929-8934.
[7]Nagasawa S,Sedukhina AS,Nakagawa Y,et al.LSD1 overexpression is associated with poor prognosis in basallike breast cancer,and sensitivity to PARP inhibition[J].PLoSOne,2015,10(2):e118002.
[8]Ketscher A,Jilg CA,Willmann D,etal.LSD1 controls metastasis of androgen-independent prostate cancer cells through PXN and LPAR6[J].Oncogenesis,2014,3:e120.
[9]Lynch JT,Harris WJ,Somervaille TC.LSD1 inhibition:a therapeutic strategy in cancer?[J].Expert Opin Ther Targets,2012,16(12):1239-1249.
[10]Chen Y,Jie W,Yan W,et al.Lysine-specific histone demethylase 1(LSD1):A potentialmolecular target for tumor therapy[J].CritRev EukaryotGene Expr,2012,22(1):53-59.
[11]Wang M,Liu X,Guo J,et al.Inhibition of LSD1 by Pargyline inhibited process of EMT and delayed progression of prostate cancer in vivo[J].Biochem Biophys Res Commun,2015,467(2):310-315.
[12]朱继云,汪慧访,邱江锋.上皮—间质转化在肿瘤转移中的作用[J].中国生物化学与分子生物学学报,2014,30(12):1169-1175.
[13]Shao G,Wang J,Li Y,et al.Lysine-specific demethylase 1 mediates epidermal growth factor signaling to promote cell migration in ovarian cancer cells[J].Sci Rep,2015,5:15344.
[14]Kosumi K,Baba Y,Sakamoto A,et al.Lysine-specific demethylase-1 contributes tomalignantbehavior by regulation of invasive activity and metabolic shift in esophageal cancer[J].Int JCancer,2016,138(2):428-439.
[15]董奇,丁杰.LSD1与肿瘤转移的研究进展[J].广东医学,2016,37(14):2211-2213.

